
- •Лекция № 55-56 аминокислоты. Пептиды
- •1. Методы получения
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции по аминогруппе Дезаминирование
- •Алкилирование и арилирование
- •Ацилирование
- •2.3. Реакции по карбоксильной группе Декарбоксилирование
- •Этерификация
- •Получение галогенангидридов и ангидридов
- •2.4. Специфические реакции аминокислот
- •Комплексообразование
- •Отношение аминокислот к нагреванию
- •Нингидриновая реакция
- •Строение и классификация
- •Стереоизомерия.
- •Кислотно-основные свойства.
- •Пептиды
- •Строение пептидов
- •Определение аминокислотной последовательности
- •Определение n-концевых аминокислот.
- •Частичный гидролиз полипептидов
- •4.3. Синтез петидов
Лекция № 55-56 аминокислоты. Пептиды
План
Методы получения.
Химические свойства.
Аминокислоты, входящие в состав белков.
Пептиды
Нуклеиновые кислоты
А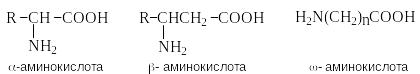 минокислоты
– гетерофункциональные соединения,
содержащие карбоксильную и аминогруппы.
По взаимному расположению функциональных
групп различают -,-,
- и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу
на конце цепи, называют -аминокислотами.
минокислоты
– гетерофункциональные соединения,
содержащие карбоксильную и аминогруппы.
По взаимному расположению функциональных
групп различают -,-,
- и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу
на конце цепи, называют -аминокислотами.
1. Методы получения
А
 ммонолиз
галогензамещенных кислот.
ммонолиз
галогензамещенных кислот.
Метод используется для синтеза -аминокислот из доступных -галогензамещенных кислот.
Метод Штеккера- Зелинского.
В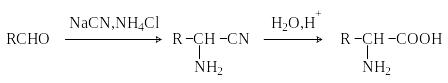 ключает
стадии образования аминонитрила при
взаимодействии альдегида с HCN
и NH3
c
последующим гидролизом его в аминокислоту.
В качестве реагента применяют смесь
NaCN
и NH4Cl.
ключает
стадии образования аминонитрила при
взаимодействии альдегида с HCN
и NH3
c
последующим гидролизом его в аминокислоту.
В качестве реагента применяют смесь
NaCN
и NH4Cl.
Метод применим для синтеза только -аминокислот.
А
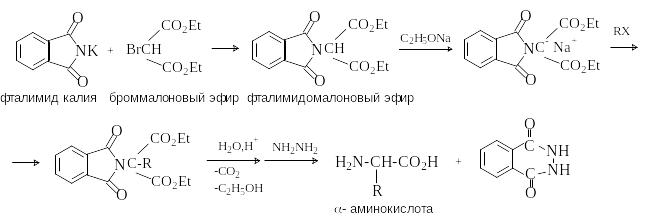 лкилирование
N-фталимидмалонового
эфира.
лкилирование
N-фталимидмалонового
эфира.
4 )
Присоединение аммиака к ,-непредельным
карбоновым кислотам.
)
Присоединение аммиака к ,-непредельным
карбоновым кислотам.
Метод применим для синтеза -аминокислот.
5 )
Из оксимов циклических кетонов
перегруппировкой Бекмана.
)
Из оксимов циклических кетонов
перегруппировкой Бекмана.
Метод используется для синтеза -аминокислот.
2. Химические свойства
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
А минокислоты
содержат кислотный и основный центры
и являются амфотерными соединениями.
В кристаллическом состоянии они
существуют в виде внутренних солей
(биполярных ионов), которые образуются
в результате внутримолекулярного
переноса протона от более слабого
основного центра (СОО-)
к более сильному основному центру (NH2).
минокислоты
содержат кислотный и основный центры
и являются амфотерными соединениями.
В кристаллическом состоянии они
существуют в виде внутренних солей
(биполярных ионов), которые образуются
в результате внутримолекулярного
переноса протона от более слабого
основного центра (СОО-)
к более сильному основному центру (NH2).
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Ф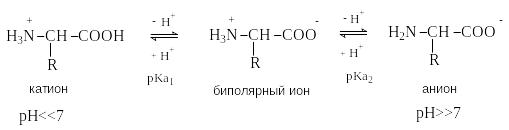 орма
существования аминокислот в водных
растворах зависит от рН. В кислых
растворах аминокислоты присоединяют
протон и существуют преимущественно в
виде катионов. В щелочной среде биполярный
ион отдает протон и превращается в
анион.
орма
существования аминокислот в водных
растворах зависит от рН. В кислых
растворах аминокислоты присоединяют
протон и существуют преимущественно в
виде катионов. В щелочной среде биполярный
ион отдает протон и превращается в
анион.
При некотором
значении рН, строго определенном для
каждой аминокислоты, она существует
преимущественно в виде биполярного
иона. Это значение рН называют
изоэлектрической точкой (рI).
В изоэлектрической точке аминокислота
не имеет заряда и обладает наименьшей
растворимостью в воде. Катионная форма
аминокислоты содержит два кислотных
центра (COOH и NH3+)
и характеризуется двумя константами
диссоциации рКа1 и рКа2.
Значение рI определяется
по уравнению:![]()
2.2. Реакции по аминогруппе Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
RCH(NH2)COOH + HNO2 RCH(OH)COOH + N2 + H2O
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
