Лекции / Лекция_51-52(б)
.DOC
3) Кислотные свойства
Индол представляет собой слабую NH-кислоту (рКа=17) и образует соли при действии сильных оснований, например:
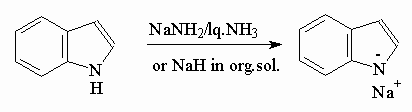
Шестичленные ароматические гетероциклы с одним гетероатомом
Пиридин, хинолин, изохинолин
О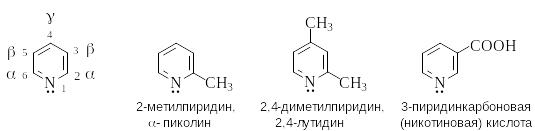 бразуя
названия производных пиридина и его
бензологов, используют нумерацию цикла.
В случае пиридина используют также
буквы греческого алфавита. Некоторые
производные имеют тривиальные названия.
бразуя
названия производных пиридина и его
бензологов, используют нумерацию цикла.
В случае пиридина используют также
буквы греческого алфавита. Некоторые
производные имеют тривиальные названия.

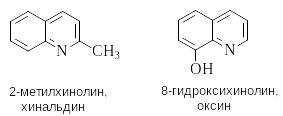
хинолин изохинолин
Методы получения
Синтез хинолина по Скраупу
Метод состоит во взаимодействии первичных ароматических аминов с глицерином в присутствии дегидратирующего реагента и окислителя. Классический синтез Скраупа может быть выражен следующей схемой.
Н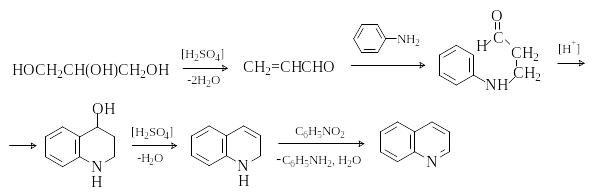 а
первой стадии происходит катализируемая
серной кислотой дегидратация глицерина
с образованием ,-непредельного
альдегида, акролеина. Второй стадия -
сопряженное присоединение анилина к
акролеину. Третья стадия – замыкание
цикла путем электрофильной атаки
карбонильной группы по ароматическому
кольцу. На заключительных стадиях
происходит дегидратация и окисление
образующегося 1,2-дигидрохинолина в
хинолин. В качестве окислителя удобно
использовать нитросоединение,
соответствующее исходному амину. Для
снижения экзотермичности реакции,
которая протекает очень бурно, в
реакционную смесь добавляют FeSO4.
а
первой стадии происходит катализируемая
серной кислотой дегидратация глицерина
с образованием ,-непредельного
альдегида, акролеина. Второй стадия -
сопряженное присоединение анилина к
акролеину. Третья стадия – замыкание
цикла путем электрофильной атаки
карбонильной группы по ароматическому
кольцу. На заключительных стадиях
происходит дегидратация и окисление
образующегося 1,2-дигидрохинолина в
хинолин. В качестве окислителя удобно
использовать нитросоединение,
соответствующее исходному амину. Для
снижения экзотермичности реакции,
которая протекает очень бурно, в
реакционную смесь добавляют FeSO4.
Синтез хинолина по Дебнеру-Миллеру
Э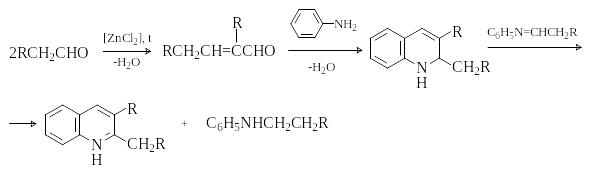 тот
метод, как и реакция Скраупа, основан
на взаимодействии ароматических аминов
с ,-непредельными
карбонильными соединениями. Ненасыщенные
карбонильные соединения получают
непосредственно в реакционной смеси
из альдегидов и кетонов путем кротоновой
конденсации. Окислителями промежуточно
образующихся 1,2-дигидрохинолинов
являются альдимины, образующиеся при
взаимодействии исходных карбонильных
соединения с ароматическим амином.
тот
метод, как и реакция Скраупа, основан
на взаимодействии ароматических аминов
с ,-непредельными
карбонильными соединениями. Ненасыщенные
карбонильные соединения получают
непосредственно в реакционной смеси
из альдегидов и кетонов путем кротоновой
конденсации. Окислителями промежуточно
образующихся 1,2-дигидрохинолинов
являются альдимины, образующиеся при
взаимодействии исходных карбонильных
соединения с ароматическим амином.
Физические свойства и строение
Пиридин – бесцветная жидкость с неприятным запахом, растворим в воде. Хинолин и изохинолин – бесцветные жидкости, малорастворимы в воде.
П иридин
представляет собой ароматическую
6-электронную
систему, подобную
ароматической системе бензола. Все
атомы цикла, в то числе и атом азота,
находятся в состоянии sp2-гибридизации
и предоставляют р-орбитали для
образования замкнутой сопряженной
-системы. Неподеленная
пара электронов атома азота лежит в
плоскости, перпендикулярной плоскости
-системы кольца, и
не принимает участия в создании
ароматического секстета.
иридин
представляет собой ароматическую
6-электронную
систему, подобную
ароматической системе бензола. Все
атомы цикла, в то числе и атом азота,
находятся в состоянии sp2-гибридизации
и предоставляют р-орбитали для
образования замкнутой сопряженной
-системы. Неподеленная
пара электронов атома азота лежит в
плоскости, перпендикулярной плоскости
-системы кольца, и
не принимает участия в создании
ароматического секстета.
-МО пиридина подобны орбиталям бензола, но имеются следующие отличия. Во-первых, -орбитали пиридина имеют более низкую энергию, что обусловлено большей электроотрицательностью атома азота по сравнению с атомом углерода. Во-вторых, высшие занятые молекулярные орбитали (ВЗМО) 2 и 3 у бензола вырождены, а соответствующие орбитали пиридина имеют разную энергию. Орбиталь 2 со значительным коэффициентом на атоме азота ниже по энергии, чем орбиталь 3 с нулевым коэффициентом на атоме азота.
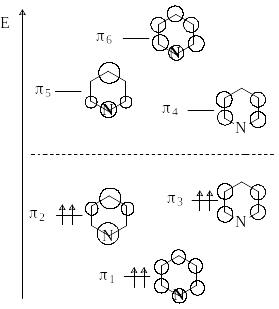
Атом азота действует как акцептор по индуктивному механизму, что приводит к снижению электронной плотности на атомах углерода пиридиниевого кольца по сравнению с бензолом. Поэтому пиридин относят к -дефицитным гетероциклам.
Пиридин обладает значительной энергией делокализации, сравнимой с энергией делокализации бензола. Это свидетельствует о высокой стабильности циклической системы пиридина, в чем он превосходит пятичленные ароматические гетероциклы – пиррол,фуран и тиофен.
Хинолин и изохинолин являются электронными аналогами нафталина. Они содержат -электронную систему из 10 -электронов и могут быть к отнесены к ароматическим гетероциклам. Присутствие атома азота снижает электронную плотность главным образом на атомах углерода пиридиниевого цикла.
Химические свойства
Реакции по атому азота
Наличие у атома азота пиридина и его бензологов свободной пары электронов, не участвующей в сопряженной системе, обусловливает их основные и нуклеофильные свойства.
П иридин
и хинолин являются слабыми основаниями
и с сильными кислотами образуют соли
пиридиния и хинолиния.
иридин
и хинолин являются слабыми основаниями
и с сильными кислотами образуют соли
пиридиния и хинолиния.
По основности пиридин и его бензологи уступают алифатическим и алициклическим аминам и близки к ароматическим аминам.
p
![]() 11,25 5,23 5,14
4,94 4,58
11,25 5,23 5,14
4,94 4,58
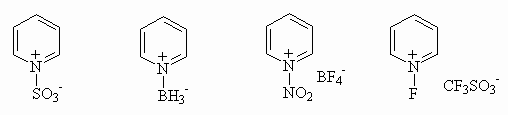
Для пиридина и его бензологов характерно образование комплексов с кислотами Льюиса, которые в большинстве своем служат мягкими электрофильными агентами, например:
|
|||
сульфирующий агент |
мягкий восстановитель |
мягкий нитрующий агент |
фторирующий агент |
Нуклеофильность атома азота проявляется в его способности к алкилированию. При алкилировании образуются устойчивые соли алкилпиридиния и алкилхинолиния:

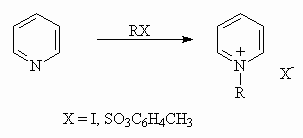
2) Реакции электрофильного замещения
Пиридин
Реакции электрофильного замещения в пиридине идут с большим трудом, что обусловлено -дефицитностью ядра и способностью атома азота образовывать соли с протонными кислотами и комплексы с кислотами Льюиса, что еще больше уменьшает нуклеофильность ядра. По реакционной способности к электрофильному замещению пиридин напоминает нитробензол. Замещение идет по положению 3, что вытекает из рассмотрения резонансных структур -комплексов, ведущих к продуктам замещения в положения 2, 3 и 4.
Н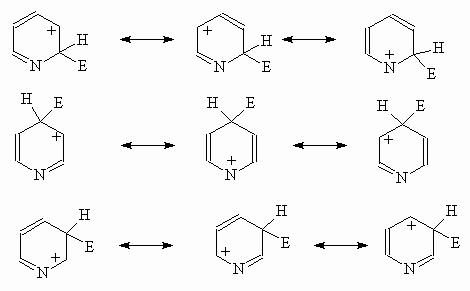 есмотря
на то, что в резонансной стабилизации
промежуточного катиона при электрофильной
атаке как при замещении по положению
3, так и по положениям 2 и 4, участвует
одинаковое число мезомерных структур,
в последних двух случаях катионы с
положительным зарядом на иминном атоме
азота крайне невыгодны.
есмотря
на то, что в резонансной стабилизации
промежуточного катиона при электрофильной
атаке как при замещении по положению
3, так и по положениям 2 и 4, участвует
одинаковое число мезомерных структур,
в последних двух случаях катионы с
положительным зарядом на иминном атоме
азота крайне невыгодны.
П иридин
нитруется, сульфируется и галогенируются
в очень жестких условиях. Только процессы
галогенирования и сульфирования идут
с удовлетворительными выходами.
Алкилирование и ацилирование в кольцо
провести не удается.
иридин
нитруется, сульфируется и галогенируются
в очень жестких условиях. Только процессы
галогенирования и сульфирования идут
с удовлетворительными выходами.
Алкилирование и ацилирование в кольцо
провести не удается.
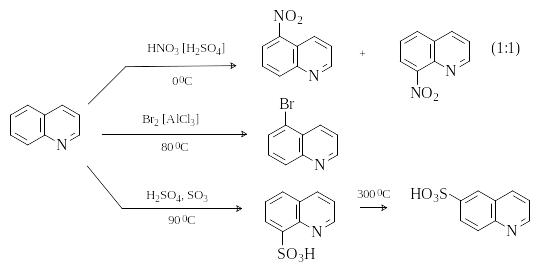
Хинолин
Реакции электрофильного замещения идут по наименее электронодефицитному бензольному кольцу преимущественно в положения 5 и 8. В условиях термодинамического контроля, например, при сульфировании выше 3000С, основным продуктом будет более стабильный 6-изомер.
3) Реакции нуклеофильного замещения
Реакции нуклеофильного замещения для пиридиниевого цикла наиболее характерны. Пиридиниевый атом азота оказывает на ядро активирующее действие, подобно нитрогруппе в бензольном кольце. Нуклеофильное замещение протекает по механизму присоединения-отщепления (SNAr). Наиболее активированными являются положения 2 и 4. При атаке нуклеофила по этим положениям образуются наиболее стабильные анионные интермедиаты, в которых атом азота участвует в делокализации отрицательного заряда.
В хинолине к нуклеофильному замещению
также активированы положения 2 и 4.
хинолине к нуклеофильному замещению
также активированы положения 2 и 4.
Под действием таких сильных нуклеофилов, как амиды металлов и металлоорганические соединения, в пиридине и хинолине возможно замещение гидрид-иона. Аминирование пиридина и хинолина амидами металлов носит название реакции Чичибабина. Процесс проводят путем нагревания реагентов в инертном растворителе. Механизм реакции – присоединение –отщепление.
А налогично
реагирует хинолин с образованием
2-аминохинолина.
налогично
реагирует хинолин с образованием
2-аминохинолина.
П ри
действии на пиридин и хинолин фениллития
водород в положении 2 замещается на
фенильную группу.
ри
действии на пиридин и хинолин фениллития
водород в положении 2 замещается на
фенильную группу.
4) Восстановление
К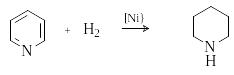 аталитическое
гидрирование пиридина дает пиперидин.
аталитическое
гидрирование пиридина дает пиперидин.
П ри
гидрирование хинолина в первую очередь
восстанавливается пиридиниевый цикл
и образуется 1,2,3,4-тетрагидрохинолин.
ри
гидрирование хинолина в первую очередь
восстанавливается пиридиниевый цикл
и образуется 1,2,3,4-тетрагидрохинолин.
5) Окисление
Я дро
пиридина устойчиво к действию окислителей.
Алкилпиридины могут быть окислены до
пиридинкарбоновых килот.
дро
пиридина устойчиво к действию окислителей.
Алкилпиридины могут быть окислены до
пиридинкарбоновых килот.
П ри
окислении хинолина и изохинолина в
первую очередь, как правило, разрушается
бензольное кольцо.
ри
окислении хинолина и изохинолина в
первую очередь, как правило, разрушается
бензольное кольцо.
Окисление пиридина и хинолина пероксидом водорода и надкислотами приводит к N-оксидам.
6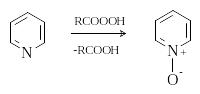 )
Реакции N-оксидов
пиридина и хинолина
)
Реакции N-оксидов
пиридина и хинолина
О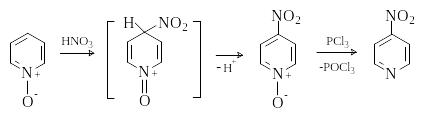 бразование
N-оксида облегчает электрофильное
замещение и меняет его ориентацию.
Нитрование N-оксида пиридина идет в
положение 4, так как образующийся при
атаке электрофилом по этому положению
интермедиат стабилизирован с участием
атома кислорода. Если учесть возможность
последующей дезоксигенации N-оксидов
действием PCl3 или NO, то такой
синтетический подход очень удобен для
получения пиридинов, содержащих
заместители в -положении:
бразование
N-оксида облегчает электрофильное
замещение и меняет его ориентацию.
Нитрование N-оксида пиридина идет в
положение 4, так как образующийся при
атаке электрофилом по этому положению
интермедиат стабилизирован с участием
атома кислорода. Если учесть возможность
последующей дезоксигенации N-оксидов
действием PCl3 или NO, то такой
синтетический подход очень удобен для
получения пиридинов, содержащих
заместители в -положении:
N -оксид
хинолина также легко нитруется в
положение 4. N-Оксидная группировка
способствует и нуклеофильному замещению,
что дает возможность легко замещать
введенную таким образом нитрогруппу
на различные нуклеофилы:
-оксид
хинолина также легко нитруется в
положение 4. N-Оксидная группировка
способствует и нуклеофильному замещению,
что дает возможность легко замещать
введенную таким образом нитрогруппу
на различные нуклеофилы:
7) Реакции метилпиридинов
А том
азота в пиридиниевом кольце оказывает
влияние на подвижность -водородных
атомов в алкилпиридинах. Метилпиридины
обладают большей СН-кислотностью, чем
толуол. СН-кислотность атомов водорода
метильных групп в 2- и 4-метилпиридинах
сравнима с кислотностью метилкетонов.
Повышенная протонная подвижность
водорода метильных групп в 2- и 4-
метилпиридинах может быть объяснена
стабилизацией сопряженных оснований
с участием атома азота, что следует из
рассмотрения их резонансных структур.
том
азота в пиридиниевом кольце оказывает
влияние на подвижность -водородных
атомов в алкилпиридинах. Метилпиридины
обладают большей СН-кислотностью, чем
толуол. СН-кислотность атомов водорода
метильных групп в 2- и 4-метилпиридинах
сравнима с кислотностью метилкетонов.
Повышенная протонная подвижность
водорода метильных групп в 2- и 4-
метилпиридинах может быть объяснена
стабилизацией сопряженных оснований
с участием атома азота, что следует из
рассмотрения их резонансных структур.
В этом отношении анионы метилпиридинов пободны енолят-анионам. В присутствии оснований 2- и 4- метилпиридины выступают в реакции альдольно-кротоновой конденсации в роли метиленовые компоненты.
А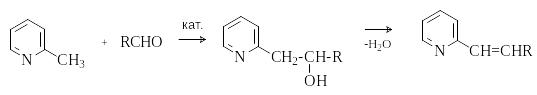 налогичными
свойствами обладают 2- и 4- метилхинолины.
налогичными
свойствами обладают 2- и 4- метилхинолины.