
- •Меркуриметрическое титрование. Характеристика метода, рабочие растворы, индикаторы. Преимущества и недостатки метода меркуриметрии.
- •Сущность метода
- •Преимущества и недостатки метода меркуриметрии.
- •2. Сущность и методы оксидиметрии. Перманганатометрия. Характеристика, рабочий раствор, стандартизация.
- •3. Особенности и возможности метода ко – перманганатометрии: определение окислителей и восстановителей. Преимущества и недостатки метода Кислая среда:
- •Нейтральная или слабощелочная среда:
- •Преимущества и недостатки метода перманганатометрии
- •4. Общая характеристика йодометрического метода титрования. Фиксирование точки эквивалентности.
- •Фиксирование конечной точки титрования. Безиндикаторный способ
- •Индикаторы
- •5. Стандартные растворы в йодометрии. Приготовление, стандартизация.
- •6. Применение йодометрии в фармацевтическом анализе – определение кислоты аскорбиновой, метамизола натрия и кофеина. Достоинства и недостатки йодометрии.
- •7. Окислительно-восстановительное титрование – бихроматометрия.
- •8. Окислительно-восстановительное титрование – цериметрия.
- •9. Броматометрия. Общая характеристика. Приготовление раствора кВrО3, и его стандартизация. Прямое броматометрическое титрование.
- •10. Бромометрическое (броматометрическое титрование) определение. Классификация. Преимущества и недостатки.
- •11. Нитритометрия. Сущность метода. Преимущества и недостатки метода нитритометрии.
- •12. Приготовление рабочего раствора NaNo2 и его стандартизация. Индикаторы метода нитритометрии.
- •13. Комплексонометрическое титрование. Комплексоны. Химизм.
- •14. Особенности проткания реакции комплексообразования. Приготовление стандартного раствора трилона б. Способы фиксирования конечной точки титрования. Кривые титрования.
- •15. Комплексонометрическое титрование. Анализ двузарядных катионов. Химизм. Примеры.
- •16. Комплексонометрическое титрование. Анализ трехвалентных катионов. Химизм. Примеры.
11. Нитритометрия. Сущность метода. Преимущества и недостатки метода нитритометрии.
Нитритометрия, или нитритометрическое титрование, - метод количественного определения веществ с использованием титранта – раствора нитрита натрия NaNO2. Метод – фармакопейный, применяется в анализе различных веществ, в том числе многих фармацевтических препаратов.
Сущность метода
Метод основан на использовании полуреакции, протекающей в кислой среде:
NO2- + ẽ + 2Н+ = NO + H2O
Стандартный ОВ потенциал редокс-пары NО2/NО при комнатной температуре равен 0,98 В. Реальный ОВ потенциал этой редокс-пары увеличивается с ростом концентрации ионов водорода.
Е = 0,98 + lg([NO2-]·[H+]2/[NO])
Поэтому с повышением кислотности среды окислительные свойства нитрит-иона возрастают.
Нитритометрическое титрование ведут в кислой среде. Поскольку в указанной ОВ полуреакции участвует один электрон, то фактор эквивалентности нитрита натрия равен единице, молярная масса эквивалента равна молярной массе, молярная концентрация эквивалента равна молярной концентрации нитрита натрия. Метод основан на реакциях окисления-восстановления, диазотирования, нитрозирования, азирования. Нитрит натрия может проявлять свойства окислителя и восстановителя.
Титрант метода – натрия нитрит (NaNO2) обычно используют в виде водного раствора с концентрацией 0,1 или 0,5 М. Раствор готовят способом установленного титра, так как нитрит натрия неустойчив при хранении и может окисляться до нитрата.
При визуальной индикаторной фиксации КТТ в нитритометрии применяют две группы индикаторов: внутренние и внешние.
В качестве внутренних используют редокс-индикаторы, такие, как тропеолин 00 (в КТТ окраска из красной переходит в желтую), его смесь с метиленовым синим (окраска из малиновой переходит в синюю), нейтральный красный (окраска из красно-фиолетовой переходит в синюю), а также сафранин Ж, метаниловый желтый, кислотный синий 2К.
В качестве внешних индикаторов обычно применяют иодидкрахмальную бумагу, которая представляет собой фильтровальную бумагу, пропитанную раствором крахмала и иодида калия и затем высушенную.
Нитритометрия один из самых простых методов окислительно-восстановительного титрования, который применяется для количественного определения различных лекарственных средств.
Используемые в данном методе оборудование (за исключением приборов для определения КТТ потенциометрически и амперометрически) имеет на вооружении каждая лаборатория и аптека. Поскольку титрование является классическим методом количественного определения, то все провизоры владеют данными навыками.
Недостатками метода являются трудности по соблюдению методик из-за специфических свойств как титранта, так и определяемых веществ.
В настоящее время, как показывает практика, нитритометрия нашла широкое применение как в аналитических, так и в аптечных лабораториях. Подтверждению этому являются утверждённые методики количественного определения многих лекарственных средств в частных фармакопейных статьях.
12. Приготовление рабочего раствора NaNo2 и его стандартизация. Индикаторы метода нитритометрии.
Титрант метода – натрия нитрит (NaNO2) обычно используют в виде водного раствора с концентрацией 0,1 или 0,5 М. Раствор готовят способом установленного титра, так как нитрит натрия неустойчив при хранении и может окисляться до нитрата.
Стандартизацию нитрита натрия проводят по той реакции, которую будут использовать для определения. Если NaNO2 используется как окислитель, то его стандартизацию проводят по железу(II), мышьяку(III), гидразину, если как восстановитель – то по перманганату калия (вторичный стандарт), дихромату калия, если в реакциях диазотирования – то по сульфаниловой кислоте, п-аминобензойной кислоте, паминоэтилбензоату.
Как окислитель нитрит натрия используют для определения восстановителей Sn2+, Fe2+, As2O3, гидразина и других соединений. При этом нитрит восстанавливается до оксида азота:
HNO2 + H+ + ē ↔ NO + H2O
Как восстановитель нитрит натрия используют для определения перманганата калия, хлора, йодата калия и других соединений по реакции:
HNO2 + H2O – 2ē ↔ NO3- + 3H+
Чаще других используют реакцию диазотирования, которая протекает с первичными ароматическими аминами в кислой среде:
Ar–NH2 + NaNO2 + 2HCl ↔ [Ar–N ≡N]+Cl- + NaCl + 2H2O.
В качестве титранта используют обычно водный раствор нитрита натрия NaNО2, чаще всего ‒ с молярной концентрацией 0,5 или 0,1 моль/л. Раствор готовят способом установленного титра, так как нитрит натрия неустойчив при хранении и может окисляться до нитрата.
Раствор вначале готовят с приблизительно требуемой концентрацией, а затем стандартизуют ‒ в большинстве случаев по стандартному раствору сульфаниловой кислоты NH2C6H4SО3H или перманганата калия.
Стандартизацию нитрита натрия проводят по той реакции, которую будут использовать для определения.
Если NaNO2 используется как окислитель, то его стандартизацию проводят по железу(II), мышьяку(III), гидразину,
если как восстановитель – то по перманганату калия (вторичный стандарт), дихромату калия,
если в реакциях диазотирования – то по сульфаниловой кислоте, паминобензойной кислоте, аминоэтилбензоату.
Для приготовления 0,1 моль/л раствора титранта растворяют 7,3 г нитрита натрия в воде в мерной колбе на 1 л и доводят водой объем раствора до метки. Затем раствор стандартизуют.
Стандартизация по сульфаниловой кислоте.
Стандартный раствор сульфаниловой кислоты готовят, растворяя точную навеску ее в воде в присутствии гидрокарбоната натрия NаНСО3, с тем чтобы образовалась водорастворимая смесь.
Для приготовления раствора 0,2 г (точная навеска) сульфаниловой кислоты, которую предварительно дважды перекристаллизовывают из воды и высушивают при 120°С до постоянной массы, смешивают с 0,1 г NaHCO3, 10 мл воды и затем прибавляют к смеси еще 60 мл воды, 10 мл разбавленной HCl, 1 г КВr (для ускорения реакции) и титруют стандартизуемым раствором нитрита натрия.
Реакция сульфаниловой кислоты с нитритом натрия в соляно-кислой среде с образованием соли диазония протекает медленно, поэтому раствор нитрита натрия прибавляют при интенсивном перемешивании в начале титрования со скоростью ~ 2 мл в минуту, а в конце титрования (когда остается прибавить ~ 0,5 мл раствора) ‒ со скоростью 0,05 мл в минуту.
Конец титрования определяют либо потенциометрически, либо визуально индикаторным методом в присутствии индикатора ‒ смеси тропеолина 00 с метиленовым синим или нейтрального красного.
Стандартизованный раствор нитрита натрия хранят в темном месте в сосудах из темного стекла с притертыми пробками. Аналогично готовят, стандартизуют и хранят 0,05 моль/л раствор нитрита натрия.
Стандартизация по перманганату калия
Проводится методом обратного перманганатометрического титрования с иодометрическим окончанием. К точно известному объему стандартного раствора перманганата калия, взятого в избытке по сравнению со стехиометрическим количеством, прибавляют серную кислоту, раствор нагревают до ~40°С для ускорения протекания реакции, после этого добавляют точно измеренный объем стандартизуемого раствора нитрита натрия и оставляют смесь на 15‒20 минут. При этом протекает реакция:
5NO2- + 2MnO4- + 6Н+ = 5NO3- + 2Мn2+ + 3Н2O
Затем к раствору добавляют избыток 10%-ного раствора иодида калия, накрывают колбу стеклом и оставляют смесь на ‒ 5 минут в темном месте. Иодид калия взаимодействует с непрореагировавшим остатком перманганата калия с образованием иода:
2МnО4- + 10I- + 16H+ = 2Мn2+ + 5I2 + 8Н2O
Образовавшуюся смесь разбавляют небольшим количеством воды и оттитровывают выделившийся иод стандартным 0,05 моль/л раствором тиосульфата натрия до слабо-желтой окраски раствора (цвет остаточного недотитрованного иода), после чего прибавляют небольшое количество 1- 2%-ного раствора крахмала ‒ раствор окрашивается в синий цвет.
Продолжают титрование до резкого перехода окраски раствора из синей в бесцветную. Расчет результатов титрования проводят обычным способом, исходя из закона эквивалентов:
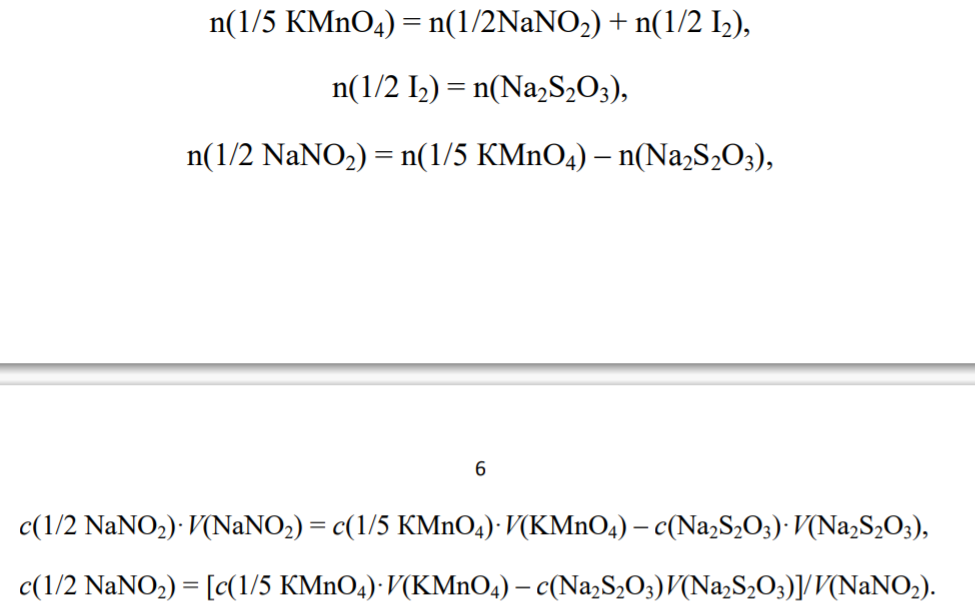
Нитрит-ион неустойчив в кислой среде и разлагается с образованием газообразных оксидов азота:
NO2- + H+ = HNO2
2HNO2 = NO + NO2 + Н2O
Поэтому при проведении нитритометрического титрования раствор нитрита натрия прибавляют к кислому титруемому раствору; сам же раствор нитрита натрия перед титрованием не подкисляют. Водные растворы нитрита натрия умеренной концентрации относительно устойчивы. В сильно разбавленных растворах происходит окисление нитрит-иона до нитрат-иона.
Определение конца титрования. Окончание титрования в нитритометрии чаще всего фиксируют электрометрически, проводя потенциометрическое титрование.
Индикаторы метода (внешние, внутренние). При визуальной индикаторной фиксации КТТ в нитритометрии применяют две группы индикаторов: внутренние и внешние.
В качестве внутренних используют редокс-индикаторы, такие, как тропеолин 00 (в КТТ окраска из красной переходит в желтую), его смесь с метиленовым синим (окраска из малиновой переходит в синюю), нейтральный красный (окраска из красно-фиолетовой переходит в синюю), а также сафранин Ж, метаниловый желтый, кислотный синий 2К.
В качестве внешних индикаторов обычно применяют иодидкрахмальную бумагу, которая представляет собой фильтровальную бумагу, пропитанную раствором крахмала и иодида калия и затем высушенную.
Контроль за ходом титрования ведут, периодически отбирая каплю титруемого раствора и нанося его на иодидкрахмальную бумагу. До достижения ТЭ в титруемом растворе нет окислителя — нитрит-ионов, поэтому при нанесении капли такого раствора на иодидкрахмальную бумагу иодид-ионы не окисляются, иод не образуется и бумага не синеет.
После достижения ТЭ прибавление уже одной капли избыточного титранта приводит к появлению в растворе нитрит-ионов, поэтому при нанесении капли такого раствора на иодидкрахмальную бумагу иодид-ионы окисляются нитрит-ионами до иода:
2I- + 2NO2- + 4Н+ = I2 + 2NO + 2H2O
Образующийся иод в присутствии крахмала окрашивает бумагу в синий цвет.
Титрование прекращают тогда, когда капля титруемого раствора, отобранная через примерно одну минуту после прибавления титранта к титруемому раствору, сразу же окрашивает бумагу в синий цвет.
Параллельно проводят контрольный опыт для определения избыточного расхода титранта.
