
- •Меркуриметрическое титрование. Характеристика метода, рабочие растворы, индикаторы. Преимущества и недостатки метода меркуриметрии.
- •Сущность метода
- •Преимущества и недостатки метода меркуриметрии.
- •2. Сущность и методы оксидиметрии. Перманганатометрия. Характеристика, рабочий раствор, стандартизация.
- •3. Особенности и возможности метода ко – перманганатометрии: определение окислителей и восстановителей. Преимущества и недостатки метода Кислая среда:
- •Нейтральная или слабощелочная среда:
- •Преимущества и недостатки метода перманганатометрии
- •4. Общая характеристика йодометрического метода титрования. Фиксирование точки эквивалентности.
- •Фиксирование конечной точки титрования. Безиндикаторный способ
- •Индикаторы
- •5. Стандартные растворы в йодометрии. Приготовление, стандартизация.
- •6. Применение йодометрии в фармацевтическом анализе – определение кислоты аскорбиновой, метамизола натрия и кофеина. Достоинства и недостатки йодометрии.
- •7. Окислительно-восстановительное титрование – бихроматометрия.
- •8. Окислительно-восстановительное титрование – цериметрия.
- •9. Броматометрия. Общая характеристика. Приготовление раствора кВrО3, и его стандартизация. Прямое броматометрическое титрование.
- •10. Бромометрическое (броматометрическое титрование) определение. Классификация. Преимущества и недостатки.
- •11. Нитритометрия. Сущность метода. Преимущества и недостатки метода нитритометрии.
- •12. Приготовление рабочего раствора NaNo2 и его стандартизация. Индикаторы метода нитритометрии.
- •13. Комплексонометрическое титрование. Комплексоны. Химизм.
- •14. Особенности проткания реакции комплексообразования. Приготовление стандартного раствора трилона б. Способы фиксирования конечной точки титрования. Кривые титрования.
- •15. Комплексонометрическое титрование. Анализ двузарядных катионов. Химизм. Примеры.
- •16. Комплексонометрическое титрование. Анализ трехвалентных катионов. Химизм. Примеры.
10. Бромометрическое (броматометрическое титрование) определение. Классификация. Преимущества и недостатки.
При бромометрических определениях титрантом является Вг2, образующийся в результате взаимодействия бромата и бромида калия в кислой среде. Такой подход намного удобнее, чем применение для титрования заранее приготовленного раствора Вг2. Бром, как и йод, мало растворим в воде и сильно летуч.
Бромометрические определения ведут в присутствии избытка КВг, который добавляют в раствор определяемого вещества или титранта. Нейтральный раствор, содержащий КВгO3 и КВг (бромид-броматная смесь), устойчив, поскольку данные вещества взаимодействуют друг с другом только в кислой среде. Данный вид титрования используется для определения органических веществ, вступающих в реакции электрофильного замещения (фенолов, ароматических аминов) или электрофильного присоединения (органических веществ, содержащих в молекуле кратные связи) с бромом. В основе обратного титрования лежит реакция:
BrO3 + 5Br- + 6H+ = 3Br2 + 3H2O;
В методах броматометрии (бромометрическое) используют:
прямое;
косвенное (титрование заместителя);
обратное титрование.
Прямое бромометрическое титрование
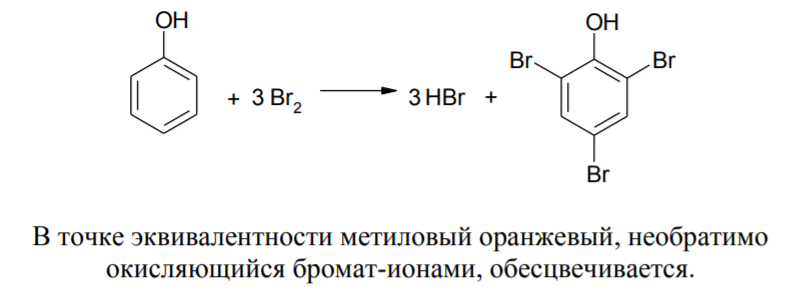
При определении фенола применяется прямое титрование. К испытуемому раствору добавляют бромид калия и хлороводородную кислоту и титруют броматом калия. Весь выделившийся бром будет вступать в реакцию с фенолом.
Косвенное (заместительное) бромометрическое титрование
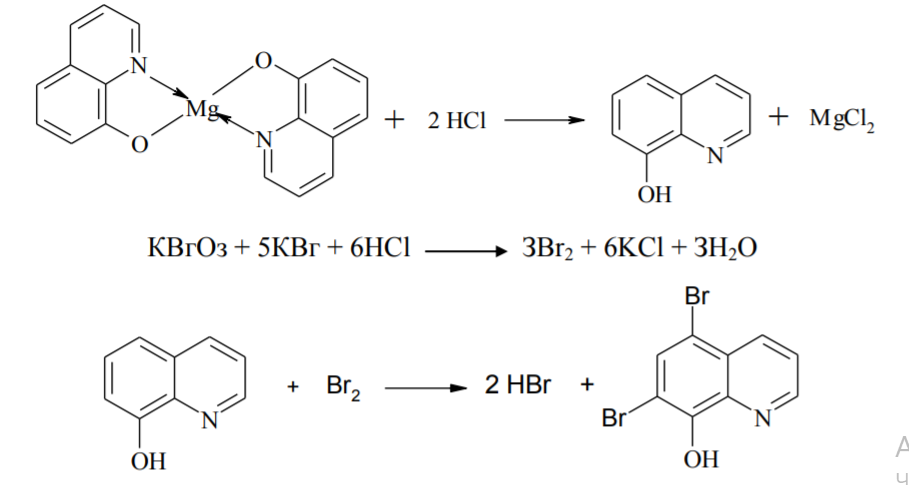
Метод бромирования можно использовать при косвенном анализе многих металлов: магния, алюминия, меди, кадмия, цинка, применяя 8- оксихинолин. Определяемый металл сначала осаждают 8-оксихинолином. Отфильтрованный и промытый осадок растворяют в хлороводородной кислоте и титруют раствором бромата в присутствии бромида калия с индикатором метиловым-красным.
Обратное бромометрическое титрование (бромид-броматное определение).
В фармацевтическом анализе метод бромирования часто применяют в сочетании с методом йодометрии (броматометрическое титрование с йодометрическим окончанием), способ «титрование заместителя» дает возможность связать эти методы. Их используют при количественном определении салициловой кислоты и ее солей, некоторых сульфаниламидных препаратов, тимола, резорцина, стрептоцида.
Количественные определения, проводимые этим способом, основаны на реакциях бромирования органических соединений и иодометрическом определении не вошедшего в реакцию брома.
Определение идет в четыре этапа:
Реакция взаимодействия бромида калия с броматом калия в кислой среде:
КВгОз + 5КВг + 6НСl = ЗВr2 + 6KCl + 3Н2О.
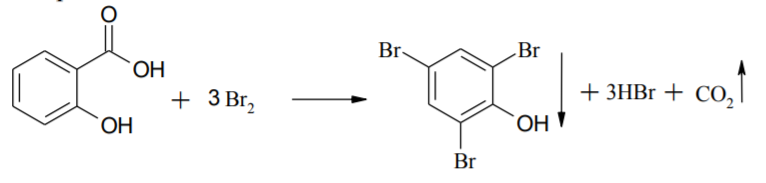
Реакция бромирования органического соединения. Рассмотрим эту реакцию на примере взаимодействия салициловой кислоты с бромом.
Так как титрованный раствор КВгОз прибавляется в избытке, с салициловой кислотой реагирует только эквивалентное ей количество (1:3) брома - часть же брома остается в растворе.
Реакция взаимодействия избытка брома с иодидом калия:
При добавлении в реакционную среду концентрированного раствора йодида калия происходит окислительно-восстановительная реакция с выделением молекулярного йода:
2KI + Br2 → 2КВг + I2
Йодометрическое окончание броматометрического титрования:
Избыток брома определяют иодометрическим методом: выделившийся йод титруют раствором тиосульфата натрия.
Br2+ 2KI = I2 + 2KBr
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Индикатор – крахмал, в точке эквивалентности синее окрашивание исчезает.
Броматометрический метод применяется для количественного определения лекарственных средств, которые являются восстановителями, например, изониазида, а также фенолов (фенола, тимола, резорцина, кислоты салициловой, синэстрола и др.) и первичных ароматических аминов (например, стрептоцида). Определение фенолов и ароматических аминов основано на реакции электрофильного замещения – бромирования.
Броматометрическое титрование используют для определения олова(II), мышьяка(Ш), сурьмы(Ш), железа(II), пероксида водорода, нитритов, тиоцианатов, гидразина, фенилгидразина, гидроксиламина, семикарбазида, тиокарбамида, щавелевой кислоты, в количественном анализе фармацевтических препаратов, таких, как As2O3, мышьяксодержащие новарсенол, миарсенол, аминарсон, осарсол, после их минерализации и перевода в соединения мышьяка(Ш).
Достоинства броматометрического метода
Броматометрический метод отличается рядом достоинств по сравнению с другими методами:
1. Бромат-бромидные растворы можно применять не только для определения восстановителей и окислителей, но и для анализа органических ненасыщенных, ароматических и гетероциклических соединений, а также для косвенного определения разнообразных ионов, осаждаемых в виде нерастворимых в воде соединений, например в виде оксихинолятов.
2. В отличие от стандартных растворов йода или брома, применяемых для анализа тех же соединений, растворы бромата калия устойчивы и не меняют своего титра в течение продолжительного времени. Поэтому при пользовании броматом получаются более надежные результаты анализа.
3. При введении в бромат-бромидную смесь ионов ртути (II) увеличивается потенциал системы бром – бромид благодаря образованию устойчивых комплексных ионов [HgBr4]2– . При этом происходит окисление таких ионов и соединений, которые в 10 отсутствие ионов ртути не окисляются бромат-бромидной смесью. Например, хром (III) легко окисляется до хрома (VI) в присутствии ионов ртути (II).
Недостатки броматометрического метода Броматометрический метод имеет также ряд недостатков:
1. Вода, присутствующая в растворе или образующаяся в процессе титрования неводных растворов, мешает определению многих органических соединений.
2. Окисление некоторых органических соединений сопровождается нежелательными побочными реакциями гидролиза, замещения и присоединения, вызываемыми действием ионов воды и брома.
3. В ряде случаев реакции бромата калия с органическими веществами протекают не в строго стехиометрических отношениях, что приводит к искажению конечных результатов анализа.
