
- •Меркуриметрическое титрование. Характеристика метода, рабочие растворы, индикаторы. Преимущества и недостатки метода меркуриметрии.
- •Сущность метода
- •Преимущества и недостатки метода меркуриметрии.
- •2. Сущность и методы оксидиметрии. Перманганатометрия. Характеристика, рабочий раствор, стандартизация.
- •3. Особенности и возможности метода ко – перманганатометрии: определение окислителей и восстановителей. Преимущества и недостатки метода Кислая среда:
- •Нейтральная или слабощелочная среда:
- •Преимущества и недостатки метода перманганатометрии
- •4. Общая характеристика йодометрического метода титрования. Фиксирование точки эквивалентности.
- •Фиксирование конечной точки титрования. Безиндикаторный способ
- •Индикаторы
- •5. Стандартные растворы в йодометрии. Приготовление, стандартизация.
- •6. Применение йодометрии в фармацевтическом анализе – определение кислоты аскорбиновой, метамизола натрия и кофеина. Достоинства и недостатки йодометрии.
- •7. Окислительно-восстановительное титрование – бихроматометрия.
- •8. Окислительно-восстановительное титрование – цериметрия.
- •9. Броматометрия. Общая характеристика. Приготовление раствора кВrО3, и его стандартизация. Прямое броматометрическое титрование.
- •10. Бромометрическое (броматометрическое титрование) определение. Классификация. Преимущества и недостатки.
- •11. Нитритометрия. Сущность метода. Преимущества и недостатки метода нитритометрии.
- •12. Приготовление рабочего раствора NaNo2 и его стандартизация. Индикаторы метода нитритометрии.
- •13. Комплексонометрическое титрование. Комплексоны. Химизм.
- •14. Особенности проткания реакции комплексообразования. Приготовление стандартного раствора трилона б. Способы фиксирования конечной точки титрования. Кривые титрования.
- •15. Комплексонометрическое титрование. Анализ двузарядных катионов. Химизм. Примеры.
- •16. Комплексонометрическое титрование. Анализ трехвалентных катионов. Химизм. Примеры.
3. Особенности и возможности метода ко – перманганатометрии: определение окислителей и восстановителей. Преимущества и недостатки метода Кислая среда:
В кислых средах ионы марганца могут существовать в различных степенях окисления: Mn2+, Mn3+, MnIV, MnV и MnVII. Низкозарядные ионы марганца способны окисляться до более высоких степеней окисления. Во избежание образования промежуточных форм окисления ионов марганца титрование рекомендуется проводить медленно, в очень кислых значениях рН, и при определенных температурах (нагревание). Реакцию восстановления можно наблюдать по изменению окраски – красно-фиолетовая переходит в бурый цвет (IV и III) и затем обезцвечивается (II) :
 MnO4- MnO2 Mn3+ Mn2+
MnO4- MnO2 Mn3+ Mn2+
Суммарный процесс протекает по следующей схеме:
4 2

Особенностью метода является сильное влияние рН на Ео системы (МnО4- + 8Н+ )/Мn2+. При титровании в сильно кислых средах чаще всего используют серную кислоту. Хлороводородную и азотную кислоты применять не следует, так как в их присутствии могут идти конкурирующие окислительно-восстановительные реакции. Ионы марганца низших степеней окисления, являются катализаторами реакции. Для качественного титрования часто используют способ обратного титрования, когда добавляется заведомый избыток перманганата и через некоторое время его остаток оттитровывается восстановителем.
Нейтральная или слабощелочная среда:
Восстановление перманганата в нейтральной или слабо щелочной среде не менее сложен, чем в кислой. На первой стадии реакции окисления- восстановления образуется сначала манганат:
 MnO4- + e- MnO4--
MnO4- + e- MnO4--
На второй стадии окисления-восстановления манганат восстанавли- вается до Мn (IV):

Сильно щелочная среда:
Восстановление перманганата в сильно щелочной среде протекает в одну стадию, при этом окраска окраска меняется от краснофиолетовой до зеленой:
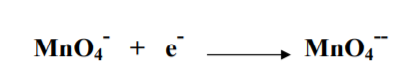
Окислительная способность перманганата в нейтральной и щелочной среде значительно ниже, чем в кислой среде. Поэтому определение восстановителей проводят в основном в кислой среде.
Перманганатометрически в щелочной среде, как правило, определяют органические соединения: формиаты, формальдегид, муравьиную, коричную, винную, лимонную кислоты, гидразин, ацетон и др.
Признаком окончания титрования служит бледно-розовая окраска избытка титранта KMnO4 (одна капля 0,004 моль/л раствора титранта придает заметную окраску 100 мл раствора). Поэтому, если титруемый раствор бесцветен, о достижении точки эквивалентности точки эквивалентности можно судить по появлению бледно-розовой окраски избытка титранта КМnО4 при титровании прямым способом прямым способом или по исчезновению окраски при обратном титровании обратном титровании. При анализе окрашенных растворов рекомендуется использовать индикатор ферроин.
Преимущества и недостатки метода перманганатометрии
Метод перманганатометрии обладает рядом достоинств:
В этом методе рабочий раствор является индикатором – одна его капля окрашивает раствор в розовый цвет.
Возможность титрования раствором КМnО4 можно проводить как в кислой среде, так и в щелочной среде.
Перманганат дешевый и доступный реагент.
Перманганат калия используется как реактив в осадительном титровании.
Стехиометричность и достаточно высокая скорость большинства окислительно-восстановительных реакций с участием МnО4- при оптимально выбранных условиях
Наряду с перечисленными достоинствами, метод перманганатометрии имеет ряд недостатков:
Перманганат калия трудно получить в химически чистом виде, т.к. он содержит много примесей, и его точную навеску взять невозможно.
Стандартные растворы неустойчивы и в процессе использования необходимо периодически проверять титр.
В среде соляной кислоты проводить определение нельзя, т.к. Сl- окисляется до свободного хлора.
Некоторые реакции окисления протекают очень медленно и поэтому требуется нагревание; но в этом случае могут разлагаться исследуемые вещества.
