
- •Меркуриметрическое титрование. Характеристика метода, рабочие растворы, индикаторы. Преимущества и недостатки метода меркуриметрии.
- •Сущность метода
- •Преимущества и недостатки метода меркуриметрии.
- •2. Сущность и методы оксидиметрии. Перманганатометрия. Характеристика, рабочий раствор, стандартизация.
- •3. Особенности и возможности метода ко – перманганатометрии: определение окислителей и восстановителей. Преимущества и недостатки метода Кислая среда:
- •Нейтральная или слабощелочная среда:
- •Преимущества и недостатки метода перманганатометрии
- •4. Общая характеристика йодометрического метода титрования. Фиксирование точки эквивалентности.
- •Фиксирование конечной точки титрования. Безиндикаторный способ
- •Индикаторы
- •5. Стандартные растворы в йодометрии. Приготовление, стандартизация.
- •6. Применение йодометрии в фармацевтическом анализе – определение кислоты аскорбиновой, метамизола натрия и кофеина. Достоинства и недостатки йодометрии.
- •7. Окислительно-восстановительное титрование – бихроматометрия.
- •8. Окислительно-восстановительное титрование – цериметрия.
- •9. Броматометрия. Общая характеристика. Приготовление раствора кВrО3, и его стандартизация. Прямое броматометрическое титрование.
- •10. Бромометрическое (броматометрическое титрование) определение. Классификация. Преимущества и недостатки.
- •11. Нитритометрия. Сущность метода. Преимущества и недостатки метода нитритометрии.
- •12. Приготовление рабочего раствора NaNo2 и его стандартизация. Индикаторы метода нитритометрии.
- •13. Комплексонометрическое титрование. Комплексоны. Химизм.
- •14. Особенности проткания реакции комплексообразования. Приготовление стандартного раствора трилона б. Способы фиксирования конечной точки титрования. Кривые титрования.
- •15. Комплексонометрическое титрование. Анализ двузарядных катионов. Химизм. Примеры.
- •16. Комплексонометрическое титрование. Анализ трехвалентных катионов. Химизм. Примеры.
13. Комплексонометрическое титрование. Комплексоны. Химизм.
Комплексонометрическое титрование – метод титриметрического анализа, основанный на реакции комплексообразования катионов металлов с комплексонами – аминополикарбоновыми кислотами и их солями.
Простейшим комплексоном, известным под названием комплексон I, служит трехосновная нитрилотриуксусная кислота
Химизм. Комплексон III, как и другие комплексоны, образует со многими ионами металлов растворимые внутрикомплексные соли. При этом металл замещает атомы водорода карбоксильных групп, а также образовывает донорно-акцепторные связи с атомами азота и кислорода согласно схеме
в отличие от других титриметрических методов, в комплексонометрии используют молярные концентрации веществ, а не нормальности. Это обусловлено как раз тем, что реакции металлов с комплексонами практически всегда протекают в молярном соотношении 1:1, поэтому нет необходимости в расчете эквивалентов. Метод комплексонометрического титрования обладает высокой чувствительностью (до 10-3 M) и точностью (погрешность 0.1–0.3 %), быстр и прост в исполнении, имеет достаточно высокую избирательность (селективность)

14. Особенности проткания реакции комплексообразования. Приготовление стандартного раствора трилона б. Способы фиксирования конечной точки титрования. Кривые титрования.

1. в результате реакции образуются комплексы только одного состава с соотношением компонентов металл-комплексообразователь – лиганд комплексон (М:L) – 1:1 (-++комплексонаты).
2. комплексонаты бесцветны, хорошо растворимы в воде и обладают высокой устойчивостью, так как центральный атом металла прочно связан полидентатным хелатным лигандом.
3. реакция является обратимым процессом и может быть сдвинута как в сторону образования, так и в сторону разрушения комплексоната, что легко достигается с помощью варьирования величины рН раствора – подкисление приводит к смещению равновесия влево к исходным реагентам, а подщелачивание способствует образованию комплексоната:
М2 + Na2Н2Y = Na2[MY] + 2H
4. в результате реакции выделяются ионы водорода, поэтому её следует проводить в буферной среде, поддерживая оптимальное значение рН, определяемое константой устойчивости комплексоната.
ПРИГОТОВЛЕНИЕ СТАНДАРТНОГО РАСТВОРА ТРИЛОНА Б Динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б, комплексон ІІІ, динатрия эдетат) гигроскопична, поэтому из нее готовят вторичный стандартный раствор, а затем определяют его точную концентрацию по стандартным веществам - химически чистыми Zn, ZnO, СаСО3. Для этого точную навеску стандартного вещества растворяют в химически чистой серной или хлороводородной кислотах, полученный раствор нейтрализуют раствором NaOH или аммиака, прибавляют аммиачную буферную смесь и титруют раствором трилона Б. Стандартизуют приготовленный раствор трилона Б так же - по стандартным растворам ZnSО4 или MgSО4.
СПОСОБЫ ФИКСИРОВАНИЯ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ Конечную точку титрования устанавливают с помощью металлоиндикаторов – индикаторов, изменяющих окраску в зависимости от концентрации иона металла. Это органические соединения, содержащие в своих молекулах хромофорные группы и, вследствие этого, окрашенные. Такие индикаторы образуют с ионами металлов менее прочные, чем титрант, комплексы, цвет которых отличается от цвета самих индикаторов.
Металлоиндикаторы можно разделить на две группы. Индикаторы, которые сами не имеют окраски, но образуют с ионами металлов окрашенные комплексы. Интенсивность окраски образующихся комплексов обычно невысокая. Поэтому, чтобы наблюдать окраску комплекса, концентрация индикатора должна быть приблизительно в 10 раз больше концентрации титруемого металла.
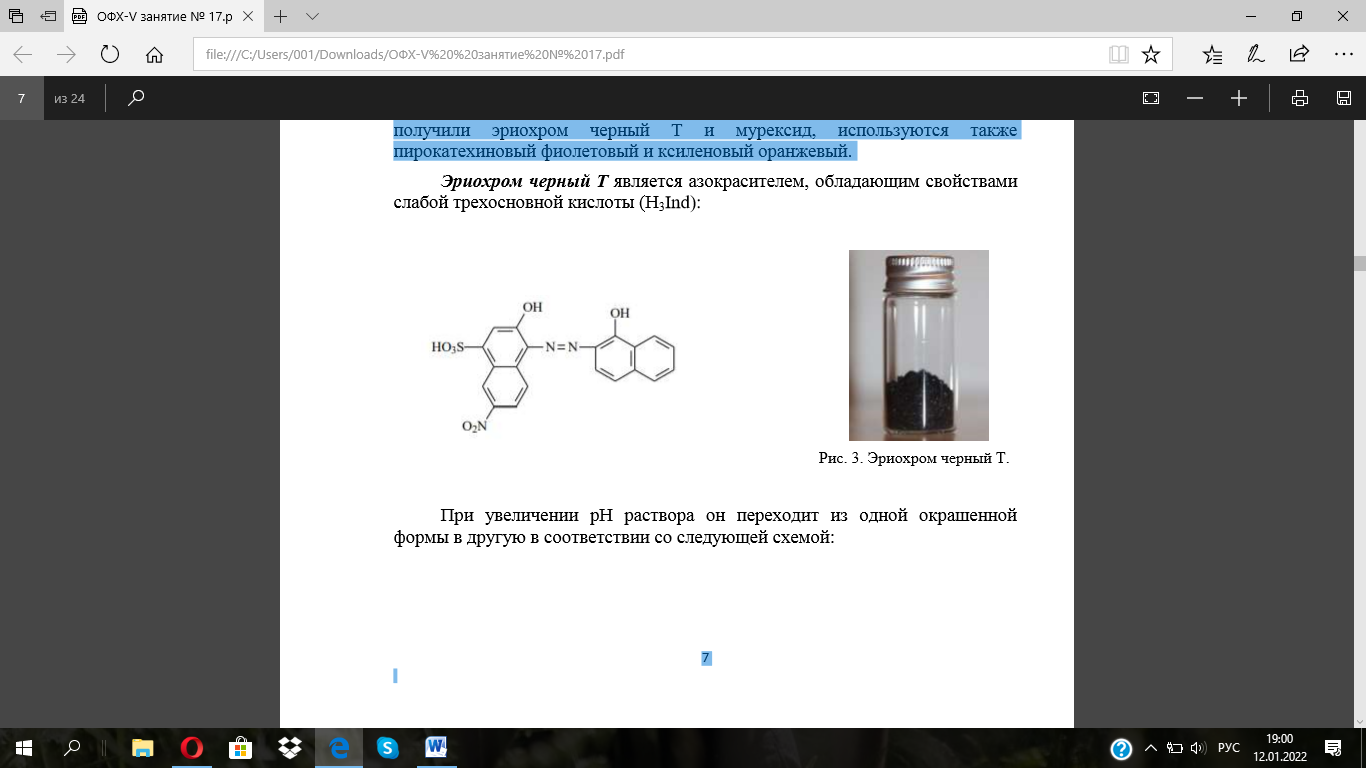
Вторая группа металлоиндикаторов более многочисленна и представлена металлохромными индикаторами – органическими веществами с хромофорными группами, образующими с ионами металлов интенсивно окрашенные комплексы, менее устойчивые, чем комплексонаты. Наибольшее распространение среди металлохромных индикаторов получили эриохром черный Т и мурексид, используются также пирокатехиновый фиолетовый и ксиленовый оранжевый.
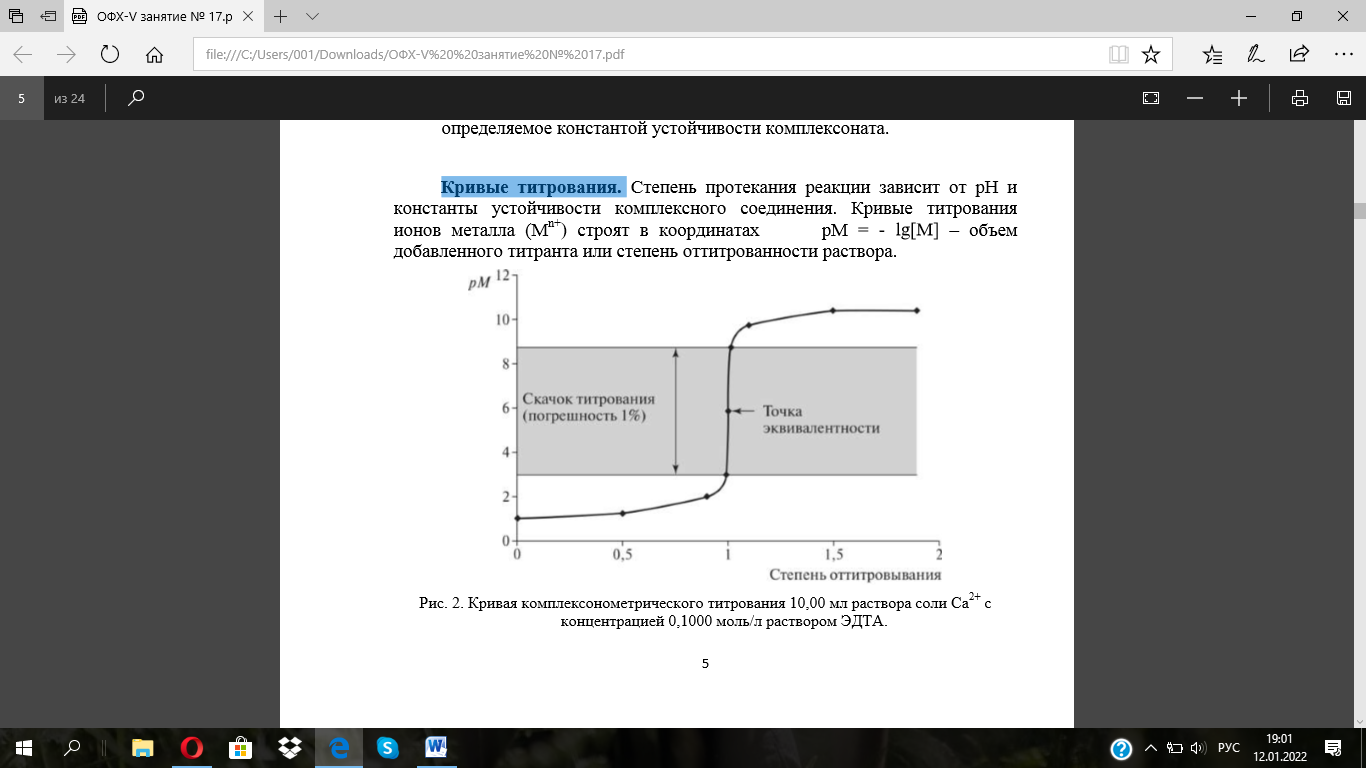 Кривые
титрования. Степень протекания реакции
зависит от рН и константы устойчивости
комплексного соединения. Кривые
титрования ионов металла (Мn+) строят в
координатах рМ = - lg[M] – объем
добавленного титранта или степень
оттитрованности раствора.
Кривые
титрования. Степень протекания реакции
зависит от рН и константы устойчивости
комплексного соединения. Кривые
титрования ионов металла (Мn+) строят в
координатах рМ = - lg[M] – объем
добавленного титранта или степень
оттитрованности раствора.
На величину скачка на кривой титрования оказывают влияние две величины: первоначальная концентрация определяемого иона в растворе и константа устойчивости образующегося комплексного соединения с ЭДТА: чем выше концентрация определяемого иона и чем прочнее комплекс, тем больше скачок.
