
- •Меркуриметрическое титрование. Характеристика метода, рабочие растворы, индикаторы. Преимущества и недостатки метода меркуриметрии.
- •Сущность метода
- •Преимущества и недостатки метода меркуриметрии.
- •2. Сущность и методы оксидиметрии. Перманганатометрия. Характеристика, рабочий раствор, стандартизация.
- •3. Особенности и возможности метода ко – перманганатометрии: определение окислителей и восстановителей. Преимущества и недостатки метода Кислая среда:
- •Нейтральная или слабощелочная среда:
- •Преимущества и недостатки метода перманганатометрии
- •4. Общая характеристика йодометрического метода титрования. Фиксирование точки эквивалентности.
- •Фиксирование конечной точки титрования. Безиндикаторный способ
- •Индикаторы
- •5. Стандартные растворы в йодометрии. Приготовление, стандартизация.
- •6. Применение йодометрии в фармацевтическом анализе – определение кислоты аскорбиновой, метамизола натрия и кофеина. Достоинства и недостатки йодометрии.
- •7. Окислительно-восстановительное титрование – бихроматометрия.
- •8. Окислительно-восстановительное титрование – цериметрия.
- •9. Броматометрия. Общая характеристика. Приготовление раствора кВrО3, и его стандартизация. Прямое броматометрическое титрование.
- •10. Бромометрическое (броматометрическое титрование) определение. Классификация. Преимущества и недостатки.
- •11. Нитритометрия. Сущность метода. Преимущества и недостатки метода нитритометрии.
- •12. Приготовление рабочего раствора NaNo2 и его стандартизация. Индикаторы метода нитритометрии.
- •13. Комплексонометрическое титрование. Комплексоны. Химизм.
- •14. Особенности проткания реакции комплексообразования. Приготовление стандартного раствора трилона б. Способы фиксирования конечной точки титрования. Кривые титрования.
- •15. Комплексонометрическое титрование. Анализ двузарядных катионов. Химизм. Примеры.
- •16. Комплексонометрическое титрование. Анализ трехвалентных катионов. Химизм. Примеры.
Меркуриметрическое титрование. Характеристика метода, рабочие растворы, индикаторы. Преимущества и недостатки метода меркуриметрии.
Меркуриметрия, или меркуриметрическое титрование – метод титримегрического анализа, основанный на использовании реакций образования устойчивых, слабодиссоциирующих, растворимых соединений ртути (II) — HgCl2, HgBr2, HgI2, Hg(CN)2, Hg(SCN)2, которые в растворах присутствуют в форме комплексных соединений.
Сущность метода
Метод используется для определения анионов Сl, Вr-, Г, CN-, SCN-, а также ртути (II) Hg2+ (с использованием роданида аммония в качестве титранта).
Анализируемый раствор, содержащий определяемый анион, титруют стандартным раствором соли ртути (II) – нитрата Hg(NO3)2 или перхлората Hg(ClO4)2.
В ходе реакции образуются устойчивые комплексы, например:
Hg2+ + 2 СГ = HgCl2
Hg2+ +4 I- = [HgI4]2-
Hg2+ + 2 SCN- = Hg(SCN)2
Окончание титрования фиксируют либо по изменению окраски прибавляемого индикатора, либо по появлению осадка.
В качестве титранта применяют стандартные растворы нитрата Hg(NO3)2 или перхлората Hg(ClO4)2 ртути (II), обычно с молярной концентрацией 0,05 моль/л. Нитрат и перхлорат ртути (II) – сильные электролиты и в водном растворе диссоциируют на ионы.
Раствор титранта готовят вначале с приблизительной концентрацией, а затем стандартизуют по стандартным растворам NaCl или NH4SCN в присутствии индикатора.
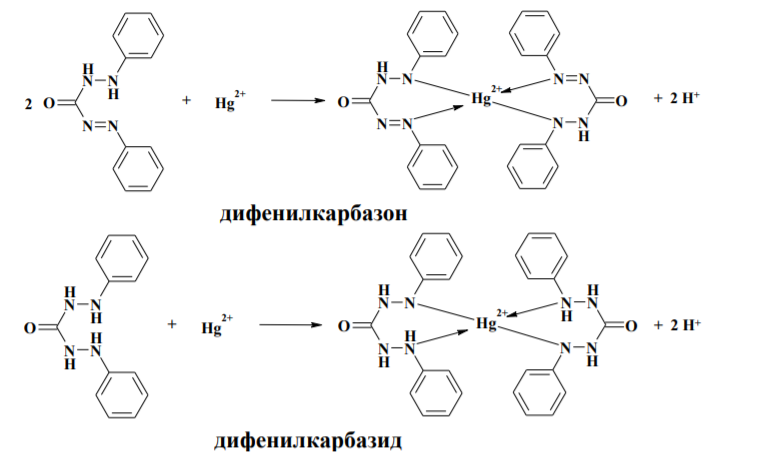
В качестве индикаторов в меркуриметрии применяют нитропруссид натрия Na2[Fe(CN)5NO] • 2Н2O, дифенилкарбазон, дифенилкарбазид и некоторые другие.
Нитропруссид натрия образует с катионами Hg2+ белый осадок:
Hg2+ + [Fe(CN)5NO]2- + 2 Н2O = Hg[Fe(CN)5NO] • 2 H2O
белый
В ТЭ появляется белый осадок (раствор мутнеет).
Cущественная методическая ошибка возникает при взаимодействии ионов Hg2+ с HgCl2, которые образуются в процессе титрования хлорид- ионов:
Hg2+ + HgCl2 = 2 [HgCl]+,
поэтому возникает необходимость введения поправочного коэффициента к эквивалентному объему титранта;
Дифенилкарбазон и дифенилкарбазид образуют с ионами Hg2+ окрашенные комплексы. Титрование прекращают при появлении сине-фиолетовой окраски раствора.
При определении йодид-ионов используют безиндикаторный метод, титрование проводят до появления розовой мути.
Hg2+
+
2
I-
⇌
HgI![]()
HgI2 + 2 I-⇌[HgI4]2-
Hg2+ +4 I- ⇌ [HgI4]2-
Избыточная капля раствора ртути (II) нитрата реагирует с комплексным ионом [HgI4]2- с выделением осадка HgI2 розово-оранжевого цвета:
[HgI4]2-
+
Hg2+
=
2
HgI2
![]()
Во время определения йодид-ионов получают несколько заниженный результат за счет диссоциации комплекса [HgI4]2-), в связи с чем к израсходованному на титрование объему раствора Hg(NO3)2 прибавляют поправку, величина которой пропорциональна общему объему титруемой смеси, из расчета: на 20,00 мл смеси 0,35 мл титранта.
При титровании йодидов в присутствии хлоридов и бромидов органических соединений необходимо помнить, что образующийся при титровании комплекс K2[HgJ4] действует по типу общеалкалоидного реактива Майера и, следовательно, может давать осадочные реакции со многими солями алкалоидов и азотистых оснований, содержащими третичный или четвертичный азот. Например, при титровании смеси пилокарпина гидрохлорида с калия йодидом от добавления первых капель раствора нитрата ртути (II) еще до достижения точки эквивалентности образуется бледно- желтый осадок и определять калия йодид без индикатора не представляется возможным.
Возможно также меркуриметрическое определение солей ртути (II) с использованием в качестве титранта раствора аммония тиоцианата и индикатора — ионов Fe3+:
Hg2+ + 2 NCS- = [Hg(NCS)2]
Избыточная капля титранта взаимодействует с ионами железа (III) и окрашивает раствор в красный цвет:
Fe3+ + 3 SСN- = Fe(SCN)3
красный
