
лекции Попова печатные
.pdf
Лекция 1
ЭЛЕКТРОХИМИЯ
Электрохимия – раздел физической химии, в котором изучаются законы взаимного превращения химической и электрохимической форм энергии и системы, где эти превраще-
ния совершаются. В электрохимии также изучаются физико-химические свойства ионных проводников, процессы и явления на границах раздела фаз с участием заряженных частиц – ионов и электронов. Электрохимические системы и явления рассматриваются как в равно-
весных условиях в отсутствие электрического тока, так и в неравновесных условиях при прохождении тока измеримых значений.
Вэлектрохимии сформировались два раздела:
1.Теория электролитов – занимается изучением равновесных и неравновесных свойств однофазных систем – электролитов.
2.Электрохимия гетерогенных систем.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Равновесие в растворах электролитов
По природе частиц, обеспечивающих прохождение электрического тока, выделяют
проводники первого и второго рода. Проводники первого рода (металлы) – электронная про-
водимость, носители заряда – электроны; проводники второго рода (растворы и расплавы электролитов) – ионная проводимость, носители заряда – ионы.
Электролиты – это вещества, которые в растворах или расплавах самопроизвольно частично или полностью способны распадаться на ионы. Ионы – заряженные частицы, спо-
собные к самостоятельному существованию.
Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона нейтральности, в соответствии с которым сум-
ма положительных зарядов равна сумме отрицательных. Таким образом, несмотря на нали-
чие ионов, раствор электролита остается электронейтральным.
Различают следующие типы электролитов:
x Бинарные электролиты распадаются на два иона Тип: 1 – 1 KCl два иона однозарядные
2 – 2 ZnSO4 два иона двухзярадные
3 – 3 La[Fe(CN)6] два иона трехзарядных
Бинарные электролиты являются симметричными.
1

x Тернарные распадаются на три иона: |
||
1 – 2 |
Na2SO4 |
одно- и двухзарядные ионы |
2 – 1 |
CaCl2 |
двух- и однозарядные ионы |
x Квартернарные распадаются на четыре иона |
||
1 – 3 |
Na3PO4 одно- и трехзарядные ионы |
|
3 – 1 |
Al(NO)3 |
трех- и однозарядные ионы |
Выделяют слабые (частичная диссоциация, α→0) и сильные (диссоциируют нацело, α→1). Данное разделение условно, т.к. степень диссоциации (α) зависит от растворителя и
концентрации.
Поведение слабых электролитов описывает теория Аррениуса:
1. Вещества, называемые электролитами при растворении диссоциируют на ионы.
Ионы представляют собой заряженные частицы, которые состоят из отдельных атомов или
группы атомов:
СН3СООН СН3СОО- + Н+
NaCl Na+ + Cl-
Предполагалось, что ионы в растворах ведут себя подобно молекулам идеального газа, т.е. не
взаимодействуют друг с другом.
2. Диссоциация молекул на ионы является неполной, т.е. не все молекулы электроли-
та, а лишь некоторая их доля α, названная степенью диссоциации.
|
|
|
|
|
|
D |
n |
|
|||
|
|
|
|
|
|
N |
|||||
n – число исходных молекул, распавшихся на |
|
ионы |
|||||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
N – общее число исходных молекул. |
|
|
|
|
|
||||||
|
3. Ионы и недиссоциированные молекулы находятся в равновесии, т.е. к процессу |
||||||||||
|
|
|
|
|
|
|
|
||||
электролитической диссоциации применим закон действующих масс. |
|||||||||||
|
|
|
|
|
|
|
|
||||
|
|
|
Закон разведения Оствальда |
||||||||
|
|
|
|
|
диссоциации для бинарного |
||||||
|
Установим связь константы диссоциации со степенью |
||||||||||
электролита KA, распадающегося на два иона: |
|
|
|
|
|
||||||
|
|
|
|
KA→Kz++Az- |
|
||||||
|
|
(вывод для электролита типа 1-1) |
|||||||||
|
= |
|
= |
|
1 − |
(1 − ) |
2
В общем случае для электролита |
K ν Aν : |
|
|
|||||
|
|
ν αc ν ν αc ν |
ν ν |
|
ν 1 αν |
|
|
|
KD |
c 1 α |
ν ν c |
|
|
|
|
||
1 α |
|
|
||||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Зависимость степени и константы диссоциации от различных факторов
-
Степень и константа диссоциации зависят от:
1)от природы электролита;
2)от природы растворителя (связано с диэлектрической проницаемостью);
3) от температуры (описывается изобарой Вант-Гоффа). |
при уши |
ln KD |
с t.ro |
|
Рис. 1.1. Зависимость константы диссоциации слабых электролитов
Так как по теории Аррениуса константа диссоциации является константой равновесия процесса диссоциации электролита на ионы, то для данного электролита, растворенного в
данном растворителе при заданной температуре она является величиной постоянной.
Факторы, влияющие на степень диссоциации, но НЕ влияющие
-
на константу диссоциации:
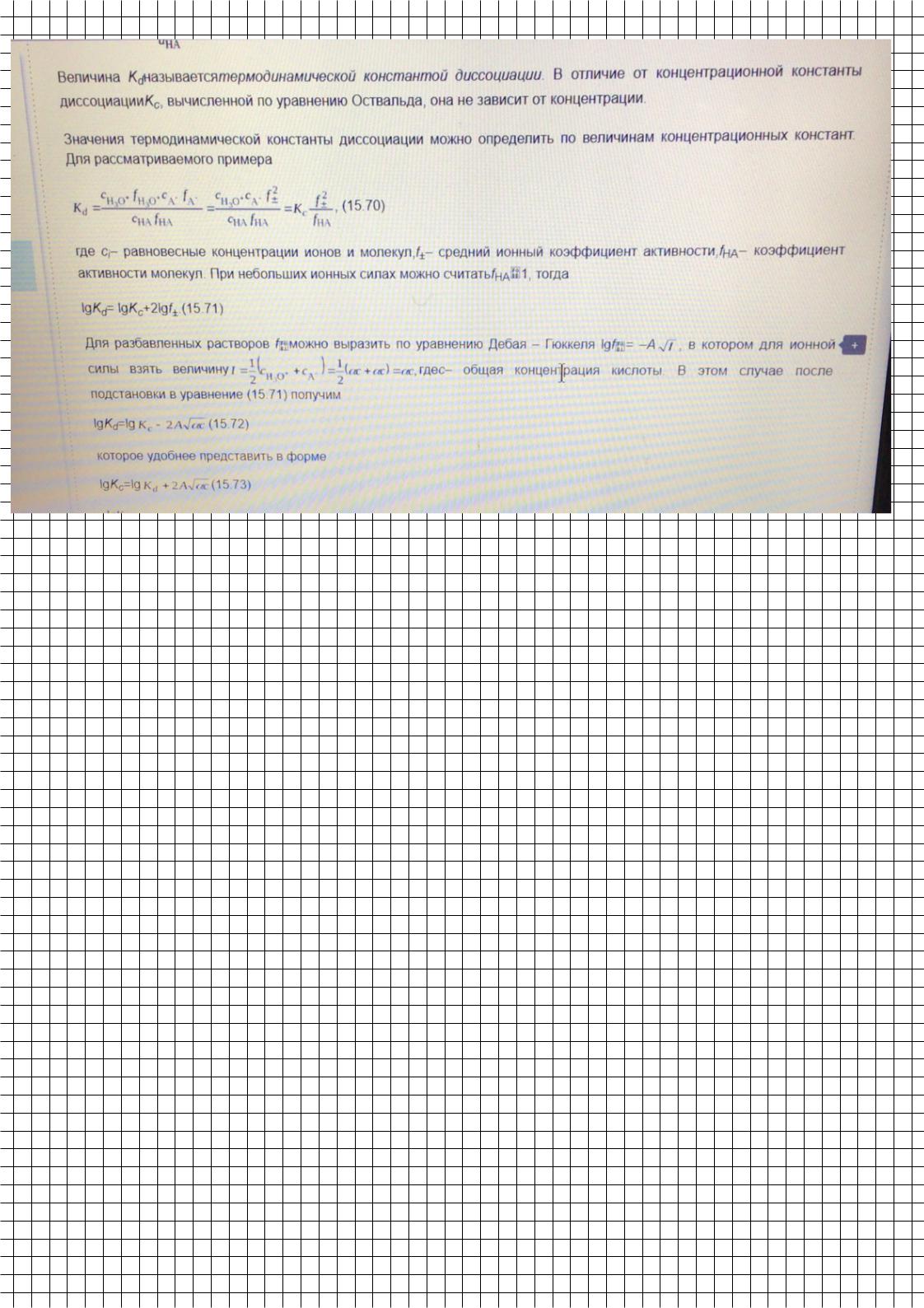
1=. Концентрация (разведение) электролита.
Рис. 1.2. Зависимость степени диссоциации слабого электролита от
концентрации (а) и разведения (б)
3

2. Присутствие посторонних электролитов: по отношению к данному электролиту
-
различают неиндифферентные (имеют общий ион – катион или анион) и индифферентные
(не имеют общих ионов с данным электролитом)
а) введение неиндифферентного электролита уменьшает степень диссоциации (свя-
занно с изменением концентрации ионов);
б) введение индифферентного электролита незначительно увеличивает степень диссо-
циации (связано с изменением коэффициента активности, для каждого электролита смотреть в отдельности).
Недостатки теории Аррениуса:
-теория оказалась применима только к разбавленным растворам;
-теория не объясняет механизм диссоциации;
-теория не учитывает взаимодействие молекул растворителя с ионами электролита;
-теория не учитывает взаимодействие между ионами электролита.
Причины электролитической диссоциации
Электролитическая диссоциация в растворе происходит вследствие взаимодействия молекул растворителя с молекулами вещества – сольватации. ( Гидранта вводе)
Растворы электролитов могут быть образованы двумя группами веществ. К первой группе относят вещества с ионной кристаллической решеткой – ионофоры. Например, хло-
рид натрия, который имеет кристаллическую решетку, в узлах которой находятся ионы Na+ и
Cl-. При растворении кристаллы разрушаются за счет взаимодействия ионов с диполями во-
ды, т.е. за счет гидратации.
гидр.G (Na+) + гидр.G (Cl-) = -1101 кДж/моль реш.G (NaCl) = 762 кДж/моль
Энергии гидратации ионов достаточно для разрушения кристаллической решетки и перехода ионов в раствор.
Ко второй группе относятся вещества, образующие ионы лишь при растворении –
ионогены. Например, в молекулах хлороводорода связь ковалентная. Однако при растворе-
нии в воде газообразного НСl в результате взаимодействия с водой образуется раствор силь-
ного электролита:
HCl + H2O = H3O+ + Cl-
Каждый из ионов гидратирован.(432 кДж/моль – энергия связи)
Строго говоря, ионной связи в «чистом» виде не существует эффективные заряды на
ионе натрия +0,92, а на ионе хлора –0,92.
4

Растворы сильных электролитов
Так сильные электролиты полностью диссоциированы даже в относительно концен-
трированных растворах. В разбавленных растворах, когда ионы находятся на большом рас-
стоянии друг от друга, взаимодействие между ними слабые и в основном электростатиче-
ские. По мере сближения ионов при увеличении концентрации возможно перекрывание их сольватных оболочек. При сближении катионов и анионов может происходить их ассоциа-
ция, при которой силы взаимодействия между ионами уже нельзя считать чисто электроста-
тическими. Еще более сильное неэлектростатическое взаимодействие возникает при образо-
вании в растворе комплексных тонов и молекул.
Американский физик Дж. Льюис ввел понятие активности (а) как некоторой фор-
мальной эффективной концентрации. Он показал, что все термодинамические уравнения для идеальных растворов, но с заменой в них концентраций на активности, согласуются с ре-
зультатами экспериментальных измерений.
В разбавленных растворах слабых электролитов можно пренебречь взаимодействием между ионами и тогда: 
KA = K+ + A–
∙
=
В концентрированных растворах, а также в присутствие постороннего сильного элек-
тролита электростатическое взаимодействие становится заметным:
= |
∙ |
= |
∙ |
∙ |
∙ |
= |
∙ |
∙ ± |
Коэффициент активности γ является мерой отклонения свойств реальных раство-
ров от свойств идеальных растворов: чем больше γ z 1, чем существеннее эти отклонения.
Коэффициент активности зависит от концентрации, давления, температуры и концентрации всех остальных компонентов раствора, так как учитывает взаимодействия между ними.
В растворах сильных электролитов даже при низких концентрациях взаимодействие в
←растворах проявляется значительно.
= |
+ (принцип |
Kν Aν ν Kz ν Az |
||
электронейтральности и условие |
аддитивности) |
|||
|
|
|
|
|
5

μ |
o |
|
½ |
|
μ RT ln a ° |
||||
μ |
|
μo |
RT ln a |
¾ |
|
° |
|||
|
|
|
¿ |
|
Подставляем в исходное выражение и путём несложных математических преобразо-
ваний получаем: |
ln = ln + ln . |
||||
Окончательно: |
|||||
|
|
= |
∙ . |
||
|
|
|
|
|
|
6

Лекция 2
Средние ионные величины
Невозможно приготовить раствор, содержащий только катионы или только анионы,
т.е. экспериментально определить активность для катионов и анионов в отдельности.
Поэтому вводится понятие о средней ионной активности электролита, которая обозначается как a± и представляет собой среднюю геометрическую величину от
активностей отдельных ионов.
a a ar
|
|
|
|
|
= |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
a aQ aQ |
|
aQ aQ |
|
aQ |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r |
|
r |
|
|
|
r |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
ar aQ aQ 1 ν |
|
|
a1 ν |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
Т.к. |
a |
|
m J |
|
½ |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¾ , получаем: |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
m J |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
¿ |
|
|
|
|
|
||||||||||||||||||||
ar |
ª |
|
ν |
(m J ) |
ν º1 ν |
m |
ν |
m |
ν |
1 ν |
(J ) |
ν |
(J ) |
ν 1 ν |
||||||||||||||||
¬(m J ) |
|
|
¼ |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
11= |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
mr |
m |
ν m |
ν |
1 ν |
– средняя ионная моляльность, |
||||||||||||||||||||||
(J )ν (J )ν |
ν |
– средний ионный моляльный коэффициент активности. |
||||||||||||||||||||||||||||
Тогда: ar |
mrJr . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-1 |
|||||||||||
Учитывая, что |
m |
ν |
|
m½ |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
¾ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
получаем: |
|
m |
ν m¿ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
||
|
|
|
|
a |
r |
|
|
|
ª(ν |
|
mJ |
|
)ν |
(ν |
|
mJ |
|
) |
ν º1 ν |
ν |
|
|
mJ |
|
|
|||||
|
|
|
|
|
|
|
|
¬ |
|
|
|
|
|
|
|
|
|
|
¼ |
|
r |
|
r |
|
||||||
Значения |
коэффициента |
|
νr |
|
(ν ν νν )1 ν , |
|
называемого |
иногда фактором |
||||||||||||||||||||||
валентности, |
для электролитов различного валентного типа приводятся в справочниках. |
|||||||||||||||||||||||||||||
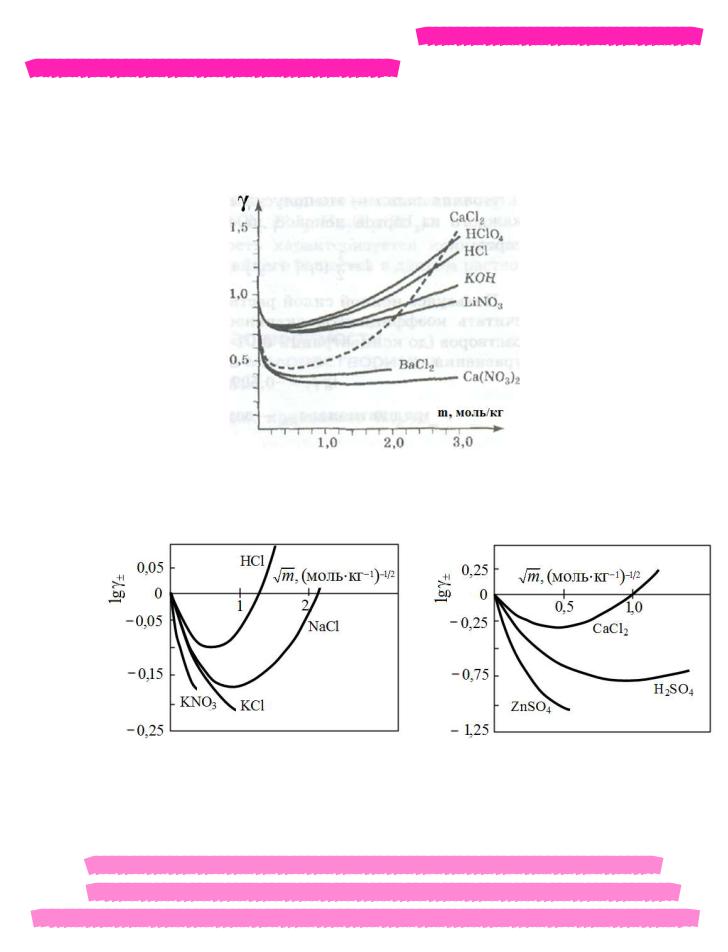
Экспериментальная зависимость
среднего ионного коэффициента активности от концентрации
В настоящее время теоретический расчет коэффициентов активности возможен только для очень разбавленных растворов, где преобладает наиболее простой тип электростатического взаимодействия между ионами. Для концентрированных растворов,
имеющих концентрации, используемые на практике, определение коэффициентов активности производится экспериментально.
Рис. 2.1. Зависимость коэффициентов активности некоторых сильных электролитов от моляльности их растворов
Рис. 2.2. Средние ионные коэффициенты активности электролитов, диссоциирующих на два (валентный тип 1-1) и три иона, при 298 K для водных растворов
Ионная сила и правило ионной силы (закон ионной силы Льюиса и Рендалла)
Активность, также как коэффициент активности, зависит от природы электролита,
природы растворителя, температуры, концентрации раствора, присутствия посторонних
2

электролитов и формально учитывает взаимодействие всех частиц в растворе. Суммарное влияние этих факторов на коэффициент активности проявляется через величину ионной силы раствора:
I12 ¦(mi zi2 )
Ионная сила раствора является мерой электростатического взаимодействия между всеми ионами в растворе и зависит от концентрации и заряда всех ионов, присутствующих в растворе.
Закон ионной силы Льюиса и Рендалла: коэффициенты активности электролита данного валентного типа одинаковы во всех растворах с равной ионной силой.
Теория сильных электролитов (теория Дебая-Хюккеля)
Воснове теории сильных электролитов лежат следующие положения.
1)сильные электролиты диссоциируют полностью (нацело);
2)ионы распределяются равномерно в растворе, находясь в непрерывном тепловом движении;
3)вокруг каждого иона формируется «ионная атмосфера»;
4)распределение заряда в ионной атмосфере, её размеры зависят от сил межионного взаимодействия, интенсивности теплового движения и носят статистический характер.
Основные уравнения теории Дебая-Хюккеля
а) Первое приближение теории Дебая-Хюккеля (предельный закон Дебая-Хюккеля)
-
|
|
|
lg J r = A _z+ z _ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
I |
|
|
|
|
|
|
|
|||||||||||||||||
- |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
б) Второе приближение теории Дебая-Хюккеля |
|
|
|
учет ранит |
сон |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
, |
|
Тем |
|||||||||||||
|
|
|
lgJr |
|
A | z z | |
|
|
|
I |
и |
сим |
нинзя |
. |
||||||||||||
|
|
|
|
|
|
|
|
|
, |
||||||||||||||||
|
|
|
1 Ba |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
I |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
в) Третье приближение теории Дебая-Хюккеля |
линий . завели |
|
Е |
от |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ĸеĸ |
|
|
|
|
|
|
|
lgJr |
A | z z | I |
|
|
|
CI |
|
. нерв |
. |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1 Ba |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
I |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теоретические расчёты средних ионных коэффициентов активности по первому приближению показали, что количественное согласие с опытными данными даже для электролитов 1-1 наблюдается лишь для достаточно разбавленных растворов.
3
