
лекции Попова печатные
.pdf
ЭДС гальванического элемента есть разность потенциалов катода и анода, или
правого и левого электродов.
Зависимость ЭДС элемента от активности участников химической реакции
(уравнение Нернста)
Пусть в гальваническом элементе протекает следующая окислительно-
восстановительная реакция:
aА + bB = сС + dD
Тогда уравнение Нернста имеет вид:
= − |
|
Уравнение Нернста может быть записано, как для суммарной реакции, т.е. для электрохимической цепи, так и для электродной полуреакции (рассматривается как реакция восстановления).
В качестве примера рассмотрим элемент Якоби–Даниэля. Напомним, что в элементе протекает следующая реакция:
Zn0 + Cu2+ = Zn2+ + Cu0,
-
тогда уравнение Нернста примет вид:
= − |
|
2
По определению активность конденсированной фазы равна единицы, тогда:
= |
|
− |
|
|
|
|
|
Переходя к десятичным логарифмам и учитывая2, что при 25 o C |
2,3RT |
0,059 , получаем: |
|||||
|
|
|
|
|
|
F |
|
|
o |
|
0,059 |
aZn2 |
|
|
|
E E |
|
|
2 |
lg a |
2 |
|
|
|
|
|
|
Cu |
|
|
|
5

Лекция 6
Классификация электродов
Согласно термодинамической классификации выделяют следующие основные типы электродов:
–электроды 1-го рода;
–электроды 2-го рода;
–электроды 3-го рода;
–газовые электроды;
–окислительно-восстановительные электроды
–мембранные (ионообменные) электроды.
Электроды 1-го рода
Электроды первого рода – электрохимическая система, состоящая из электронного проводника (металла или металлоида), погруженного в раствор, содержащий его ионы.
Условное изображение электрода (электронный проводник - металл):
MZ+µM
Электродная реакция:
MZ+ + ze- M
В электродах первого рода восстановленной формой является металл электрода, а
окисленной формой - ионы этого металла (простые или комплексные).
Уравнение Нернста:
|
/ = |
|
/ + |
Примеры:
CuSO4 | Cu
AgNO3 | Ag
Для электродов, образованных из неметалла, погружённого в раствор собственной соли, условная запись электрода, электродная реакция и уравнение Нернста записывается аналогично.
|
|
MZ-µM |
|
|
/ = 2 |
/ |
− 2 |
|
Te |
| Te |
|
|
|
|
Se | Se |
1

К электродам первого рода относят амальгамные электроды, в которых восстановленной формой является амальгама - сплав металла с ртутью.
Примером амальгамного электрода является кадмиевый электрод (12.5% Cd в ртути),
используемый в элементе Вестона:
Сd 2 | Cd (Hg )
Cd2+ + 2е- = Cd(Hg).
Потенциал амальгамного электрода является функцией как активности катиона в растворе аМZ+, так и активности металла в амальгаме aM(Hg).
E |
|
|
|
E |
0 |
|
|
|
RT |
aCd ( Hg ) |
Cd |
2 |
/ Cd |
Cd |
2 |
/ Cd |
|
ln |
|||
|
|
|
|
|
zF |
aCd 2 |
||||
|
|
|
|
|
|
|
|
|
z2
Электроды 2-го рода
Электрод 2-го рода – металлическая пластинка, покрытая слоем малорастворимого соединения этого металла и помещенная в раствор электролита, содержащего те же анионы, что и малорастворимое соединение.
|
|
Az | MQ AQ | M |
|
|
||
M |
A ne Q |
M Q |
|
Az |
||
|
Q Q |
|
|
|
|
|
/ |
/ |
= / |
= |
|
||
/ + |
|
|||||
Потенциал электрода второго рода зависит только от активности аниона в растворе
электролита. Электрод обратим по аниону.
-
KCl | Hg2Cl2 | Hg | Pt
Cl | AgCl | Ag
Электроды 3-го рода
Электрод 3-го рода - металл M, покрытый последовательно двумя малораство-
римыми соединениями с одним и тем же анионом: менее растворимого соединения MQ AQ
того же металла и более растворимого MQc AQ другого металла, который помещен в раствор электролита, содержащий катионы второго металла.
2

Mcz | McQ AQ (тв) | MQ AQ (тв) |M
Все рассмотренные выше электроды (1-го, 2-го и 3-го рода) характеризуются тем общим свойством, что металл электрода играет роль не только “посредника” в передаче электронов, но и является химически активным компонентом электродной окислительно-
восстановительной реакции.
Газовые электроды
Газовые электродысостоят из металлического проводника, который контактирует одновременно и с электрохимически активным газом, пропускаемым через раствор электролита, и с самим раствором, содержащим ионы, природа которых соответствует продуктам окисления или восстановления этого газа на электроде.
Газовые электроды могут быть обратимы относительно катиона (водородный электрод-) или относительно аниона (хлорный и кислородный электроды). В качестве проводника с электронной проводимостью используют инертные металлы: платина, иридий,
-золото и т.п.
Рассмотрим на примере хлорного электрода.
Хлорный электрод является примером газового электрода, обратимого по аниону.
Реализация обратимого газового хлорного электрода связана со значительными трудностями.
Условная запись:
|
Cl | Cl2 | |
Pt |
|
|
||
Электродная реакция: |
1/2Cl2 + e- = Cl- |
|
|
|||
Уравнение Нернста: |
|
|
|
|
|
|
|
|
|
|
R T |
1 / 2 |
|
|
0 |
|
|
ln |
a C l2 |
|
E C l |C l2 |
E C l |C l2 |
|
|
|
|
|
|
|
f- |
|
F |
|
a C l |
|
|
|
|
|
||
ECl |Cl |
0 |
ДЕ |
RT |
ln pCl2 |
|
RT |
lnaCl |
ECl |Cl |
|
|
|||||
2 |
2 |
|
2F |
|
1 |
F |
|
|
|
|
|
||||
|
|
|
|
|
|
3

Окислительно-восстановительные (Redox) электроды
Окислительно-восстановительный электрод - инертный проводящий материал
(токоподвод) (Pt, Ti, C), погруженный в раствор, содержащий окисленную и восстановленную форму одного и того же элемента.
Ox, Re d | Pt
На любом электроде протекают окислительно-восстановительные реакции и любой из рассмотренных ранее электродов можно назвать редокс – электродом. Однако редокс-
электроды отличаются от остальных тем, что электродная реакция протекает в объеме раствора, а инертный металл служит только для переноса заряда.
Окислительно-восстановительные электроды можно разделить на простые и
сложные.
Для простых окислительно-восстановительных электродов электродная реакция сводится к изменению степени окисления без изменения состава реагирующих веществ.
Например: Fe3+ +e- = Fe2+
Условная запись электрода: Fe3+,Fe2+| Pt
Электродный потенциал этого электрода зависит только от активности окисленной и восстановленной форм и определяется уравнением:
|
|
, |
| |
= |
, |
| − |
|
|
|
|
Исторически |
сложилось |
так, |
что |
|
окисленной |
формы |
записывают |
в |
||
активность |
|
|
||||||||
числитель, а активность восстановленной формы в знаменатель: |
|
|
|
|||||||
|
|
/ |
= |
/ |
|
|
|
|
|
|
В сложных |
+ |
реакция |
протекает с |
|||||||
|
окислительно-восстановительных электродах |
|||||||||
изменением степени окисления и состава реагирующих веществ. В таких реакциях обычно участвуют ионы Н3О+, OН- и молекулы воды.
MnO4 ,Mn2 ,H | Pt
Классификация электрохимических цепей
Гальванические элементы (электрохимические цепи) классифицируют по двум основ-
ным признакам:
4

–по источнику электрической энергии (физические, химические и концентрационные),
–по наличию или отсутствию в цепи границы раздела жидких фаз (с переносом или без переноса).
Среди физических гальва-
нических элементов выде-
ляют аллотропические,
=гравитационные и термо-
гальванические:
-
M(D) | MA | M(E)
(T1) Ni | NiSO4 || NiSO4 | Ni (T2 )
Различают два вида химиче- |
Различают два типа кон- |
|||
ских цепей: простые (без пе- |
центрационных |
элементов: |
||
реноса) и сложные (с перено- |
концентрационные элемен- |
|||
сом): |
ты без переноса (с одним |
|||
Pt | H2 | HCl | AgCl | Ag | Pt |
раствором) и с переносом |
|||
Pt | H2 | HCl | Cl2 | Pt |
(с двумя растворами): |
|||
Cu | Zn | ZnSO 4 || CuSO 4 | Cu |
Pt | H2 ( p1) | HCl | H2 ( p2 ) | Pt |
|||
Ni | NiSO4 || KCl | Hg2Cl2 | Hg | Ni |
Ag | AgNО |
(a ) ¦AgNO (a ) | Ag |
||
|
3 |
1 |
3 |
2 |
|
|
|
|
|
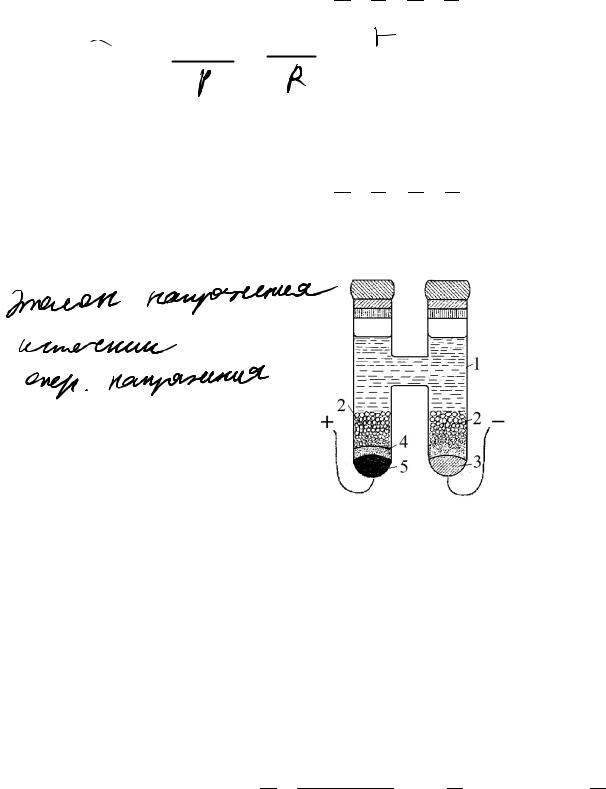
Рассмотрим подробнее некоторые гальванические элементы:
а) Pt | H2 ( p1) | HCl | H2 ( p2 ) | Pt - концентрационная цепь без переносомна
(+) 2Н++2е=Н2 (-) Н2-2е=2Н+
2Н++ Н2(р1)= Н2(р2)+2Н+
5

Лекция 7
Зависимость ЭДС электрохимической цепи от температуры
Термодинамические соотношения, описывающие влияние температуры на ЭДС гальванических элементов, могут быть установлены на основе уравнений, выражающих зависимость изменения энергии Гиббса химической реакции от температуры и давления соответственно.
§ w' |
G |
· |
'r S , |
|
||
¨ |
r |
|
¸ |
|
||
© |
wT |
¹p |
|
|
||
учитывая, что |
|
−∆ , |
= . |
, |
||
имеем: |
|
|
|
|||
|
|
Гиббса-Гельмгольца: |
||||
Из термодинамики известно уравнение∆ = |
|
|
||||
|
|
|
|
§ w'rG · |
, |
|
'rG 'r H T 'r S 'r H T ¨ |
¸ |
|
||||
|
|
|
|
© |
wT ¹p |
|
при подстановке выше упомянутых выражение получим:
− = ∆ −
или
Уравнения |
которые |
= −∆ |
+ |
|
|
. |
|
Wэл |
zFE |
|
|||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
связывают электрическую |
|
работу |
( |
|
|
|
|
|
) или ЭДС |
|||
электрохимической цепи с тепловым эффектом химической реакции ( 'r H ) и температурным |
|||||||||||||||
|
|
§ w E · |
электрохимической формой уравнений Гиббса– |
||||||||||||
коэффициентом ЭДС ¨ |
¸ , называют |
||||||||||||||
|
|
© wT |
¹p |
|
|
|
|
|
|
|
|
|
|
|
|
Гельмгольца. |
В данных уравнениях 'r H характеризует тепловой эффект реакции при ее |
||||||||||||||
|
|
|
|
|
, |
выражение |
|
|
|
|
|
||||
необратимом протекании в условиях←p const а |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= ∆ = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
представляет собой теплоту обратимо протекающей химической реакции. |
|
|
|
|
|||||||||||
|
|
|
Анализ работы электрохимической цепи |
|
|
|
|
||||||||
§ w E · |
0 . |
|
|
ĸ |
.it#tTEI |
||||||||||
а) ¨ |
¸ |
|
|
|
|
|
|
|
|
|
|
||||
© wT ¹p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭДС элемента не зависит от температуры и тогда: |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Wэл |
zFE 'r H |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |

Такой элемент будет вырабатывать электрическую энергию, т.е. производить положительную электрическую работу только при условии, что химическая реакция,
протекающая в гальваническом элементе, является экзотермической ( 'rH 0 ).
←Электрическая работа в данном случае точно равняется тепловому эффекту химической реакции. При этом работа гальванического элемента не сопровождается обменом теплотой с окружающей средой.
б) |
§ w E · |
0 . |
¨ ¸ |
||
|
© wT ¹p |
|
ЭДС элемента падает с увеличением температуры, а электрическая работа меньше энтальпии химической реакции:
Wэл zFE 'r H
Электрическая энергия может быть получена только при условии, что химическая реакция, протекающая в гальваническом элементе, является экзотермической ( 'r H 0 ). При этом лишь часть энергии химической реакции превращается в электрическую работу, другая же ее часть выделяется в окружающую среду. Тогда, в условиях теплоизоляции или плохого теплообмена, гальванический элемент при работе будет нагреваться.
в) § w E · ! 0 . ¨© wT ¸¹ p
ЭДС элемента возрастает с увеличением температуры, а электрическая работа больше величины теплового эффекта реакции:
Wэл zFE ! 'r H
Поскольку температурный коэффициент ЭДС положителен, то 'r S ! 0 , а значит,
гальванический элемент работает с поглощением тепла из окружающей среды. Если элемент изолирован от окружающей среды, то в процессе работы он будет охлаждаться.
В рассматриваемых условиях электрическая энергия в гальваническом элементе может быть получена при протекании в нем как экзотермической, так и эндотермической реакции.
На рисунке приведена зависимость ЭДС гальванического элемента от температуры для
различных случаев:
§ w E · |
0 , |
|
1– ¨ |
¸ |
|
© wT ¹p |
|
|
§ w E · |
! 0 : а – 'rCp 0 , б – 'rCp 0 , в – 'rCp ! 0 , |
|
2 – ¨ |
¸ |
|
© wT ¹p |
|
|
2

§ w E · |
0 |
|
3 – ¨ |
¸ |
|
© wT ¹p |
|
|
Зависимость ЭДС электрохимической цепи от давления
Очевидно, что влияние давления на ЭДС будет существенно только для гальванических элементов с газовыми электродами, поскольку лишь в этом случае изменение объема ( 'rV )
в ходе реакции, протекающей в гальваническом элементе, может быть существенным.
Так как ∆ = ∆ ,
а ∆ = −, то = − ∆ .
Если ∆ > 0, то Е уменьшается с ростом температуры, а если ∆ < 0 – то возрастает.
Применение измерений ЭДС
1) Определение термодинамических функций химических реакций – используются химические цепи: измеряют ЭДС гальванического элемента при различных температурах и определяют температурный коэффициент ЭДС, т.е. величину wE wT p :
wT p :
∆ , = −,
∆ = ,
∆= ∆ G+T∆
2)Определение константы химического равновесия – необходимо составить гальванический элемент, в котором исследуемая реакция могла бы быть осуществлена:
=
- НЕЕ г |
ТНК |
3 |
|
||
|
|
|
- |
|
|
