
лекции Попова печатные
.pdf
Между количеством лучистой энергии, поглощенной молекулами вещества, и
количеством фотохимически прореагировавших молекул существует соотношение,
выражаемое законом фотохимической эквивалентности Штарка – Эйнштейна:
Число молекул, подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов электромагнитного излучения.
Поскольку фотохимическая реакция, как правило, включает в себя и вторичные процессы (например, в случае цепного механизма), для описания реакции вводится понятие квантовый выход фотохимической реакции:
Квантовый выход фотохимической реакции γ есть отношение числа частиц,
претерпевших превращение, к числу поглощенных веществом квантов света.
Квантовый выход реакции может варьироваться в очень широких пределах: от 10- 3(фотохимическое разложение метилбромида) до 106 (цепная реакция водорода с хлором); в
общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция. Значения квантового выхода меньше единицы объясняются тем, что молекулы теряют часть поглощенной энергии, излучая энергию или сталкиваясь с другими молекулами раньше, чем получают возможность прореагировать. Если за первичной фотохимической реакцией следуют вторичные, то квантовый выход будет больше единицы.
Первичными фотохимическими реакциями называются реакции, в которых участвуют электронно-возбужденные молекулы.
Примеры первичных фотохимических реакций:
1.Флюоресценция
→ +
2.Дезактивация при соударении
+ → +
М– валентно-насыщенная молекула или стенка сосуда
3.Прямая спонтанная диссоциация
→ +
4.Диссоциация при столкновении
+ → + +
5.Изомеризация
→
6.Реакции с другими молекулами
+ →
2

Если продуктами первичной фотохимической реакции являются свободные радикалы
или атомы, то развиваются вторичные реакции.
Примеры вторичных фотохимических реакций:
1.Рекомбинация
+ + → +
2.Реакция с продуктом или другой молекулой с регенерацией исходного вещества
+ → +
3.Нецепные реакции без участия и без образования исходного вещества А
+ → +
4.Нецепные реакции с участием новых молекул исходного вещества А
+ → +
5.Цепные реакции без участия исходного вещества А
+ → +
+ → +
6.Цепные реакции с участием вещества А
+ → +
+ → +
Кинетика фотохимических реакций
Закон светопоглощения Ламберта – Бугера – Бера:
=
– интенсивность света, падающего на вещество;
– интенсивность света, прошедшего через вещество;
k – коэффициент поглощения;
с – концентрация вещества;
l – толщина поглощающего слоя.
Скорость фотохимической реакции определяется числом прореагировавших молекул в единицу-времени в единице объема.
= =
Поглощенную энергию можно выразить через интенсивность светового потока:
= − = −
= ( − )
3

Из уравнения следует, что скорость первичной фотохимической реакции не зависит от
температуры. -
-
При высоких концентрациях вещества фотохимическая реакция протекает как реакция первого порядка:
= |
|
|
|
При небольших концентрациях – первый порядок реакции:
= = оп
ЦЕПНЫЕ РЕАКЦИИ
Цепные реакции — это химические процессы, в которых превращение исходных веществ в конечные продукты осуществляется путем регулярного чередования нескольких реакций с участием свободных радикалов (или атомов), идущих с сохранением свободной валентности.
Свободные радикалы, участвующие в цепной реакции, часто называют активными центрами цепной реакции.
По цепному механизму протекает ряд важных классов химических реакций:
1)окисление молекулярным кислородом, в том числе горение;
2)галоидирование многих соединений;
3)некоторые реакции термического распада, например, пиролиз углеводородов;
4)многие реакции полимеризации.
Любая цепная реакция обязательно включает три основные стадии: зарождение,
продолжение и обрыв цепи.
Зарождением (инициированием) цепей называется стадия цепной реакции, в которой образуются свободные радикалы из валентно-насыщенных молекул исходных веществ.
Реакциями продолжения цепей называются стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к расходованию исходных веществ и образованию продуктов реакции.
Обрывом цепей называются стадии цепной реакции, приводящие к исчезновению свободной валентности.
В некоторых цепных реакциях наряду с элементарными стадиями зарождения,
продолжения и обрыва цепей происходят процессы с участием активных центров или стабильных продуктов реакции, идущие с увеличением числа активных центров — атомов и свободных радикалов.
4

Элементарная стадия цепной реакции, в которой превращение активных промежуточных частиц или реакционноспособных продуктов реакции приводит к увеличению числа свободных радикалов или атомов, называется разветвлением цепи.
Цепные реакции, в которых отсутствует стадия разветвления цепей, называются
неразветвленными цепными реакциями. Цепные реакции, в которых имеется стадия разветвления, называются разветвленными цепными реакциями.
Неразветвленные цепные реакции
Классическим примером неразветвленных цепных реакций является хлорирование водорода.
Простая бимолекулярная реакция
H 2 Cl2 o 2HCl
не идет из-за запрета симметрии. Основным каналом реакции является превращение по следующему неразветвленному цепному механизму:
— стадия зарождения (инициирования) цепи;
звено цепи
линейный
обрыв
квадратичный
обрыв
"
n
—стадии
и' продолжения цепи;
—стадии обрыва цепи;
—стадии обрыва цепи.
Реакции зарождения цепи
Примеры:
1) C |
|
H |
|
I |
o |
x |
|
H |
|
+ Ix |
— гомолитическая диссоциация с разрывом наименее прочной |
2 |
5 |
C |
2 |
5 |
|||||||
|
|
|
|
|
|
|
|
||||
связи C I |
; |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
5 |
2) Cl2 |
|
|
|
|
|
|
x |
|
|
— гетерогенная реакция диссоциации; |
||
+ стенка |
|
o |
Cl + Clадс |
|||||||||
3) Cl2 |
|
|
|
|
|
x |
— инициирование светом; |
|||||
+ hQ |
|
|
|
o |
2 Cl |
|||||||
4) Hg |
+ hQ |
|
|
|
o Hg * , |
|
|
½ |
|
|||
|
|
|
|
|
° |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
° |
фотосенсибилизированное |
|
|
|
|
|
|
|
|
|
|
|
¾ |
|
Hg * + C |
|
H |
|
|
o |
x |
|
|
x |
° |
инициирование. |
|
3 |
8 |
|
C |
H + H + Hg |
° |
|
||||||
|
|
|
|
|
|
3 |
7 |
|
¿ |
|
||
5) распад инициатора, вводимого в систему в виде добавки:
x
NOCl o NO + Cl ;
6) реакции переноса электрона с участием инициатора:
RH + CoIII |
x |
o R + CoII + H+ ; |
7) инициирование в бимолекулярных реакциях:
x x
RH + O2 o R + H O2 .
Реакции продолжения цепи
Примеры последовательности реакций продолжения, образующих звено цепи:
1) |
x |
O2 |
|
x |
|
R |
o |
RO2 , |
|
||
|
|
|
|
|
|
|
x |
|
|
|
x |
|
RO2 RH |
|
o ROOH |
R . |
|
|
|
|
|
|
|
Такие |
звенья |
реализуются в |
реакциях окисления углеводородов и альдегидов |
||
x |
|
|
|
|
|
|
|
|
|
(R — радикал углеводорода или альдегида). |
|||||||||
2) |
x |
O2 |
|
|
x |
, |
|
|
|
CH3 |
|
o CH3 O O |
|
|
|||||
|
-------- |
|
|
|
|
|
|
|
|
|
|
x |
|
|
x |
|
|
|
|
|
CH3O O |
|
o |
CH2OOH , |
|
|
|
||
|
x |
|
|
o CH O |
x |
|
|
|
|
|
CH OOH |
|
OH , |
|
|||||
|
2 |
|
|
|
2 |
|
|
|
|
|
x |
CH |
|
|
o H O |
|
x |
|
. |
|
OH |
4 |
|
CH |
3 |
||||
|
|
|
|
2 |
|
|
|
||
----------
Такое звено реализуется при окислении (горении) метана.
3) |
RH |
x |
o |
x |
, |
|
Hal |
HHal + R |
|||||
|
|
|
-------- |
|
|
|
|
x |
Hal2 |
o |
x |
|
|
|
R |
RHal + Hal . |
||||
|
|
|
|
|
-------- |
|
Такие звенья реализуются при галогенировании углеводородов и водорода.
6

В результате последовательности реакций продолжения, образующих звено цепи,
=вновь возникает свободный радикал, начавший эту последовательность.
Начавшись с образования свободного радикала в стадии зарождения цепи, звено цепи будет повторяться многократно, пока свободные радикалы не погибнут в реакциях обрыва цепи. Число этих повторов от момента зарождения цепи до момента ее обрыва называют
длиной цепи. В цепных неразветвленных реакциях длина цепи может изменяться от
нескольких единиц до 106 .
Длину цепи можно вычислить из соотношения
QWпродолжения
Wобрыва
При стационарном протекании неразветвленной цепной реакции
Wобрыва Wзарождения
Поэтому Q можно вычислить также и из соотношения
QWпродолжения
Wзарождения
Скорость неразветвленной цепной реакции в целом
W Wзарождения Q
Реакции обрыва цепи
Различают два типа реакций обрыва цепи: реакции линейного обрыва и реакции
квадратичного обрыва.
Реакциями линейного и квадратичного обрыва называются реакции обрыва цепи,
скорость которых пропорциональна концентрации свободных радикалов в первой и второй
степени, соответственно.
|
Реакции линейного обрыва |
|
|||
|
Линейный обрыв цепи возможен в результате: |
||||
1) |
захвата свободных радикалов стенками реакционного сосуда |
||||
|
x |
|
o |
x |
|
|
R |
s |
Rадс ; |
|
|
2) |
взаимодействия свободных радикалов с соединениями металлов переменной валентности |
||||
|
x |
Men+ |
o RO2 Me(n+1)+ ; |
||
|
RO2 |
||||
3) |
взаимодействия свободных радикалов с молекулами, приводящего к образованию менее |
||||
|
активных свободных радикалов |
||||
|
x |
|
|
x |
M . |
|
H O2 |
M |
o HO 2 |
||
|
|
|
|
|
7 |

Такой путь обрыва называется обрывом цепи на молекулах ингибитора.
Ингибиторы цепных реакций — это вещества, добавление которых в идущую цепную реакцию приводит к замене активных свободных радикалов, ведущих цепь, на малоактивные радикалы, не способные продолжать цепь.
Реакции квадратичного обрыва
Поскольку в результате каждого элементарного акта квадратичного обрыва цепи гибнут два активных центра, то выражение для скорости квадратичного обрыва будет иметь вид
W 2 k г C2x
R
Различают два типа процессов квадратичного обрыва: рекомбинация и диспропорционирование.
Пример рекомбинации:
|
|
x |
x |
o C2H6 |
|
|
CH3 |
CH3 |
|
Пример диспропорционирования: |
|
|
||
x |
H5 |
x |
H5 |
o C2H4 C2H6 |
C 2 |
C 2 |
|||
Квадратичный обрыв цепей является основным путем гибели свободных радикалов в цепных реакциях, протекающих в жидкой фазе и в газовой фазе при больших давлениях, когда диффузия свободных радикалов к стенке затруднена.
Квадратичный обрыв цепей в реакциях между атомами или свободными радикалами может происходить в бимолекулярных или тримолекулярных реакциях, в зависимости от того,
какая из двух стадий — собственно рекомбинация или отвод энергии, выделившейся при рекомбинации, лимитирует рекомбинацию.
8

Лекция 15
Кинетика неразветвленных цепных реакций
Через некоторое время после начала реакции концентрация активных частиц перестает
изменяться, то есть устанавливается квазистационарный режим протекания процесса. При
-этом число возникающих активных частиц равно числу гибнущих.
В ряде случаев кинетические уравнения для стабильных компонентов реакции можно привести к уравнениям реакций простых типов с целыми или кратными 0,5 порядками по
исходным веществам.
Для этого должны выполняться два условия:
- длина цепи должна быть достаточно велика, что позволяет пренебречь скоростями зарождения и обрыва по сравнению со скоростями реакций продолжения цепи;
- скорость обрыва цепей с участием одного из свободных радикалов (атомов) должна существенно превышать скорость обрыва с участием других радикалов (или атомов).
В этом случае скоростью неразветвленной цепной реакции считают скорость реакции продолжения цепи с участием свободного радикала (атома), на котором происходит основной обрыв цепей. Эта стадия является лимитирующей.
Рассмотрим вывод уравнения на примере реакции фотохимического хлорирования муравьиной кислоты.
|
Схема механизма |
|
|
+ → 2 + |
|
|||||
|
|
|
̇ |
реакции: |
|
|
|
|
|
|
1. |
|
|
|
|
зарождение |
|
||||
|
+ → 2 |
|
|
|
|
|
|
|||
2. |
̇ |
|
|
|
̇ |
|
|
продолжение |
|
|
|
+ → + |
|
|
|
||||||
3. |
|
̇ |
|
|
̇ |
цепи |
|
|||
4. |
|
+ → + + |
обрыв цепи |
|
||||||
|
+ стенка → |
|
|
|
|
|
|
|||
|
|
|
|
адс. |
|
|
|
|
описывается |
|
|
Лимитирующей |
стадией |
является |
стадия (2), скорость реакции |
||||||
|
̇ |
|
|
|
|
|||||
уравнением: |
|
|
= |
̇ |
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
[ ] |
|
||
В полученное уравнение входит концентрация атомов хлора, которую нужно выразить через концентрации устойчивых молекул, используя принцип стационарных концентраций:
̇
= обр − расх = 0
Атом хлора образуется в реакциях (1) и (3) и расходуется в реакциях (2) и (4).
̇ |
|
|
|
|
|
|
̇ |
− |
̇ |
[ ] − |
̇ |
|
= 2 [ ] + [ ] |
|
= 0 |
1

Аналогично записываем выражение для радикала |
̇ |
|
: |
||||||
|
|
̇ |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
̇ |
|
] − [ ] |
̇ |
|
||
|
|
|
|
|
|||||
Складывая эти |
уравнения=, получим[ : |
= 0 |
|||||||
|
2 [ ] |
|
|
|
|
||||
|
|
|
̇ |
|
|
|
|||
|
|
|
= |
|
|
|
|
|
|
Подставляя полученное выражение в уравнение для скорости реакции получим:
= |
̇ |
[ ] = |
2 |
[ ][ ] |
|
|
Разветвленные цепные реакции. Критические явления в химической кинетике
В некоторых экзотермических реакциях наблюдаются так называемые критические явления. Эти явления состоят в резком переходе от полной инертности реагентов к быстрому их взаимодействию при очень малом изменении таких параметров, как общее давление,
концентрация реагентов, размер реакционного сосуда, температура.
Тот факт, что критические явления наблюдаются только для экзотермических реакций,
←указывает на связь этих явлений с запасом химической энергии у реагентов. Химическая энергия, запасенная в реагентах, может трансформироваться в три формы энергии.
1.В химическую энергию активных промежуточных частиц. Такая трансформация имеет место в классических разветвленных цепных реакциях.
2.В тепловую энергию одновременно возбуждаемых поступательных, вращательных и колебательных степеней свободы молекул. Такая трансформация имеет место при тепловом взрыве.
3.В энергию некоторых селективно возбуждаемых внутренних степеней свободы реагентов и продуктов реакции. Такая трансформация имеет место в цепных реакциях с энергетическим разветвлением.
Критические явления возникают тогда, когда переход химической энергии в одну из указанных трех форм оказывает ускоряющее воздействие на реакцию. Другими словами, они возникают тогда, когда имеется положительная обратная связь между скоростью преобразования химической энергии реагентов (т. е. скоростью реакции) и количеством энергии, перешедшей в одну из трех указанных форм. При наличии положительной обратной связи критическое явление возникает вследствие того, что энергия в виде одной из трех упомянутых выше форм генерируется в ходе реакции быстрее, чем релаксирует. В результате она накапливается и приводит к автоускорению процесса.
2
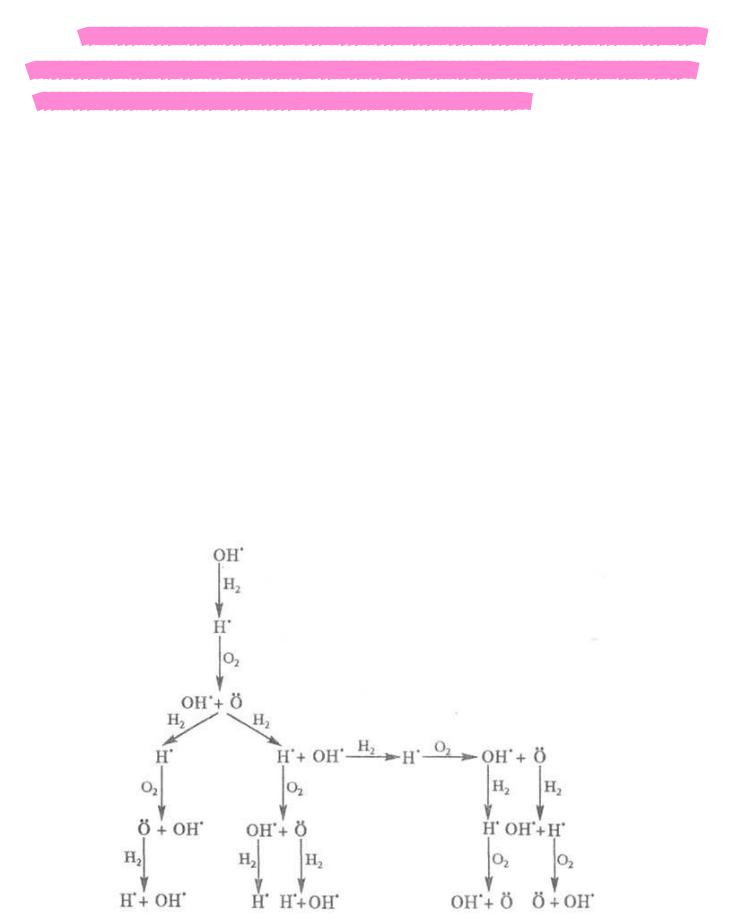
Основные кинетические особенности химических реакций, демонстрирующих критические явления, рассмотрим на примере хорошо изученной реакции окисления водорода кислородом. Эта реакция протекает по следующему механизму:
1.зарождение цепи
H2 + O2 → 2OH•
H2 + O2 → H• + HO2• HO2• + H2 → OH• + Н2O
2.продолжение и разветвление цепи:
OH• + H2 → H2O + H• H• + O2 → OH• + •O• •O• + H2 → OH• + H•
.…………………………
3.обрыв цепи:
H• + стенка → H(адс) ОH• + стенка → OH(адс)
H• + O2 + M → •HO2 + M •HO2 + стенка → ½H2O + ½O2
Схематически процесс можно представить следующим образом:
3
