
- •ЛЕКЦИЯ 4(дистанционно)
- •1. Строение, классификация и номенклатура комплексных соединений(КС).
- •Биолиганды:
- •n- координационное число -
- •Дентантность – число связей, образуемых лигандом и комплексообразователем
- •Вернер Альфред (12.XII.1866–15.XI.1919)
- •Изомерия КС:
- •Классификация и номенклатура комплексных соединений
- •• III тип: наиболее распространена классификация по
- •Комплекс называется следующим образом:
- •2. Химическая связь и свойства комплексных соединений (КС)
- •Метод валентных связей
- •Теория кристаллического поля
- •Типы электроных переходов при поглощении света
- •1,10- Фенантролин
- •Изомерия КС:
- •Теория Льюиса
- •Свойства КС
- •Свойства КС
- •КС в аналитической химии
- •Дентантность – число связей, образуемых лигандом и комплексообразователем
- •Аффинная хроматография
- •3. Комплексные соединения в диагностике
- •Аффинная хроматография

ЛЕКЦИЯ 4(дистанционно)
Комплексные соединения :
строение и свойства
ВОПРОСЫ:
1.Строение, классификация и номенклатура комплексных соединений(КС).
2.Химическая связь в КС. Свойства КС.
3.КС в аналитической химии и диагностике.

1. Строение, классификация и номенклатура комплексных соединений(КС).
Комплексными соединениями называются вещества, молекулы которых состоят из центрального атома (или иона) – М, непосредственно связанного с определенным числом n других молекул или ионов L, называемых лигандами:
M + nL ↔ [MLn]

M + nL ↔ [MLn]
Комплексообразователь (М) (центральный атом) - атом или ион - который является акцептором электронной пары
(атомы или ионы s, p,d- и f-металлов)
Лиганды (L) - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с
комплексообразователем (анионы; нейтральные соединения: Н2О, NH3, CO, R-OR (эфиры), RNH2 (амины); макросоединения: белки, НК и т.д.).

Биолиганды:
АК и белки: глутатион, цистеин, метионин, ферменты;
Азотистые основания, олиго- и полинуклиотиды, нуклеозиды;
Биополимеры: полисахариды, гликопротеины,липиды

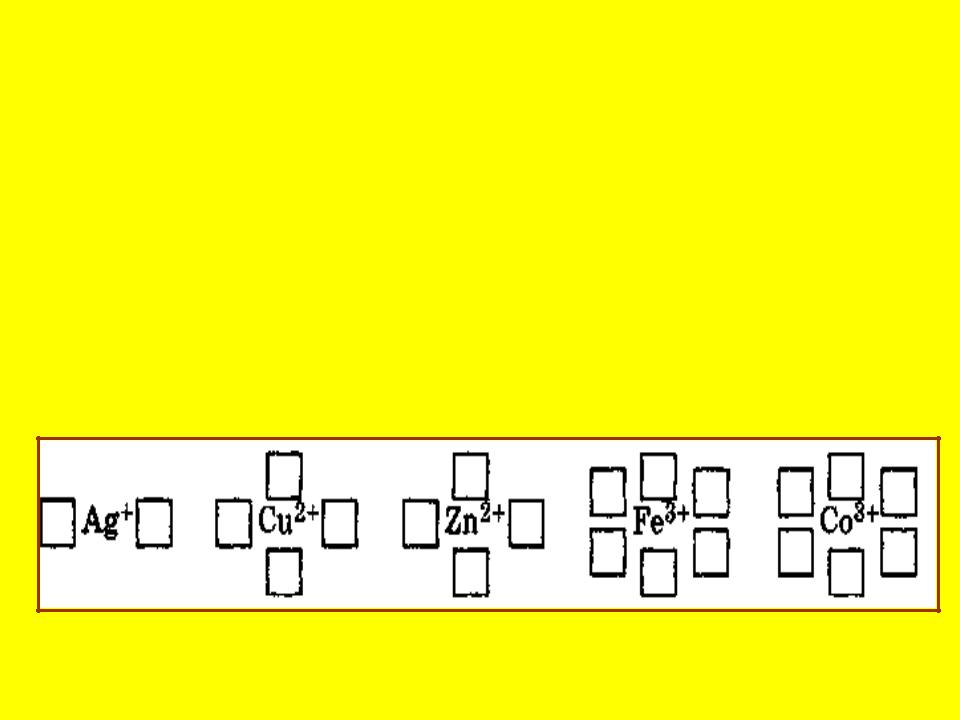
 n- координационное число -
n- координационное число -
- число свободных атомных орбиталей, предоставляемых комплексообразователем ( удвоенный заряд иона комплексообразователя)

Дентантность – число связей, образуемых лигандом и комплексообразователем

Вернер Альфред (12.XII.1866–15.XI.1919)
Швейцарский химик. Основоположник химии комплексных (координационных) соединений. Выдвинул и развил (1893) координационную теорию строения комплексных соединений. Предсказал (1899) существование оптически активных изомеров, не имеющих асимметрического углеродного атома.
Нобелевская премия (1913).

Изомерия КС:
• Геометрическая
•(цис- транс- расположение лигандов)
•Гидратная (ионизационная, координационная)
[Cr(H2O)6]Cl3 – трихлорид гексааквахрома (III) – фиолетового цвета,
[CrCl(H2O)5]Cl2∙H2O – моногидрат дихлорид пентааквахлорохрома (III)
– сине-зеленого цвета,
[CrCl2(H2O)4]Cl∙2H2O – дигидрат хлорид тетрааквадихлорохрома (III)
– зеленого цвета.
• Оптическая (правые и левые изомеры)
• Структурная (стереохимия)

Классификация и номенклатура комплексных соединений
• I тип: комплексные соединения с одинаковыми
лигандами называются однородными (монолигандными), а с разными лигандами — неоднородными (полилигандными).
• II тип: за основу берётся химическая природа
комплекса:
Нейтральные: [MLn].
Например: [Fe(CO)5] – пентакарбонилжелезо
Анионные: Кат[MLn].
Например:K3[Fe(CN)6] – гексацианоферрат(III) калия
Катионные: [MLn]Ан.
Например: [Co(H2O)6]SO4 – сульфат гексааквакобальта(II)
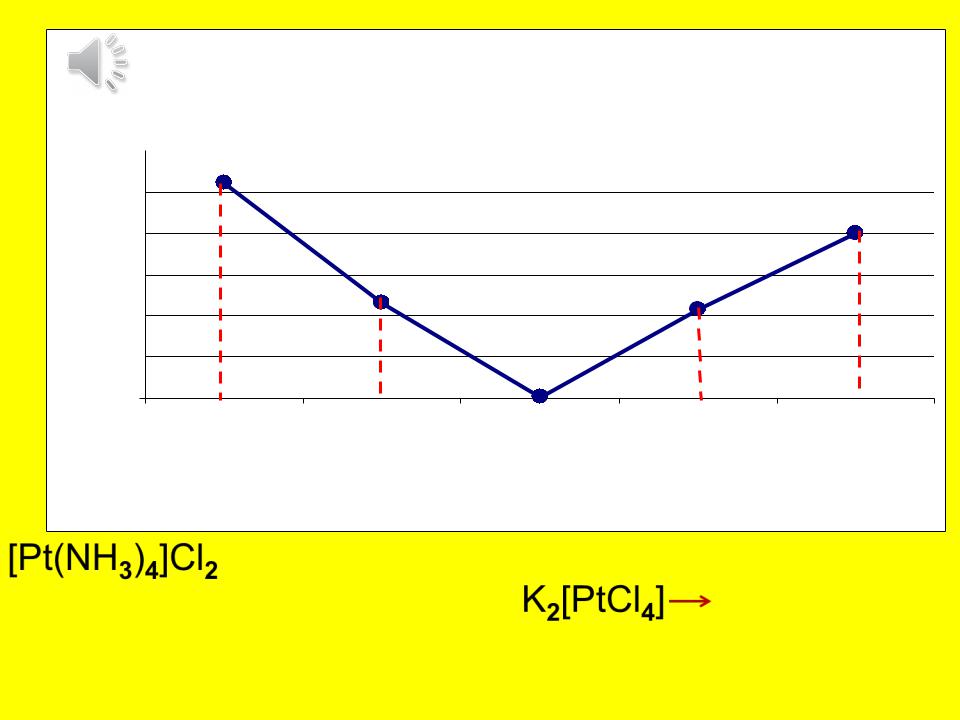
|
Изменение электропроводности растворов |
|
|||
|
комплексных соединений платины |
|
|||
|
300 |
|
|
|
|
|
250 |
|
|
|
|
мСм/см |
200 |
|
|
|
|
150 |
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
0 |
|
|
|
|
|
[Pt(NH3)4]Cl2 |
[Pt(NH3)3 Cl]Cl |
[Pt(NH3)2 Cl2] |
K[Pt(NH3)Cl3] |
K2[Pt Cl4] |
|
|
|
Нейтральное КС |
|
|
КС катионого типа |
КС анионого типа |
|
 [Pt(NH3)4]2+ + 2Cl-
[Pt(NH3)4]2+ + 2Cl-
2K+ + [PtCl4]2-
[Pt (NH3)2Cl2] - прочное соединение, диссоциирует незначительно
