
3) Опыт 14.4 Влияние неравномерной аэрации на процесс коррозии:
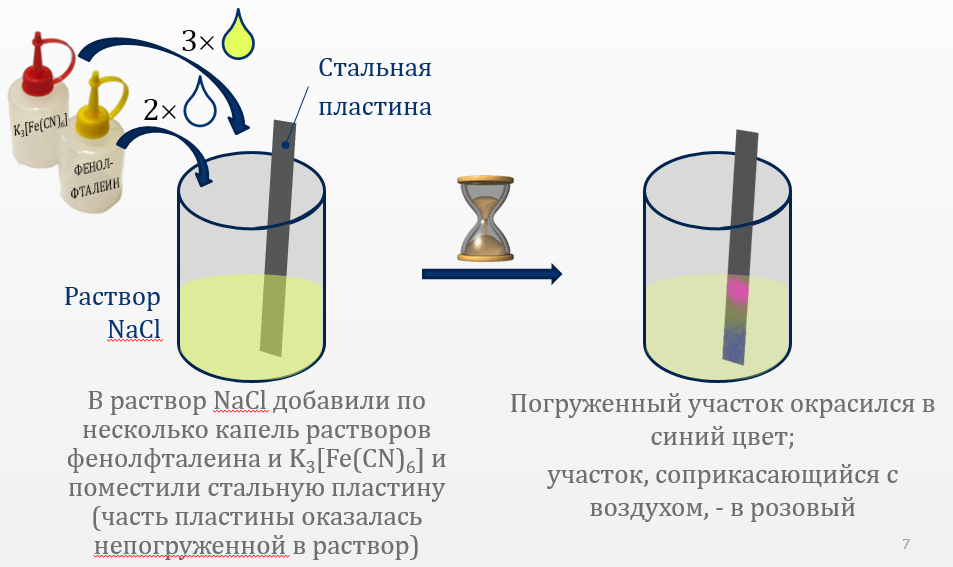 Зачищенную
наждачной бумагой железную пластину
поместить в пробирку с 3 %-м
раствором NaCl,
так чтобы часть пластины оказалась
непогруженной в раствор. Добавить в
раствор по 2 капли K3[Fe(CN)6]
и фенолфталеина. Наблюдать окрашивание
в синий цвет раствора вокруг участка
пластины, который находится в растворе,
и окрашивание в розовый цвет того
участка, который соприкасается с
воздухом. Объяснить и написать процессы,
происходящие на электродах короткозамкнутых
гальванических элементов, образовавшихся
вследствие неравномерного снабжения
кислородом различных участков железной
пластины.
Зачищенную
наждачной бумагой железную пластину
поместить в пробирку с 3 %-м
раствором NaCl,
так чтобы часть пластины оказалась
непогруженной в раствор. Добавить в
раствор по 2 капли K3[Fe(CN)6]
и фенолфталеина. Наблюдать окрашивание
в синий цвет раствора вокруг участка
пластины, который находится в растворе,
и окрашивание в розовый цвет того
участка, который соприкасается с
воздухом. Объяснить и написать процессы,
происходящие на электродах короткозамкнутых
гальванических элементов, образовавшихся
вследствие неравномерного снабжения
кислородом различных участков железной
пластины.
Анодный процесс – окисление железа (происходит на погруженной в раствор части пластины):
(подтверждается качественной реакцией на ионы – посинением раствора)
Качественная реакция:
Катодный процесс – кислородная деполяризация в аэрированной среде (происходит на участке пластины, соприкасающимся с воздухом):
 (подтверждается
качественной реакцией на ионы
- порозовением раствора)
(подтверждается
качественной реакцией на ионы
- порозовением раствора)
Происходит это всё из-за неравномерного доступа кислорода к пластине. Часть пластины, соприкасающаяся с воздухом, имеет больший доступ к кислороду, чем погруженная часть, поэтому на металле возникает гальваническая пара и запускается процесс коррозии.
4) Действие стимулятора коррозии:
 Взять
две пробирки, в одну налить раствор
СuSO4,
в другую
CuCl2.
В каждую из пробирок опустить по кусочку
алюминия. Алюминий покрыт защитной
пленкой Al2O3.
При разрушении этой пленки возможно
вытеснение меди из раствора ее соли
более активным металлом (алюминием).
Вытеснение меди в первой пробирке идет
очень медленно, во второй
быстро. Объяснить различие и написать
уравнения процессов, идущих на пластинах.
Взять
две пробирки, в одну налить раствор
СuSO4,
в другую
CuCl2.
В каждую из пробирок опустить по кусочку
алюминия. Алюминий покрыт защитной
пленкой Al2O3.
При разрушении этой пленки возможно
вытеснение меди из раствора ее соли
более активным металлом (алюминием).
Вытеснение меди в первой пробирке идет
очень медленно, во второй
быстро. Объяснить различие и написать
уравнения процессов, идущих на пластинах.
Хлор – анодный ускоритель коррозии. В первом случае ионы хлора легко адсорбируются поверхностью электрода, имеющего окисную плёнку. Это ведёт к вытеснению ионов кислорода и замещению их в окисной плёнке ионами хлора. После такой замены в местах адсорбции хлор-иона получается растворимое хлористое соединение металла, что ведёт к образованию пор на этих участках защитной плёнки:
Вытеснение меди:



Исходя из математики, коэффициенты можно сократить…
Сульфат-ионы не являются стимуляторами коррозии. Алюминий стоек к соединениям серы, поэтому реакция с сульфат-ионом идёт очень медленно.
Вытеснение меди:


Далее: реакционной частицей в электрохимических процессах является электрон!!!!
Хлорид-ионы вступать в реакцию с оксидной плёнкой алюминия не будут. Вот представьте: Вы налили в алюминиевую кастрюлю воды, посолили её…Кастрюля же не растворяется)
Хлорид-ион будучи кислотным остатком бескислородной кислоты может принимать участие в электрохимических процессах в растворах (точнее в анодном процессе, будет окисляться; из двух анионов получится одна молекула хлора), а сульфат-ион нет.
5) Опыт 14.6. Защитное действие оксидной плёнки:
 Зачистить
поверхность пластины из алюминия
наждачной бумагой и протереть
фильтровальной бумагой. На середину
пластины поместить несколько капель
соли ртути, соблюдая при этом осторожность,
так как соли ртути ЯДОВИТЫ! Ртуть,
растворяя металлы, образует жидкие
сплавы, в которых металл сохраняет свои
свойства. Через некоторое время осторожно
осушить пластину фильтровальной бумагой.
Проследить за образованием на поверхности
пластины рыхлого слоя гидроксида
алюминия. Поверхность пластины протереть
фильтровальной бумагой и погрузить в
стакан c
водой. Наблюдать выделение газа. Написать
процессы, идущие на алюминиевой пластине.
Зачистить
поверхность пластины из алюминия
наждачной бумагой и протереть
фильтровальной бумагой. На середину
пластины поместить несколько капель
соли ртути, соблюдая при этом осторожность,
так как соли ртути ЯДОВИТЫ! Ртуть,
растворяя металлы, образует жидкие
сплавы, в которых металл сохраняет свои
свойства. Через некоторое время осторожно
осушить пластину фильтровальной бумагой.
Проследить за образованием на поверхности
пластины рыхлого слоя гидроксида
алюминия. Поверхность пластины протереть
фильтровальной бумагой и погрузить в
стакан c
водой. Наблюдать выделение газа. Написать
процессы, идущие на алюминиевой пластине.
1) Образование амальгамы

2) Взаимодействие алюминия с водой:



Коэффициенты можно сократить (в электродных процессах пишется элементарный акт полуреакции). И надо указать, какой процесс будет анодным, а какой катодным…
Реакция протекает только в месте образования амальгамы алюминия потому, что в этом месте с помощью ртути растворилась защитная оксидная плёнка алюминия, которая защищает его от воздействия воды на остальной поверхности металла.
6) Опыт 14.8. Анодное и катодное покрытия:
 Два
стакана заполнить 3 %-м раствором NaCl,
добавив в каждый по несколько капель
K3[Fe(CN)6].
Взять пластины оцинкованного и луженого
железа, на их поверхности нанести
царапины и раздельно поместить в стаканы.
Наблюдать, какая пластина раньше
подвергается коррозии. Дать объяснение.
Написать уравнения электродных процессов,
идущих при коррозии каждого образца.
Два
стакана заполнить 3 %-м раствором NaCl,
добавив в каждый по несколько капель
K3[Fe(CN)6].
Взять пластины оцинкованного и луженого
железа, на их поверхности нанести
царапины и раздельно поместить в стаканы.
Наблюдать, какая пластина раньше
подвергается коррозии. Дать объяснение.
Написать уравнения электродных процессов,
идущих при коррозии каждого образца.
1) Когда железо покрывают цинком, создается анодное защитное покрытие, так как цинк более активный металл, чем железо. Если его повредить, то разрушаться будет, в первую очередь, цинк, а потом уже железо.

Уравнения процессов, происходящих на поверхности металла:


2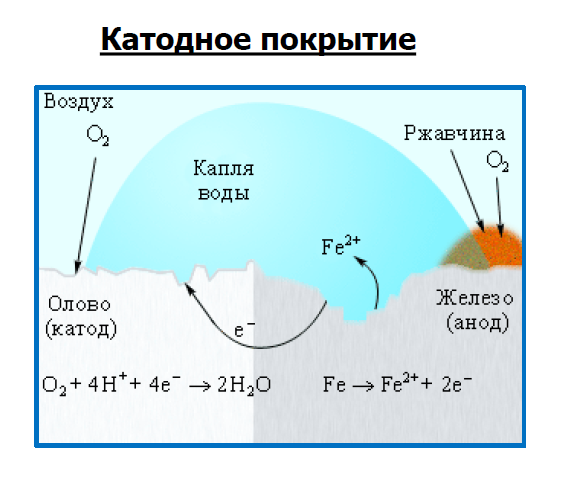 )
Когда железо покрывают оловом (лудят),
создаётся катодное защитное покрытие,
так как олово менее активный металл,
чем железо. Если его повредить, железо
будет разрушаться и ржаветь, так как
оно будет анодом.
)
Когда железо покрывают оловом (лудят),
создаётся катодное защитное покрытие,
так как олово менее активный металл,
чем железо. Если его повредить, железо
будет разрушаться и ржаветь, так как
оно будет анодом.
Процессы, происходящие в металлах:


7) Опыт 14.9. Протекторная защита.
Два стакана заполнить 0.2 н. раствором уксусной кислоты (СН3СООН), добавив в каждый по несколько капель раствора KI. В один стакан поместить плотно соединенные между собой пластины свинца и цинка, в другой только пластину свинца. Наблюдать, в каком стакане раньше появится желтая окраска PbI2. Дать объяснения. Написать электродные процессы, идущие при коррозии каждого образца.

Для свинцовой пластины:

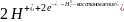

Выпал
жёлтый осадок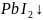
Для пары пластин:
Уравнения процессов, происходящих на поверхности металла (кислая деаэрированная среда):

Реакции проходят те же, что и в отсутствие свинца, только интенсивность их намного меньше, так как свинец защищён цинком:
Протекторная защита металла — способ антикоррозионной защиты, при котором защищаемой поверхности необходимо обеспечить контакт с более активным металлом. Разрушаться должен защитный металл, вместо защищаемого.
Денис, вот опять та же история с параллельными и последовательными реакциями…никакого ацетата свинца образовываться не будет: уже есть смесь реагентов, в которую помещается пластина. Протекает конкурирующая реакция (реактивы пишу в порядке добавления):
2СH3COOH + 2KI + Pb → PbI2 + 2CH3COOK + H2↑
Вывод:
На основе теоретического и экспериментального изучение процессов химической и электрохимической коррозии, методов зашиты металлов сформировали умение определять условия коррозионной совместимости деталей из различных материалов, выбирать оптимальные методы защиты, как на стадии проектирования, так и для процессов, связанных с изготовлением детали.
