
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра Физической химии
отчет
по лабораторной работе №4
по дисциплине «Химия»
Тема: «Коррозия металлов»
Студент гр. 9492 |
|
Скотаренко Д.Д. |
Преподаватель |
|
Рахимова О.В. |
Санкт-Петербург
2020
Цель работы.
Изучение влияния некоторых факторов на протекание электрохимической коррозии и методов защиты металлов от коррозии
Основные теоретические положения.
Коррозия – процесс самопроизвольного разрушения металлов или металлических сплавов вследствие их химического или электрохимического
взаимодействия с агрессивной окружающей средой.
При химической коррозии металлы разрушаются вследствие протекания гетерогенных химических реакций: это или взаимодействие с агрессивными газами при высоких температурах, исключающих конденсацию влаги
на поверхности металла, или растворение металла в органических средах, не
проводящих ток. Электрохимическая коррозия протекает в проводящих ток
средах.
При контакте разнородных материалов в агрессивной среде возникает
коррозионный короткозамкнутый гальванический элемент: на металле с более отрицательным электродным потенциалом протекает процесс окисления
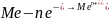 ,
а на менее активном металле имеют место
процессы:
,
а на менее активном металле имеют место
процессы:
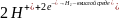
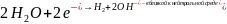
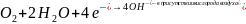
Основными методами защиты от коррозии являются:
1. Нанесение защитных покрытий. Они подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки металла.
2. Электрохимическая защита – катодная и протекторная.
3. Обработка коррозионной среды – за счет деаэрации (удаление из
среды растворенных газов) или добавления ингибиторов (веществ, замедляющих коррозию).
Металлические покрытия подразделяются на катодные, электродный
потенциал материала которых положительнее потенциала защищаемого металла, и анодные, с более отрицательным, чем у основного металла, электродным потенциалом.
Ингибиторы коррозии, адсорбируясь на поверхности металла, либо
тормозят электродные процессы коррозионных элементов, либо образуют на
поверхности металла плотную защитную оксидную пленку.
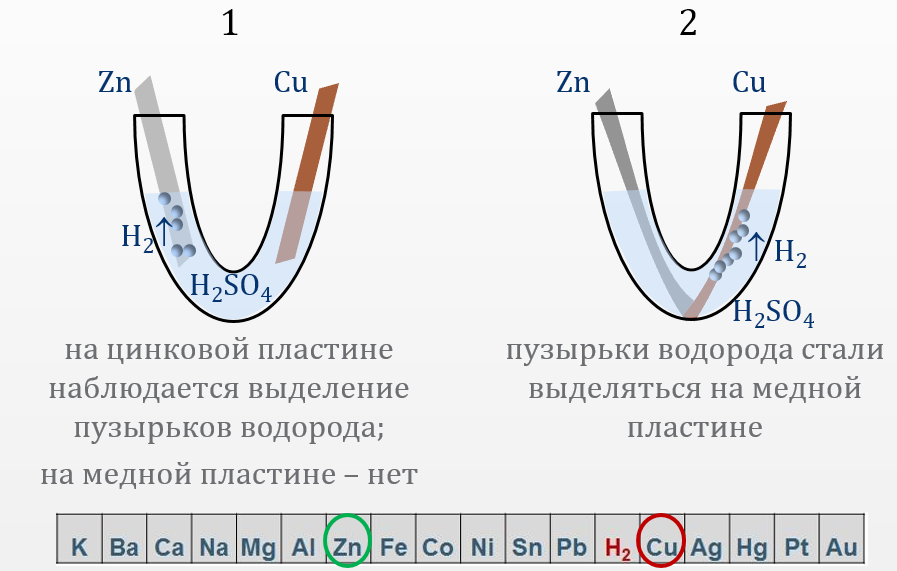
1) Опыт 14.2. Коррозия двух контактирующих металлов
В V-образную стеклянную трубку, заполненную 0.1 н. раствором Н2SO4, опустить две пластинки (цинковую и медную), не допуская их взаимного касания. Наблюдать выделение водорода на цинке и отсутствие этого процесса на меди.
 Привести
металлы в соприкосновение. Отметить
изменение в процессе выделения водорода
и дать объяснение. Написать уравнения
процессов коррозии, идущих на электродах
образовавшейся гальванической
коррозионной пары металлов.
Привести
металлы в соприкосновение. Отметить
изменение в процессе выделения водорода
и дать объяснение. Написать уравнения
процессов коррозии, идущих на электродах
образовавшейся гальванической
коррозионной пары металлов.
В начале водород выделялся на цинке, так как цинк активнее водорода, а на меди не выделялся, так как медь менее активна, чем водород.
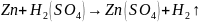
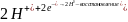
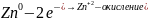
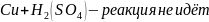
Далее, при соприкосновении металлов, началась коррозия – перетекание электронов из более активного металла к менее активному (от анода – цинка к катоду - меди), из-за этого происходит восстановление водорода на меди этими избыточными электронами.
Уравнения электрохимической коррозии (кислая деаэрированная среда):
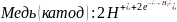
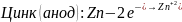
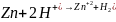
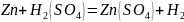
2) Опыт 14.3. Влияние механических напряжений в металле на его коррозию.
Поверхность стальной проволоки очистить наждачной бумагой, обезжирить ацетоном, промыть водой и досуха протереть фильтровальной бумагой. Проволоку согнуть так, чтобы на отдельных ее участках была различная степень деформации. Поместить проволоку в плоскую чашку и залить 3 %-м раствором NaCl, добавив 3 капли K3[Fe(CN)6] и 2 капли фенолфталеина.
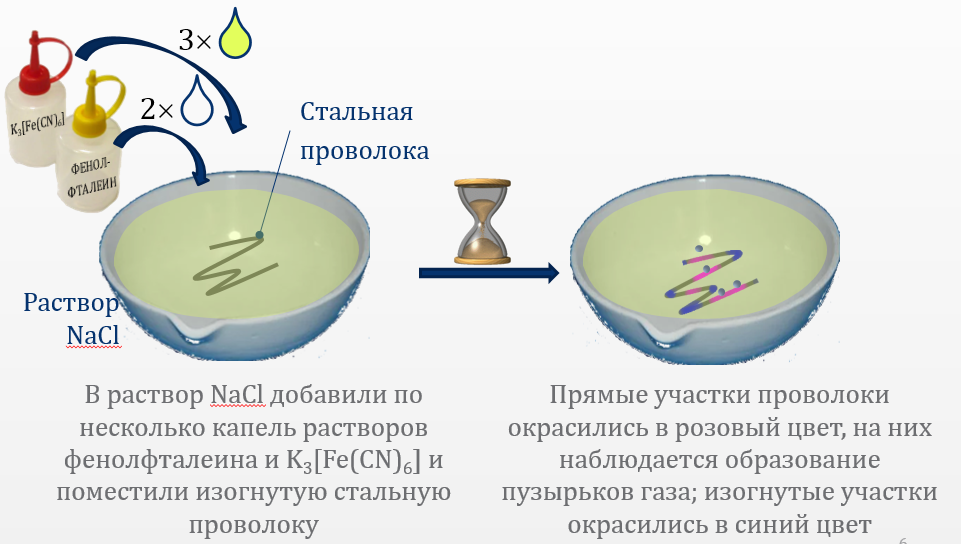 Гексацианоферрат
(III)
калия (K3[Fe(CN)6])
в присутствии ионов Fe2+
окрашивает раствор в синий цвет,
фенолфталеин в щелочной среде дает
малиновую окраску.
Гексацианоферрат
(III)
калия (K3[Fe(CN)6])
в присутствии ионов Fe2+
окрашивает раствор в синий цвет,
фенолфталеин в щелочной среде дает
малиновую окраску.
Анодный процесс – окисление железа (происходит на изогнутых участках проволоки):
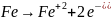 (подтверждается
качественной реакцией на ионы
(подтверждается
качественной реакцией на ионы
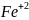 – посинением раствора)
– посинением раствора)
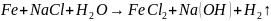
Качественная реакция:
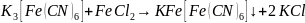
Катодный процесс – кислородная деполяризация в деаэрированной среде (происходит на прямых участках проволоки):
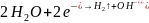 (подтверждается
качественной реакцией на ионы
(подтверждается
качественной реакцией на ионы
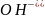 - порозовением раствора)
- порозовением раствора)
Процесс окисления активнее протекает на деформированных участках проволоки потому, что при деформации разрушается прежняя структура металла, разрушается оксидная плёнка, что даёт раствору свободно проникнуть непосредственно к металлу. Для опытов 14.3 и 14.4 необходимо добавить реакцию образования комплекса KFe[Fe(CN)6]
