
- •3. Схемы опытов
- •4. Области использования учения о генетике и изменчивости микроорганизмов
- •2) производство антибиотиков (получение штаммов бактерий и грибов с высокой продукцией антибиотиков);
- •3) производство биологически активных веществ (гормонов, например, инсулина, витаминов группы В,С, цитокинов и др.);
- •4) получение химических веществ: ацетона, спиртов, органических кислот, ингибиторов ферментов и др.
- •2) диагностика неинфекционных заболеваний (наследственных, онкологических, различных видов иммунопатологии и др.);
- •III. Генная терапия - лечение соматических заболеваний путем переноса в дефектные клетки организма человека необходимых генов; для переноса используют векторы на основе вирусов.
- •Полимеразная цепная реакция (ПЦР)
- •Таблица 17
- •Группы химических веществ с бактерицидным/статическим действием на микроорганизмы
- •Типы дезинфекции в эпидемиологическом очаге представлены в табл.18
- •Стерилизация – полное освобождение объектов внешней среды от любых микроорганизмов и их спор (рис.7)
- •Химическая стерилизация
- •используется ограниченно, поскольку существует ряд нежелательных эффектов при использовании данного вида обработки:
- •Химическая стерилизация
раствор Люголя,
70% спирт этиловый,
1-2% спиртовый раствор бриллиантового зеленого,
3% перекись водорода,
0,05-1,0% хлоргексидин,
раствор фурацилина,
0,1—0,5% водные растворы перманганата калия,
2,4% первомура и др.
Стерилизация – полное освобождение объектов внешней среды от любых микроорганизмов и их спор (рис.7)
Цель стерилизации – разрыв путей передачи возбудителей инфекционных заболеваний от источника инфекции к восприимчивым людям.
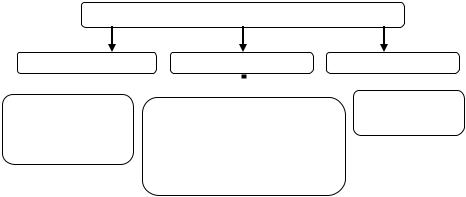
МЕТОДЫ СТЕРИЛИЗАЦИИ
|
Физические |
Механичесие |
Химические |
||
1) |
термические |
1) фильтрация через |
1) |
газовые |
|
2) |
жидкостные |
||||
2) |
лучевые |
||||
Бактериальные фильтры |
|||||
|
|
||||
|
|
|
|
||
3)ультразвуковые (мембранные, асбестовые)
2)фильтрация через бактериальные свечи
Рис. 7. Основные методы стерилизации
Наиболее надежной и контролируемой является термическая стерилизация
(табл.19).
Таблица 19
Термическая стерилизация
Вид термической |
Режим |
Стерилизуемые |
стерилизации |
|
объекты |
|
1110С-0,5 |
Питательные среды, |
|
атм.(кгс/см2) |
содержащие углеводы |
|
20-30 мин. |
|
|
1210-1270С – 1,0- |
Основные питательные |
1. паровой |
1,5 атм.(кгс/см2) |
среды, перевязочные |
(водяным |
20-45 мин. |
материалы, изделия из |
насыщенным паром |
|
резины и латекса. |
под избыточным |
1330С – 2 атм. |
Изделия из коррозионно- |
давлением – |
(кгс/см2) |
стойкого металла, стекла, |
автоклавирование) |
20 мин. |
из текстильных |
|
|
материалов, резины. |
|
|
Патогенный материал, в |
|
|
т.ч. материал, зараженный |
|
|
спороносной |
|
|
микрофлорой |
2. суховоздушная |
1600С – 160 мин. |
Изделия из металла, |
стерилизация (в |
1800С – 40 мин. |
стекла, силиконовой |
печах Пастера, или |
|
резины. |
сухожаровых |
|
|
шкафах) |
|
|
3.дробная |
|
|
|
стерилизация |
|
|
|
текучим паром |
1000С – 40-60 мин. |
Питательные среды, |
|
|
дробно 3 дня |
содержащие углеводы, |
|
тиндализация |
подряд |
молоко, желатин и др. |
|
56-580С – 60 мин. |
Сыворотки, витамины, |
||
|
|||
|
дробно 5-6 дней |
некоторые лекарственные |
|
|
подряд |
вещества |
|
4. прокаливание в |
|
Бактериологические |
|
пламени |
|
петли, иглы, пинцеты |
Химическая стерилизация
используется ограниченно, поскольку существует ряд нежелательных эффектов при использовании данного вида обработки:
1)необходимость отмывания простерилизованного объекта от остатков стерилизанта (возможна повторная контаминация объекта);
2)длительность;
3)возможность побочного действия химического вещества на человека.
Химическая стерилизация используется в случаях, когда по каким-либо причинам невозможно использовать другие способы (обработка крупногабаритных приборов, приборов с дорогостоящими деталями, требующими «щадящих» режимов, например, эндоскопов и т. д.).
Основные способы и режимы химической стерилизации представлены в табл. 20 Таблица 20
Химическая стерилизация
|
Газовая |
|
Погружная |
|
|
||
|
(предметы помещают в |
(предметы погружают в раствор) |
|
|
герметические контейнеры) |
|
|
|
1. пары формальдегида 1 |
1. |
формалинэтил-алкоголь,24 ч. |
|
г/мл, влажность 80-90%, t0 > |
2. |
формалин-изопропанол,24 ч. |
|
20 0С, 24 ч. |
3. |
раствор первомура |
|
2. окись этилена с |
4. |
раствор анолита |
|
добавлением СО2, 500-200 |
|
|
|
мг/мл, влажность 60-90%, t0 > |
|
|
|
20 0С, 6-24 ч. |
|
|
Для оценки эффективности стерилизации контролируют критические параметры (табл.21)
Таблица 21
Критические параметры, контролируемые для оценки эффективности стерилизации
|
Вид стерилизации |
Контролируемые критические параметры |
1) |
суховоздушная |
Время экспозиции, температура |
2) |
паровая |
Время экспозиции, температура, |
|
|
насыщенный пар |
3) |
химическая (этилен |
Время экспозиции, температура, |
оксидная) |
концентрация газа, относительная |
|
|
|
влажность |
Для контроля качества термической и химической стерилизации используют различные индикаторы (табл.22)
Таблица 22 Классификация индикаторов контроля качества стерилизации по принципу работы
Группа |
|
Принцип работы |
|
Преимущества метода |
|||||
индикаторов |
|
|
|
|
|
|
|
|
|
1) биологические |
Содержат |
|
тестовые |
Является |
«золотым |
||||
индикаторы (БИ) |
микробные споры (B.subtilis |
стандартом», |
|
т.к. |
|||||
|
или |
B.stearothermophilus), |
только БИ определяют |
||||||
|
которые после стерилизации |
реальный факт гибели |
|||||||
|
инкубируют в |
питательной |
спор |
бактерий |
внутри |
||||
|
среде 24-48 час. |
|
стерилизатора |
|
|||||
2) химические |
Используют |
реакции |
-дает ответ сразу после |
||||||
индикаторы |
химических |
веществ |
на |
завершения |
|
работы |
|||
|
воздействие |
факторов |
стерилизатора |
|
|||||
|
стерилизации |
(изменение |
-не |
требует |
|
наличия |
|||
|
цвета |
или |
оплавление |
при |
бак.лаборатории |
||||
|
достижении |
критического |
-прост |
|
в |
||||
|
значения |
не |
менее |
двух |
интерпритации |
||||
|
стерилизационных |
|
|
|
|
|
|||
|
параметров). |
|
|
|
|
|
|
||
Классификация индикаторов контроля качества стерилизации по способу применения:
наружные (размещаемые на поверхности упаковки стерилизуемого объекта);
внутренние (размещаемые внутри упаковки).
2.Классификации антибиотиков и принципы рациональной антибактериальной терапии.
Термин химиотерапия, впервые предложенный П.Эрлихом, подразумевает использование лекарственных средств для уничтожения возбудителей инфекций в организме человека и животных без вреда для последних.
Классификация химиотерапевтических средств
В настоящее время средства, применяемые для химиотерапии, по происхождению принято делить на:
1)антибиотики;
2)синтетические антибактериальные средства разных химических групп.
Антибиотики - лекарственные средства биологического происхождения, способные избирательно подавлять возбудителей заболеваний в организме хозяина. К группе антибиотиков также относят их производные и синтезированные аналоги.
Существует несколько принципов классификации антибиотиков (табл. 23, 24, 25).
Таблица 23
Классификация антибиотиков по происхождению
№ |
Продуценты |
Примеры антибиотиков |
п/п |
|
|
1. |
Грибы родов: |
Группа пенициллинов: |
|
|
|
- Penicillum |
-бензилпенициллин (природный) |
||
|
|
- метициллин, оксациллин, |
|
|
|
|
ампициллин (полусинтетический) |
||
|
|
|
|
|
|
- Cephalosporium |
Группа цефалоспоринов: |
|
|
|
|
-ценорин |
|
|
|
|
-кефзол и др. |
|
|
2. |
Актиномицеты рода |
Полиеновые |
(нистатин, |
леворин, |
|
Streptomyces |
амфотерицин, пимафуцин) |
|
|
|
|
|
|
|
|
|
Группа стрептомицина |
|
|
|
|
|
|
|
|
|
Аминогликозиды |
(неомицин, |
|
|
|
мономицин, |
|
|
|
|
канамицин, гентамицин) |
|
|
|
|
Тетрациклины: тетрациклин |
|
|
|
|
|
|
|
|
|
Линкомицин |
|
|
|
|
|
|
|
|
|
Левомицетин |
|
|
|
|
|
|
|
|
|
Макролиды |
(эритромицин, |
|
|
|
азитромицин) |
|
|
|
|
Рифамицины |
|
|
|
|
|
|
|
3. |
Бактерии: |
Группа полимиксина: |
|
|
|
- Bacillus polymyxa |
-полимиксин М, В |
|
|
|
|
|
|
|
|
- Bacillus brevis |
грамицидин С |
|
|
|
|
|
|
|
4. |
Животного |
Лизоцим |
|
|
|
происхождения |
|
|
|
5. |
Растительного |
Фитонциды |
|
|
|
происхождения |
|
|
|
Таблица 24 Классификация природных антибиотиков в зависимости от химической структуры
№ |
Название группы |
Некоторые |
п/п |
|
представители |
1. |
β- лактамы: |
Бензилпенициллин, |
|
1. пенициллины |
оксациллин, |
|
2. цефалоспорины |
цефотаксим |
|
3. монобактамы |
|
|
4. карбопенемы |
|
2. |
Макролиды |
Олеандомицин, |
|
|
эритромицин |
3. |
Линкозамиды |
Линкомицин, |
|
|
клиндамицин |
4. |
Аминогликозиды |
Стрептомицин, |
|
|
амикацин, Гентамицин |
5. |
Тетрациклины |
Доксициклин |
6. |
Полимиксины |
Бацитрацин, |
|
|
полимиксин В, М |
7. |
Полиеновые антибиотики |
Нистатин, |
|
|
Амфотерицин В |
8. |
Рифампицины |
Рифампицин |
9. |
Производные |
Левомицетин |
|
диоксиаминофенилпропана |
|
10. |
Фузидин |
Грицеофульвин |
11. |
Гликопептиды |
Ванкомицин, |
|
|
тейкопланин |
12. |
Ристомицин |
Ристомицин |
Таблица 25 Классификация антибиотиков по механизму действия на микробную клетку
Механизм действия |
Примеры |
|
|
|
антибиотиков |
1.Нарушение синтеза клеточной |
бетталактамные, |
|
стенки или ее компонентов |
гликопептидные |
|
|
|
|
2.Нарушение |
морфофункциональной |
полимиксины, полиены |
организации |
цитоплазматической |
|
мембраны |
|
|
3.Ингибирование синтеза белка на |
рифампицины |
|
уровне РНК-полимеразы |
|
|
4.Ингибирование синтеза белка на |
тетрациклины, |
|
уровне рибосом |
левомицетин, |
|
|
|
макролиды |
По спектру действия антибиотики классифицируются на:
-антибактериальные,
-противогрибковые,
-антипротозойные,
-противовирусные,
-противоопухолевые.
Синтетические химиотерапевтические средства (ХТС) - это группа веществ разного химического строения и механизма действия на микроорганизмы, которые используются для антимикробной терапии (табл.26)
Таблица 26
Основные группы синтетических химиотерапевтических средств
№ |
Группа ХТС |
Примеры препаратов |
|
п/п |
|
|
|
1. |
Сульфаниламиды |
Сульфадиметоксин, фталазол, ко- |
|
|
|
тримаксозол (комбинированный с |
|
|
|
триметопримом) |
|
2. |
Производные |
Ципрофлоксацин, |
норфлоксацин, |
|
хинолонкарбоновой |
дифлоксацин |
|
|
кислоты 3-го поколения - |
|
|
|
фторхинолоны |
|
|
3. |
нитрофураны |
Фурадонин, |
фурагин, |
|
|
энтерофурил |
|
4. |
8-оксихинолоны |
Энтеросептол, нитроксолин |
|
5. |
нитроимидазолы |
метранидазол |
|
6. |
производные хиноксалина |
диоксидин |
|

3. Определение чувствительности бактерий к антибиотикам
Различают эмпирическую противомикробную терапию и противомикробную терапию при установленной чувствительности возбудителя к антибиотикам. Эмпирическое лечение начинают в соответствии с протоколами еще до выделения возбудителей инфекции из организма больного и постановки антибиотикограммы – определения их чувствительности к антибактериальным препаратам.
Эмпирическая антибиотикотерапия может иметь нежелательные последствия:
-если до лечения не взят материал для бактериологического и других видов исследования, то диагноз остается неясным и осложняется дальнейший выбор лекарственного препарата;
-если штамм бактерий, являющийся причиной инфекции, оказывается малоили нечувствительным к выбранным препаратам, то неоправданным являются расходы на лечение и возможные токсические эффекты антимикробной терапии;
-при использовании антибиотиков широкого спектра действия, как правило, происходит селекция резистентных штаммов, ведущая к клинической неэффективности лечения.
Антибиотикограмма выполняется с чистой культурой выделенных от пациента бактерий. Для обеспечения этого требования необходимо соблюдать следующие правила взятия материала на исследование:
1)материал должен быть получен до начала антибактериальной терапии или через срок, равный периоду полувыведения антибактериального препарата из организма;
2)материал для посева следует брать непосредственно из очага инфекции с соблюдением правил асептики (стерильными инструментами в стерильную посуду); если взятие материала непосредственно из очага инфекции невозможно, но он сообщается с внешней средой, можно провести исследование соответствующего отделяемого (моча, мокрота и др.);
3)материал высевают на соответствующий набор питательных сред, используемых для выделения чистых культур различных видов микроорганизмов;
4)если патологический процесс вызван микробной ассоциацией, раздельно исследуют чувствительность к антибиотикам всех членов ассоциации, выделенных в чистой культуре.
Способы определения чувствительности микроорганизмов к антибиотикам
Исследование чувствительности микроорганизмов к антибиотикам и химиотерапевтическим препаратам проводят стандартными унифицированными методами, регламентированными официальными инструкциями.
Существует несколько способов, которые можно разделить на следующие группы
(рис.8)
Способы определения чувствительности микроорганизмов к антибиотикам
Регламентрованные |
Нерегламентрованные |
|
(описанные в нормативных |
|
|
документах) |
|
|
Диффузионные |
Серийных |
АвтоматизиУскоренные |
1. диско- |
разведенй |
рованные |
диффузионный |
1. в бульоне |
(в баканализа- |
2. Е-тест |
2. в агаре |
торах) |
(эпсилон-тест) |
|
|
Рис. 8. Способы определения чувствительности микроорганизмов к антибиотикам.
1. Принцип диффузионных методов основан на диффузии в агар антибиотиков, нанесенных на бумажные диски или полоски, при наложении их на засеянную культуру микроорганизмов. Диффузия антибиотика приводит к образованию зоны подавления роста микроорганизмов вокруг дисков или полосок после инкубации чашек в термостате при температуре 35о-37оС в течение суток, если исследуемый штамм проявляет чувствительность к препаратам.
При использовании диско-диффузионного метода результат учитывают путем измерения диаметра зоны вокруг диска в миллиметрах, сравнивая с данными таблиц из методических указаний (МУК «Определение чувствительности микроорганизмов к антибактериальным препаратам»). На основании размеров зон культуры относят к одной из трех групп: чувствительные, промежуточные и резистентные.
Диско-диффузионный метод относится к полуколичественным. Он прост в исполнении, экономичен, не требует специального оборудования, доступен для любой бактериологической лаборатории, поэтому именно он является основным способом тестирования чувствительности микроорганизмов и используется в рутинной практике.
При исполнении метода Е-тестов используют не диски, а полоски, на определенные участки которых антибиотик нанесен в различных концентрациях - по градиенту концентраций от максимальной к минимальной. В результате формирующиеся зоны задержки роста культуры приобретают эллипсовидную форму. В месте пересечения эллипсовидной зоны с полоской Е-теста находится минимальная подавляющая концентрация (МПК) антибиотика.
Е-тест сочетает простоту постановки метода бумажных дисков и точность метода серийных разведений, является количественым, однако ввиду высокой стоимости тестполосок не нашел широкого применения в практике.
2. Методы серийных разведений основаны на приготовлении последовательных двукратных разведений антибиотика (АБ) от максимальной рабочей концентрации к минимальной. Разведения можно выполнять в жидкой среде (в пробирках или лунках полистироловых планшет) или агаре. В результате в каждой последующей пробирке (или лунке) ряда концентрация АБ уменьшается в 2 раза по сравнению с предыдущей. Далее взвесь, приготовленную из чистой культуры исследуемых микроорганизмов, вносят во все разведения АБ в бульоне или на поверхность агара в чашках. Результаты учитывают после термостатирования в течение суток при 35о-37оС по наличию/отсутствию роста микроорганизмов в средах. Находят последнюю пробирку ряда (лунку, чашку) среди тех, где еще отсутствуют признаки роста микроорганизмов - она соответствует наименьшей концентрации антибиотика, полностью подавляющей видимый рост штамма. Такая концентрация называется минимальной подавляющей концентрацией (МПК), или минимальной ингибирующей концентрацией (МИК); измеряется в мг/л.
Данные методы являются точными, количественными, однако они очень трудоемки. Это не позволяет их использовать в повседневной практике.
3. Атоматизированные методы определения чувствительности микроорганизмов к АБ предусматривают учет результатов с помощью приборов типа бактериологических анализаторов. Для тестирования используют методы серийных разведений или пограничных концентраций, проводимые в коммерческих полистироловых 96-луночных планшетах. В лунках планшет находятся лиофильно высушены убывающие концентрации антибиотиков в бульоне или только в две концентрации - высокая и низкая (высокая соответствует границе между устойчивыми и умеренно устойчивыми штаммами, а низкая концентрация — границе между умеренно устойчивыми и чувствительными штаммами). Далее в лунки вносят суспензии исследуемых штаммов в одинаковой дозе с соблюдением

правил асептики и инкубируют при 37оС от 4-6 часов (в экспресс-режиме) до 24ч. Результаты регистрируют спектрофотометрически или кондуктометрически сразу после появлении признаков размножения нечувствительных к данному антибиотику штаммов. Процессы инкубирования, встряхивания, определения оптической плотности взвеси в каждой лунке, графическое отображение результатов, определение степени чувствительности и печать протокола исследования выполняются с помощью приборов. Одновременно возможно тестирование культуры к 20 и более антибиотикам.
Данный метод является наиболее точным, стандартным и нетрудоемким, однако имеет высокую стоимость и потому доступен только крупным диагностическим центрам.
4. Ускоренные методы определения чувствительности микроорганизмов к АБ позволяют сократить время исследования до нескольких часов, однако являются ориентировочными и требуют подтверждения в стандартных тестах. К этой группе можно отнести:
методы регистрации ферментативной активности микроорганизмов при росте нечувствительных штаммов на дифференциальных средах в присутствии антибиотиков;
методы, основанные на изменении цвета редокс-индикаторов при изменении окислительно-восстановительного потенциала среды в процессе роста микробов в присутствии антибиотиков.
Методики проведения лабораторных работ
Определение чувствительности микроорганизмов к антибиотикам методом серийных разведений
Цель исследования - определение минимальной, или подавляющей, концентрации антибиотика, ингибирующей видимый рост исследуемой культуры бактерий (МИК, или МПК).
1 этап. Готовят основной раствор, содержащий определенную концентрацию антибиотика (мг/л) в специальном растворителе или буферном растворе. Из него делают последовательные двукратные разведения антибиотика в 7-8 пробирках в соответствии со схемой 3. Далее ко всем разведениям добавляют по 0,1 мл исследуемой бактериальной суспензии с концентрацией бактерий, соответствующей стандарту мутности 0,5 по MсFarland (108м.т./ мл). В предпоследнюю пробирку ряда вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры), а в последнюю - 1 мл бульона и 1 мл антибиотика (контроль АБ). Посевы инкубируют при 370С 24 часа.
Схема 3 Определение чувствительности бактериальной культуры к антибиотику методом серийных
разведений
№ пробирок
Разведение
антибиотика
Ингредиенты
МПБ (мл)
Бензиллпеницил лин (100 мг/л)
взвесь S.aureus
(мл)
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
50 |
25 |
12,5 |
6,25 |
3,12 |
1,56 |
0,78 |
0,39 |
КК |
КАБ |
0,1 |
0,1 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
0,1 |
1,0 |
1,0 |
0,1 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
0,1 |
– |
1,0 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
– |
|
|
|
|
|
|
|
|
|
|
1,0 в дез.раствор
2 этап. Учитывают результаты опыта по помутнению питательной среды. Последняя опытная пробирка с прозрачной питательной средой указывает на задержку роста исследуемого штамма S.aureus под влиянием антибиотика в минимальной ингибирующей концентрации (МИК, МПК).
Пример учета:
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
"+" (диффузно-мутящий |
|
|
|
|
|
|
|
|
|
|
|
рост) |
– |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
"–" (прозрачная среда - |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
отсутствие роста) |
|
|
|
|
|
|
|
|
|
|
В данном примере МИК бензилпенициллина для S.aureus – 6,25 мкг/мл. Оценку результатов проводят, используя таблицу из МУК «Определение чувствительности микроорганизмов к антибактериальным препаратам» 4.2.1890-04. В таблице представлены значения МИК антибиотиков для устойчивых и чувствительных штаммов (табл.27). Делают заключение о степени чувствительности исследуемого штамма S.aureus к бензилпенициллину.
Определение чувствительности микроорганизмов к антибиотикам дискодиффузионным методом
1этап. 1 мл суспензии (108м.т./ мл) исследуемой бактериальной культуры распределяют «сплошным газоном» на пластинке агара Мюллера-Хинтона. Засеянную поверхность подсушивают и на нее с помощью стерильного пинцета накладывают бумажные диски,
содержащие определенную дозу разных антибиотиков на одинаковом расстоянии друг от друга и от края чашки (2см). Посев инкубируют при 370С 24 часа.
2этап. Учет результатов производят путем измерения диаметров (в мм) зон задержки роста микробов вокруг дисков с антибиотиками. Оценку результатов проводят по таблице из МУК (табл.27), в которой представлены пограничные значения диаметров для устойчивых, промежуточных и чувствительных штаммов.
Кчувствительным относятся штаммы микроорганизмов, рост которых подавляется при использовании обычных терапевтических доз антибиотика, они не имеют механизмов резистентности; для подавления роста культур с промежуточной чувствительностью требуются введение максимально разрешенных концентраций. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Таблица 27
Критерии интерпритации результатов определения чувствительности Staphilococcus spp.: пограничные значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
Антибактериальн |
|
Соде |
|
Диаметр зон подавления |
|
|
|
МПК |
|
|
|||||
ые |
|
ржа- |
|
|
|
роста |
|
|
|
|
(мг/л) |
|
|
||
препараты |
|
ние в |
|
|
|
(мм) |
|
|
|
|
|
|
|
|
|
|
|
диске |
|
Р |
|
П |
|
Ч |
Р |
|
П |
Ч |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
|
3 |
|
4 |
|
5 |
6 |
|
|
|
7 |
8 |
|
|
|
|
|
Бета-лактамы1 |
|
|
|
|
|
|
|
|
|||
Бензилпеницилл |
10 |
|
≤28 |
|
- |
|
≥9 |
≥0,25 |
|
- |
≤0,12 |
|
|||
ин |
|
ЕД |
|
|
|
|
|
|
|
|
|
|
|
|
|
Оксациллин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.aureus |
1 |
|
≤10 |
|
11-12 |
|
≥13 |
≥4 |
|
- |
≤2 |
|
|||
Коагулазонегати |
1 |
|
≤17 |
|
- |
|
≥18 |
≥0,5 |
|
- |
≤0,25 |
|
|||
вные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стафилококки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аминогликозиды |
|
|
|
|
|
|
|
|
|||
Канамицин |
30 |
|
≤13 |
|
14-17 |
|
≥18 |
≥84 |
|
32 |
≤16 |
|
|||
Гентамицин |
10 |
|
≤12 |
|
13-14 |
|
≥15 |
≥16 |
|
8 |
≤4 |
|
|||
Тобрамицин |
10 |
|
≤12 |
|
13-14 |
|
≥15 |
≥16 |
|
8 |
≤4 |
|
|||
Нетилмицин |
30 |
|
≤12 |
|
13-14 |
|
≥15 |
≥32 |
|
16 |
≤8 |
|
|||
Амикацин |
30 |
|
≤14 |
|
15-16 |
|
≥17 |
≥64 |
|
32 |
≤16 |
|
|||
|
|
|
|
|
Хинолоны |
|
|
|
|
|
|
|
|
||
Норфлоксацин |
10 |
|
≤12 |
|
13-16 |
|
≥17 |
≥16 |
|
8 |
≤4 |
|
|||
Эноксацин |
10 |
|
≤14 |
|
15-17 |
|
≥18 |
≥8 |
|
4 |
≤2 |
|
|||
Пефлоксацин |
5 |
|
≤15 |
|
16-21 |
|
≥22 |
≥8 |
|
4 |
≤1 |
|
|||
Офлоксацин |
5 |
|
≤12 |
|
13-15 |
|
≥16 |
≥8 |
|
4 |
≤2 |
|
|||
Ципрофлоксацин |
5 |
|
≤15 |
|
16-20 |
|
≥21 |
≥4 |
|
2 |
≤1 |
|
|||
Ломефлоксацин |
10 |
|
≤18 |
|
19-21 |
|
≥22 |
≥8 |
|
4 |
≤2 |
|
|||
Левофлоксацин |
5 |
|
≤13 |
|
14-16 |
|
≥17 |
≥8 |
|
4 |
≤2 |
|
|||
Сапрофлоксацин |
5 |
|
≤15 |
|
16-18 |
|
≥19 |
≥2 |
|
1 |
≤0,5 |
|
|||
Гатифлоксацин |
5 |
|
≤14 |
|
15-17 |
|
≥18 |
≥8 |
|
4 |
≤2 |
|
|||
|
|
|
|
Тетрациклины |
|
|
|
|
|
|
|
|
|||
Тетрациклин |
30 |
|
≤14 |
|
15-18 |
|
≥19 |
≥16 |
|
8 |
≤4 |
|
|||
Доксициклин |
30 |
|
≤12 |
|
13-15 |
|
≥19 |
≥16 |
|
8 |
≤4 |
|
|||
Миноциклин |
30 |
|
≤14 |
|
15-18 |
|
≥19 |
≥16 |
|
8 |
≤4 |
|
|||
|
|
|
|
Макролиды |
|
|
|
|
|
|
|
|
|||
Эритромицин |
15 |
|
≤13 |
|
14-22 |
|
≥23 |
≥8 |
|
1-4 |
≤0,5 |
|
|||
Кларитромицин |
15 |
|
≤13 |
|
14-17 |
|
≥18 |
≥8 |
|
4 |
≤2 |
|
|||
Азитромицин |
15 |
|
≤13 |
|
14-17 |
|
≥18 |
≥8 |
|
4 |
≤2 |
|
|||
|
|
|
|
Линкозамиды |
|
|
|
|
|
|
|
|
|||
Линкомицин |
15 |
|
<17 |
|
17-20 |
|
≥21 |
>8 |
|
|
4-8 |
≤2 |
|
||
Клиндамицин |
2 |
|
≤14 |
|
15-20 |
|
≥21 |
≥4 |
|
1-2 |
≤0,5 |
|
|||
|
|
|
|
Гликопептиды |
|
|
|
|
|
|
|
|
|||
Ванкомицин |
30 |
|
- |
|
- |
|
≥15 |
≥32 |
|
|
8-16 |
≤4 |
|
||
|
|
|
|
Другие препараты |
|
|
|
|
|
|
|
|
|||
Хлорамфеникол |
30 |
|
≤12 |
|
13-17 |
|
≥18 |
≥32 |
|
16 |
≤8 |
|
|||
Ко-тримоксазол |
1,25/ |
|
≤10 |
|
11-15 |
|
≥16 |
≥4/76 |
|
- |
≤2/38 |
|
|||
|
23,75 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нитрофурантоин |
300 |
|
≤14 |
|
15-16 |
|
≥17 |
≥128 |
|
64 |
≤32 |
|
|||
Рифампицин |
5 |
|
≤16 |
|
17-19 |
|
≥20 |
≥4 |
|
2 |
≤1 |
|
|||
Фузидин |
10 |
|
<15 |
|
15-21 |
|
≥22 |
≥32 |
|
4-6 |
≤2 |
|
|||
Линезолид |
30 |
|
- |
|
- |
|
≥21 |
- |
|
|
|
- |
≤4 |
|
|

Антибактериальн |
|
Соде |
|
Диаметр зон подавления |
|
МПК |
|
|||
ые |
|
ржа- |
|
|
роста |
|
|
(мг/л) |
|
|
препараты |
|
ние в |
|
|
(мм) |
|
|
|
|
|
|
|
диске |
|
Р |
П |
Ч |
Р |
|
П |
Ч |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
|
3 |
4 |
5 |
6 |
|
7 |
8 |
Штаммы, устойчивые к оксациллину, должны однозначно рассматриваться как устойчивые ко всем доступным беталактамам.
4. Механизмы формирования резистентности бактерий и методы определения маркеров резистентности.
Устойчивость микроорганизмов к антибиотикам и другим антибактериальным средствам - это способность микроорганизмов размножаться в присутствии различных концентраций этих препаратов.
По происхождению различают два вида устойчивости:
Первичная (видовая) – складывается в процессе эволюции видов, например, микоплазмы не чувствительны к пенициллину из-за отсутствия у них клеточной стенки;
Приобретенная - возникает в изначально чувствительной к препарату популяции в процессе ее жизнедеятельности; такая резистентность может быть результатом:
а) мутаций в хромосомных генах, контролирующих образование структурных и химических компонентов клетки, являющихся «мишенью» для препарата;
б) передачи внехромосомных факторов наследственности (R-плазмид, умеренных фагов) при рекомбинациях.
Биохимические механизмы резистентности бактерий к антибиотикам:
1) образование ферментов, разрушающих антибиотики.
Наиболее частый механизм резистентности связан с синтезом β-лактамаз. β-лактамазы — различные бактериальные ферменты, способные расщеплять или ингибировать β-лактамные антибиотики, содержащие в своей структуре циклическую амидную связь. Такие ферменты могут иметь как Грам+, так и Грамбактерий.
В практике очень важно быстро установить их наличие для определения плана лечения пациента, так как штаммы, продуцирующие β-лактамазы, будут не чувствительны к действию β-лактамных антибиотиков (всей группы или отдельных представителей);
2)утрата проницаемости клеточной стенки для определенного препарата;
3)нарушение в системе специфического транспорта данного препарата в бактериальную клетку;
4)возникновение у микроорганизмов альтернативного пути образования жизненно важного метаболита, заменяющего основной путь, блокированный препаратом.
Методы выявления маркеров резистентности бактерий к антимикробным препаратам
1)фенотипические:
определение β-лактамаз в хромогенных тестах - основаны на изменении цвета специальных субстратов и индикаторов, которые вместе с антибиотиком наносятся на диагностические диски, полоски или находятся в питательной среде; окрашивание или обесцвечивание появляется в результате гидролиза антибиотика под действием фермента β-лактамазы (например, нитроцефиновый тест);
определение у энтеробактеий β-лактамаз расширенного спектра действия методом «двойных дисков» по наличию расширенной зоны подавления роста вокруг диска с цефалоспорином 3 поколения напротив диска, содержащего клавулановую кислоту;
выявление дополнительного и модифицированного пенициллиносвязывающего белка стафилококков по резистентности к оксациллину или метициллину;
2)генетические:
Выявляют у микроорганизмов генетические детерминанты, кодирующие плазмидную или хромосомную устойчивость к определенным группам антибиотиков. Тестирование проводится в экспресс-режиме (6-8 часов), без предварительного выделения чистой культуры возбудителя, что очень важно при работе с трудноили длительно культивируемыми видами:
методы на основе ПЦР - разработаны для M.tuberculosis, стафилококков, E.coli, K.pneumoniae, вируса простого герпеса, ВИЧ;
реакция ДНК-ДНК гибридизации (применение ДНК-зондов, выявляющих у
микробов гены резистентности; ДНК-зонды |
метятся радиоактивной, |
люминесцентной или ферментной меткой). |
|
5. Побочные эффекты применения антбиотиков и принципы рациональной антибактериальной терапии.
Использование антибиотиков может привести как к возникновению нежелательных последствий со стороны организма человека, так и к изменению свойств микроорганизмов.
Со стороны организма хозяина могут возникнуть осложнения:
1)токсические реакции:
-гепатотоксическое действие (при использовании тетрациклина, эритромицина и др.);
-нефротоксическое действие (при использовании аминогликозидов);
-нарушение костного скелета и эмали зубов (при действии тетрациклинов);
-поражение органов кроветворения (при действии левомецитина, сульфаниламидов);
-нарушение синтеза витамина К (при использовании цефалоспоринов);
2)дисбиозы (при использовании антибиотиков широкого спектра действия);
3)аллергические реакции (чаще при использовании пенициллинов, цефалоспоринов);
4)иммунодепрессивное состояние:
-угнетение антителообразования (при действии левомицетина);
-подавление фагоцитоза (при действии тетрациклинов).
Изменения микроорганизмов, вызванные антибиотиками:
1)появление атипичных форм микроорганизмов (например, L- форм);
2)формирование антибиотикоустойчивости.
Общие принципы рациональной антибиотикотерапии инфекционных заболеваний I. Микробиологический принцип:
1)забор клинического материала проводят с целью выявления возбудителя заболевания до начала антибиотикотерапии (для бактериологического определения чувствительности возбудителя к антибактериальным препаратам);
2)если была начата эмпирическая химиотерапия, то при получении данных о возбудителе из бактериологической лаборатории выбор препарата может быть
пересмотрен, если возбудитель не чувствителен или мало чувствителен к используемому антибиотику.
II. Фармакологический принцип:
1)доза препарата, путь введения и интервал между ними должен быть таким, чтобы в крови и местах локализации инфекции постоянно поддерживалась концентрация, превышающая минимальную подавляющую (МПК) или минимальную бактерицидную (МБК) в 4-8 раз. При первом введении химиотерапевтических средств используют ударную дозу для более быстрого создания МПК или МБК. Несоблюдение данного принципа приводит к формированию штаммов возбудителей, резистентных к лекарственным средствам;
2)продолжительность лечения должна быть оптимальной, приводить не только к
полному клиническому выздоровлению, но и к полному выведению микробов из организма. Слишком быстрая отмена препарата способствует возникновению и формированию устойчивых штаммов микроорганизмов.
III. Клинический принцип:
1)при назначении препарата учитывают общее состояние больного, возраст, пол, наличие беременности, сопутствующие заболевания;
2)необходимо комбинировать химиотерапевтические средства с другими лекарственными препаратами, которые способствуют повышению иммунологической резистентности организма;
3)целесообразно использовать комбинации препаратов с разными механизмами действия на микроорганизмы;
4)нельзя назначать препараты, оказывающие токсическое действие, направленное на
один орган или систему.
IV. Эпидемиологический принцип:
при подборе антибиотика необходимо знать, к каким препаратам устойчивы микробы в среде, окружающей больного (в отделении, географическом регионе), насколько часто встречаются антибиотикорезистентные штаммы.
Основные правила, соблюдение которых предупреждает развитие антибиотикорезистентности у бактерий:
применять антибиотики строго по показаниям;
избегать их использование с профилактической целью;
через 7-10 дней антибиотикотерапии проводить смену препарата, учитывая, что у микробов существует перекрестная устойчивость к антибиотикам одного класса;
по возможности использовать антибиотики узкого спектра действия;
через определенное время производить смену антибиотика не только в отделении, больнице, но и в регионе;
ограниченно применять антибиотики в ветеринарии;
использовать ингибиторозащищенные антибактериальные препараты.
Тема: Облигатная и факультативная микрофлора тела человека. Дисбактериоз кишечника, принципы лабораторной диагностики. Определение чувствительности микроорганизмов к антибиотикам (продолжение).
План занятия
1.Рассмотрение основных понятий медицинской микроэкологии.
2.Характеристика нормальной микрофлоры тела человека, ее роли для организма и методов изучения.
3.Рассмотрение понятий «дисбиоз», «дисбактериоз кишечника», причин возникновения, степеней, принципов лабораторной диагностики и коррекции.
Методические указания к выполнению практического занятия.
1. Основные понятия медицинской микроэкологии
Медицинская микроэкология – это раздел, изучающий взаимоотношения между организмом человека и микроорганизмами внешней среды (экзомикроэкология), а также с аутомикрофлорой в норме и при патологии (эндомикроэкология).
Известно, что микробная биомасса во много раз превышает сумму биомасс всех остальных живых организмов, обитающих на Земле, где микроорганизмы занимают определенные экологические ниши.
Экологическая ниша - место в природе, в пределах которого данный вид может существовать неограниченно долго. Оно определяется границами выносливости вида по отношению к разным факторам, а также характером связи с другими видами и распределением в пространстве. Взаимоотношения между микроорганизмами в пределах экологической ниши называются симбиозом.
1
В зависимости от типа экологической связи бактериихемоорганотрофы подразделяют на 2 группы:
1)метатрофы, или сапрофиты - развиваются на биоорганических субстратах внешней среды, не нуждаются в организме хозяина (например, ацинетобактерии, псевдомонады, клебсиеллы, легионеллы и др.). При случайном попадании в макроорганизм они способны менять сапрофитический характер существования на паразитический и вызывать заболевания.
2)паратрофы - нуждаются в органических соединениях живого организма хозяина.
Тип экологической связи обусловливает характер отношений между микроорганизмами разных видов в биоценозе. Межвидовые взаимоотношения многообразны и динамичны. Различают три основных типа отношений: симбиоз, нейтрализм и конкуренцию (табл.28).
Симбиоз – форма сосуществования разных видов, при которой партнеры участвуют в урегулировании своих отношений с внешней средой. Симбиоз может проявляться в трех основных формах симбиотических отношений: мутуализм, комменсализм
и паразитизм.
Таблица 28 Типы взаимоотношений между паратрофами и
организмом хозяина
2
|
Типы симбиоза |
|
|
|
Примеры микроорганизмов |
||
1. Мутуализм - взаимовыгодный союз |
|
|
|
||||
|
|
Представители нормальной |
|||||
2. Комменсализм - выгодный для одного |
|
||||||
из партнеров союз, без ущерба для |
|
микрофлоры тела человека |
|||||
другого |
|
|
|
|
|
|
|
3.Паразитизм (антагонистический союз - |
|
|
|||||
микроорганизм наносит |
вред хозяину) |
|
|
||||
|
облигатный, |
при |
котором |
|
риккетсии |
||
|
микроорганизмы могут жить только |
|
хламидии |
||||
|
за счет клеток хозяина, т.к. утратили |
|
вирусы |
||||
|
собственные |
|
метаболические |
|
токсоплазмы и др. |
||
|
процессы |
|
|
|
|
|
|
|
|
при |
котором |
|
легионеллы |
||
факультативный, |
|
|
|||||
|
|
листерии |
|||||
|
микроорганизмы в |
зависимости |
от |
|
|||
|
|
псевдомонады |
|||||
|
внешних условий |
могут |
быть |
как |
|
||
|
|
клебсиеллы и др. |
|||||
|
сапрофитами, так и паразитами. |
|
|
||||
|
|
|
|
||||
2. Характеристика нормальной микрофлоры тела человека, ее роли для организма и методов изучения.
Микроорганизмы, с которыми человек контактирует и сосуществует на протяжении жизни, можно условно разделить на несколько групп:
1)микроорганизмы, более или менее часто выделяемые из организма здорового человека – нормальная микрофлора,
или микробиота;
2)транзиторная микрофлора – группа микроорганизмов, случайно попадающих в тот или иной биотоп здорового человека, не способных к длительному пребыванию в его организме хозяина;
3)возбудители инфекционных заболеваний.
Всвою очередь микробиота может быть разделена на 2 группы:
1)облигатная (резидентная) микрофлора – совокупность видов микроорганизмов, характерных для определенного биотопа здорового человека, постоянно обитающих в нем, чаще
3
всего приносящих пользу хозяину; их отсутствие обычно неблагоприятно влияет на состояние здоровья;
2) факультативная (необязательная) – группа условно-
патогенных микроорганизмов, присутствующих в малых количествах или отсутствующих в организме здорового человека; наличие их может никак не проявляться, но при снижении резистентности организма они способны вызывать заболевания;
В настоящее время форма сосуществование представителей нормальной микрофлоры рассматривается как биопленка (биологическая пленка). Биопленки – это организованные сообщества микробов, состоящие из клеточного компонента (моноили ассоциации видов) и внеклеточного матрикса, который способствует прикреплению биопленки к поверхности барьерных тканей (слизистых оболочек, и коже). Внеклеточный матрикс состоит из смеси полисахаридов, гликопептидов, нуклеиновых кислот и липидов.
Биопленка обладает рядом важных свойств, создающих благоприятные условия для выживания и размножения членов сообщества:
1) микроорганизмы образуют микроколонии;
2) микроколонии окружены защитным матриксом, пронизанным каналами, по которым циркулируют питательные вещества, продукты жизнедеятельности, ферменты, метаболиты и кислород;
3) микроорганизмы имеют определенную систему связи между собой («quorum sensing» - чувство кворума) - обмениваются генетическим материалом, «общаются между собой» посредством химических раздражений, что приводит к продукции факторов патогенности, не свойственных для каждой популяции по отдельности;
4
4) микроорганизмы в биопленке устойчивы к антибиотикам, антимикробным средствам и реакции организма хозяина.
Роль представителей нормальной микрофлоры для организма хозяина:
1)составляют конкуренцию для патогенных микробов:
формируют антиколонизационную резистентность - избирательно связывают поверхностные рецепторы клеток, особенно эпителиальных, препятствуя адгезии патогенных микроорганизмов;
проявляют выраженный антагонизм в отношении патогенных видов;
секретируют кислоты, спирты, лизоцим, бактериоцины и другие вещества, ингибирующие метаболизм и выделение токсинов патогенными видами;
2)стимулируют иммунную систему:
вызывают постоянное антигенное «раздражение» иммунной системы;
антигены представителей нормальной микрофлоры вызывают образование антител в низких титрах (Ig A секреторных, выделяющихся на поверхность слизистых оболочек и создающих местную невосприимчивость к проникающим возбудителям);
участвуют в поддержании высоких уровней лизоцима, интерферона и др.;
3)участвуют в процессах метаболизма:
участвуют в обмене белков, липидов, воды, солей, желчных и нуклеиновых кислот, холестерина, половых (стероидных) гормонов и других макромолекул;
служат клеткам хозяина источником энергии;
усиливают процесс всасывания из кишечника ионов кальция, витамина Д и железа, предотвращая развитие рахита;
4)участвуют в процессах пищеварения и моторике кишечника:
5
способствуют перистальтике и своевременному опорожнению кишечника за счет образования продуктов жизнедеятельности кишечных бактерий (кислоты и газа), а также конечных продуктов обмена белков (индола, скатола и др.);
регулируют газовый состав кишечника и других полостей организма хозяина;
5)участвуют в синтезе:
-синтезируют биологически активные соединениявитамины (В1, В2, К, рибофлавин, никотиновую, пантеноловую и
фолиевую кислоты), аминокислоты, белки, антибиотики, гормоны, медиаторы и др.;
6)выполняют детоксицирующую функцию:
ингибируют выделение энтеропатогенными эшерихиями термолабильного токсина;
детоксицируют экзогенные и эндогенные субстраты путем их сорбции или трансформации в нетоксичные продукты;
7)обладают мутагенной и антимутагенной активностью;
8)генетическая функция:
хранят хромосомные и плазмидные гены;
способны обмениваться генетической информацией, антигенами с клетками хозяина и приобретать защиту от иммунной системы.
Состав микрофлоры зависит от характера биотопа (табл.29, 30,31; рис.9, 10), питания, возраста, эндокринного фона хозяина и других факторов.
Наиболее густо заселены (в порядке убывания количества и разнообразия видов): толстый кишечник, ротовая полость, верхние дыхательные пути, кожа, влагалище.
К биотопам со скудным содержанием микрофлоры относят мочевые, желчные пути, желудок, конъюнктиву глаза, легкие.
Существуют также стерильные биотопы, в которых отсутствует постоянная микрофлора (кровь, ликвор, лимфа, плевральная, синовиальная полости и др.). В условиях
6
физиологической нормы кратковременно микроорганизмы могут появляться в таких биотопах, однако в дальнейшем происходит их элиминация.
Таблица 29 Состав нормальной микрофлоры различных биотопов человека
Облигатная группа |
|
|
Факультативная группа |
|
Кожа |
||
Corynebacterium acnes |
|
|
Staphylococcus aureus (5%) |
Staphylococcus epidermidis |
|
|
Candida albicans (3-5%) |
Staphylococcus saprophyticus |
|
|
|
Грибы |
|
|
|
Спорообразующие палочки |
|
|
|
Конъюнктива (1719% стерильна) |
|||
Corynebacterium acnes |
|
|
Streptococcus haemolyticus |
Staphylococcus epidermidis |
|
|
Р. Micrococcus |
Staphylococcus saprophyticus |
|
|
Р. Klebsiella |
|
|
|
Р. Moraxella |
|
|
|
Р. Haemophilus |
|
|
|
Staphylococcus aureus |
Носовые ходы |
|||
Corynebacterium acnes |
|
|
Staphylococcus aureus |
Staphylococcus epidermidis |
|
|
Streptococcus haemolyticus et |
Staphylococcus saprophyticus |
|
|
anhaemolyticus |
|
|
|
Р. Neisseria |
|
|
|
Р. Moraxella |
|
|
|
Р. Haemophilus |
|
|
|
Р. Corynebacterium |
|
|
|
Р. Mycobacterium |
|
Носоглотка |
||
Streptococcus anhaemolyticus |
|
|
Staphylococcus aureus (11-18%) |
Bacteroides fragilis |
|
|
Р. Neisseria |
Спириллы |
|
|
Streptococcus pneumoniae |
вибрионы |
|
|
Р. Haemophilus |
Branchamella catarrhalis (28%) |
|
|
Р. Mycobacterium |
Veilonella alcalescens |
|
|
|
|
7 |
|
|

Микрофлора мужской половой системы
Наружных половых органов |
Уретры |
Mecobacterium smegmatis |
S.epidermidis |
спирохеты |
E.coli |
фузиформные бактерии |
Дифтероиды |
|
Микоплазмы |
|
Стрептококки |
Рис.9. Наиболее часто выделяемые представители нормальной микрофлоры мужской половой системы
Микрофлора женской половой системы
вульвы |
влагалища |
шейки матки |
уретры |
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
S.epidermidis |
Лактобактерии |
Лактобактерии Лактобактерии |
|||||
Стрептококки |
S.epidermidis |
Бифидобактерии |
S.epidermidis |
||||
E.coli |
Пептострепто- |
S.epidermidis |
Пептострепто- |
||||
Клебсиеллы |
кокки |
Дифтероиды |
кокки |
||||
Микоплазмы |
Превотеллы |
Пептострепто- |
Дифтероиды |
||||
Дифтероиды |
Порфиромонасы |
Кокки |
|
|
|||
Вейлонеллы |
Бифидобактерии |
Бактероиды |
|
|
|||
Фузобактерии |
Бактероиды |
|
|
|
|
||
Бактероиды |
Энтерококки |
|
|
|
|
||
Рис. 10. Наиболее часто выделяемые представители нормальной микрофлоры женской половой системы
8
Таблица 30
Резидентная микрофлора ротовой полости
Основные группы |
Малые по количеству |
|
популяции |
Стрептококки |
Фузобактерии |
пептострептококки |
бактероиды |
вейлонеллы |
спирохеты |
дифтероиды |
лкптоспиры |
|
нейссерии |
|
гемофилы |
|
микоплазмы |
|
актиномицеты |
|
дрожжеподобные грибы |
|
простейшие |
|
|
9
Таблица 31 Качественный и количественный состав микрофлоры толстого
кишечника у здоровых людей
|
Содержание микроорганизмов |
|
|||
Виды микроорганизмов |
(м.т./г фекалий) в зависимости от |
|
|||
|
|
возраста. |
|
|
|
|
до 1 года |
От 1 года |
|
Старше 60 |
|
|
|
до 60 лет |
|
лет |
|
|
|
|
|
|
|
Облигатные представители: |
|
|
|
|
|
Бифидобактерии |
1010 - 1011 |
109 - 1010 |
|
108 - 109 |
|
Лактобактерии |
106 – 107 |
107 – 108 |
|
106 – 107 |
|
Пептострептококки |
<105 |
109– 1010 |
|
1010 |
|
Фузобактерии |
<106 |
108 – 109 |
|
108 – 109 |
|
Эубактерии |
106 – 107 |
109– 1010 |
|
109 – 1010 |
|
Эшерихии типичные |
107 – 108 |
107 – 108 |
|
1010 - 1011 |
|
Энтерококки |
105 - 107 |
105 - 108 |
|
106 - 107 |
|
Факультативные |
|
|
|
|
|
представители |
107 - 108 |
109 - 1010 |
|
1010 - 1011 |
|
Бактериоды |
|
|
|
|
|
Клостридии |
≤103 |
≤105 |
|
≤106 |
|
E.coli lac- |
<105 |
<105 |
|
<105 |
|
E.coli гемолитические |
0 |
0 |
|
0 |
|
Условно-патогенные |
|
|
|
|
|
энтеробактерии |
<104 |
<104 |
|
<105 |
|
Золотистый стафилококк |
0 |
0 |
|
0 |
|
Стафилококки |
|
|
|
|
|
эпидермальный, |
≤104 |
≤104 |
|
≤104 |
|
сапрофитный |
|
|
|
|
|
Дрожжеподобные грибы рода |
|
|
|
|
|
Candida, нитчатые грибы |
≤103 |
≤104 |
|
≤104 |
|
Неферментирующие |
≤103 |
≤104 |
|
≤104 |
|
бактерии |
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
3.Рассмотрение понятий «дисбиоз», «дисбактериоз кишечника», причин возникновения, степеней, принципов лабораторной диагностики и коррекции.
Состояние динамического равновесия между организмом хозяина, заселяющими его микроорганизмами и окружающей средой называют «эубиозом». Оно является одним из ведущих механизмов поддержания здоровья человека и рассматривается в настоящее время как важнейший фактор гомеостаза.
Несмотря на влияние различных факторов внешней среды состав нормальной микрофлоры относительно постоянен. Однако компенсаторные возможности организма хозяина не безграничны и при длительном воздействии неблагоприятных факторов происходят существенные сдвиги в составе нормальной микрофлоры, которые могут быть кратковременными, исчезающими после устранения факторов. Более длительные и стойкие изменения нормальной микрофлоры ведут к развитию дисбиоза.
Дисбиоз (дисбактериоз) - количественные, качественные и видовые нарушения в составе симбионтной микрофлоры.
Дисбактериоз кишечника - это качественные, количественные и видовые изменения в составе нормальной микрофлоры кишечника, при которых уменьшается количество или исчезают обычно присутствующие в ее составе микроорганизмы и появляются в большом количестве редко встречающиеся или несвойственные ей микробы. Это клинико-лабораторный синдром, поэтому решающее значение при постановке диагноза «дисбактериоз кишечника» имеет бактериологическое исследование кала, а клинические проявления могут быть или нет в зависимости от степени дисбактериоза.
Дисбиоз может являться одной из причин развития различных состояний и заболеваний как инфекционной, так и неинфекционной природы:
эндоинфекции и суперинфекции различной локализации;
колиты, гастриты, дуодениты, язвенная болезнь желудка и двенадцатиперстной кишки;
поражение печени;
коагулопатии;
гипо-и гиперхолестеринемия;
ревматоидные артриты, спондилоартриты, другие поражения суставов и соединительной ткани;
злокачественные новообразования желудка, толстой кишки, молочной железы;
нарушение менструального цикла;
кариес;
мочекаменная болезнь;
бронхиальная астма, атопические дерматиты и другие аллергические заболевания;
болезни водносолевого и гормонального обмена (анемия, кахексия, подагра).
Факторы, способствующие развитию кишечного дисбактериоза
врожденная патология ЖКТ;
неполноценное и нерациональное питание;
гипо- и авитаминозы;
длительное бесконтрольное лечение антибиотиками, гормональными препаратами;
заболевание ЖКТ микробной и немикробной этиологии;
облучение, химиотерапия злокачественных новообразований;
11
длительное пребывание в стационарах, где происходит заселение кишечника госпитальными штаммами микроорганизмов;
иммунодефицитные состояния;
выраженная аллергизация организма;
экстремальные воздействия и стрессовые ситуации;
загрязнение окружающей среды;
резкая смена климатогеографических условий проживания.
Основные направления лечения дисбактериоза:
по возможности устранение этиологического фактора;
использование иммуномодуляторов (системных и местных);
при необходимости применение антимикробной терапии, в первую очередь местных форм препаратов;
восстановление собственной микробиоты (использование сочетаний пробиотиков, пребиотиков, метабиотиков).
Пробиотики, или эубиотики – это группа препаратов, приготовленная на основе лиофильно высушенных живых штаммов определенных бактерий, являющихся представителями микрофлоры здорового человека (преимущественно лакто — и бифидобактерии, а также E.coli).
Особую группу представляют препараты-антагонисты, содержащие бактерии, которые в норме не живут в кишечнике человека, но при приеме внутрь подавляют рост патогенных кишечных микроорганизмов (B. subtilus, S. boulardii).
Положительный клинический эффект при заместительной терапии пробиотиками часто носит транзиторный характер, то есть проявляется только на фоне приема препаратов и быстро исчезает после окончания курса. Это обусловлено тем, что основная масса пробиотических микроорганизмов погибает в ЖКТ, а оставшиеся жизнеспособными бактерии являются чужеродными для естественной микрофлоры, не приживаются в биопленке алиментарного тракта и отторгаются; также они могут оказывать негативное воздействие на иммунную систему и организм человека в целом. В связи с этим в план комплексного лечения дисбактериоза включены препараты, способствующие восстановлению собственной микрофлоры — пребиотики и метабиотики.
Пребиотики - это вещества немикробного происхождения, которые не всасываются в тонкой кишке, но создают благоприятные условия и стимулируют рост и функции нормальной микрофлоры толстого кишечника:
препараты на основе пищевых волокон, олигосахаридов, аминокислот и т. д. (дюфалак, лактусан);
пребиотики, комбинированные с энтеросорбентами (лактофильтрум). Метабиотики, или метаболитные пробиотики, - препараты, содержащие
экзометаболиты, то есть продукты жизнедеятельности пробиотических бактерий (например, Хилак форте). Они восстанавливают физиологическую кислотность желудочно-кишечного тракта и баланс микробиоты, стимулирует регенерацию эпителия.
По составу пробиотики классифицруют на:
1)монокомпонентные – содержат только один штамм бактерий (Бифидумбактерин, Лактобактерин, Колибактерин и др.);
2)симбиотики - поликомпонентные препараты, содержащие несколько видов микроорганизмов (Бифинорм, Ацилакт, Аципол, Линекс, Бифиформ);
12
3)синбиотики – комбинированные препараты, содержащие живые бактерии и вещества, создающие оптимальные условия для их роста, например, кипацид (лактобактерии и иммуноглобулины), бифилиз (бифидобактерии и лизоцим), биофлор (кишечная палочка и экстракт сои и прополиса), кальсис (лактобактерии, селен, витамин Е, отруби овса, клетчатка цитрусовых); биокомплексы "Нормофлорины" (на основе лактобацилл и бифидобактерий);
4)сорбционные – содержат бактерии нормальной микрофлоры в сочетании с энтеросорбентами, например, Бифидобактерин-форте, Пробиофор, Бификол форте, Экофлор;
5)рекомбинантные – содержат генно-модифицированные бактерии, имеющие ген с определенными характеристиками (Субалин).
Методы изучения качественного состава и количественных изменений в составе микробного биоценоза:
1)ориентировочный – микроскопический.
2)основной - бактериологический с дозированным посевом на соответствующие питательные среды (табл.32) и дальнейшей идентификацией микроорганизма по стандартным схемам; исследования проводятся двукратно.
Таблица 32
Группы микроорганизмов, определяемые при бактериологическом исследовании кала на дисбактериоз, и питательные среды, используемые для их культивирования
Микроорганизмы |
Питательные среды |
||
Бифидобактерии |
|
|
Среда Блаурокк |
Лактобактерии |
|
|
Капустный агар или молочно- |
|
|
|
редукционная среда (МРС) |
Бактероиды |
|
|
Среда КАБ (с кровью) |
Энетробактерии, |
|
|
Среда Эндо |
неферментирующие |
|
|
|
микроорганизмы. |
|
|
|
Энтеробактерии, стафилококки, |
Кровяной агар |
||
энтерококки (для выявления |
|
||
гемолитической активности) |
|
||
Энтерококки |
|
|
Молочно-ингибиторная среда |
Стафилококки |
|
|
Желточно-солевой агар |
Протей |
|
|
Скошенный МПА |
|
|
|
( посев по Шукевичу) |
Клостридии |
|
|
Среда Вильсон-Блер |
Кандиды |
и |
другие |
Среда Сабуро |
дрожжеподобные |
и |
плесневые |
|
грибы |
|
|
|
13
ЗАКЛЮЧЕНИЕ по разделу «Физиология и изменчивость микроорганизмов. Антимикробные
мероприятия. Основы медицинской микробной микроэкологии».
Для построения клеточных структур и осуществления жизнедеятельности микробные клетки должны иметь источники углерода и энергии, получаемые в процессе питания. Медицински значимые виды обладают гетерохемоорганотрофным типом питания (утилизируют готовые органические соединения, поступающие из внешней среды, АТФ запасают при их распаде в процессе протекания окислительновосстановительных реакций). Наиболее частыми механизмами транспорта питательных веществ через цитоплазматическую мембрану является активный транспорт и транспорт с транслокацией химических групп. Пассивные способы (простая и облегченная диффузия) используются бактериями крайне редко. Совокупность всех химических превращений, происходящих в клетке, называется метаболизмом. Для его обеспечения микробной клетке требуется наличие разнообразных ферментов, которые могут быть отнесены ко всем шести известным биохимическим классам, а также могут являться эндо-и экзофрментами, конститутивными и индуцибельными. Синтез АТФ возможен за счет использования энергии, выделяемой в процессе энергетического метаболизма при дыхании и брожении. В зависимости от типа энергетического метаболизма и потребности в молекулярном кислороде микроорганизмы подразделяют на облигатные аэробы, микроаэрофилы, факультативные и облигатные анаэробы.
Для культивирования бактерий в лабораторных условиях используются питательные среды, которые должны иметь набор питательных веществ, иметь определенные физико-химические характеристики, быть стерильными и легко приготвливаемыми. Все многообразие питательных сред можно разделить в зависимости от назначения на универсальные, элективно-селективные, дифференциальнодиагностические, накопительные, обогатительные, специальные, для выращивания анаэробов.
Совокупность микроорганизмов одного вида или популяции, выращенная на питательной среде, называется чистой культурой и идентифицируется до вида по ряду свойств: тинкториальным, морфологическим (в мазках, окрашенных по Граму), культуральным (при описании колоний и характера роста в жидких средах), ферментативным (на традиционных диффернциально-диагностических средах, в микротест-системах, баканализаторах), антигенным (при постановке серологических реакций). В некоторых случаях для установления внутривидовой категории определяют чувствительность к бактериофагам, колицинам и др. Наиболее благоприятной для идентификации фазой роста культуры является логарифмическая.
В процессе культивирования необходимо создавать оптимальные условия: температуру, влажность, для анаэробных видов — условия анаэробиоза; время выращивания зависит от периода генерации вида и в большинстве случаев составляет 1-2 сутки. Наиболее удобным и эффективным методом создания анаэробных условий в настоящее время является использование автономных анаэростатов с газпакетами, продцирующими заданную атмосферу в замкнутой емкости, куда помещены посевы.
Очень важным этапом бактериологического исследования является установление чувствительности выделенных от пациентов культур к антимикробным препаратам с целью проведения рациональной антибиотикотерапии. Это можно выполнить с использованием следующих методов: диффузионных (диско-диффузионного и епсилонтеста), серийных разведений, автоматизированными и ускоренными способами, а также установить гены резистентности у некоторых видов бактерий с помощью молекулярногенетических методов.
14
Для предотвращения распространения инфекционных заболеваний в ЛПУ используется ряд мероприятий: микробная деконтаминация объектов внешней среды (дезинфекция , стерилизация) и биотопов живого организма (антисептика, химиотерапия, а также комплексные меры, включающие как методы прямого повреждающего действия на микроорганизмы, так и разграничительные мероприятия, а также мероприятия, направленные на повышение иммунного статуса пациентов.
Микроорганизмы, более или менее часто выделяющиеся из организма здорового человека, принято называть нормальной микрофлорой, или микробиотой. Облигатная микрофлора приносит несомненную пользу хозяину, а ее отсутствие или снижение количества обычно неблагоприятно сказывается на здоровье хозяина. Качественные и количественные нарушения в составе симбионтной микрофлоры обозначается термином дисбакериоз — клинико-лабораторный синдром, подтвердить который возможно только с использованием 2-кратного бактериологического исследования. Коррекция дисбиозов проводится комплексно с использованием пробиотиков, пребиотиков, метабиолтиков и других направлений.
Микроорганизмы в значительной степени подвержены изменчивости - мутационной и модификационной. Особый вид представляют генетические рекомбинации
— обмен генетической информацией между микроорганизмами-донорами и реципиентами: трансформации, трансдукции, конъюгации. Одним из наиболее важных аспектов изменчивости является приобретение штаммом маркеров резистентности к антимикробным препаратам, а также применение в промышленности генетически модифицированных микроорганизмов с заданными свойствами для получения коммерчески ценных продуктов и лекарств (вакцин, антибиотиков и др.). Генетические методы исследований широко используются при диагностике инфекционных и неинфекционных заболеваний, в судебной медицине, при генотерапии.
15
