
protokoly_k_zanyatiam_PF_2k
.pdfПротокол № 1 Окраска препаратов простым методом
При окраске препаратов простым методом использовали культуры микроорганизмов, выросшие на МПА - №1 и МПБ - №2.
Для приготовления мазка из культуры №1 на предварительно обезжиренное предметное стекло нанесли 3-4 капли физ.раствора. Простерилизованной в пламени спиртовки петлей взяли со скошенного МПА культуру №1, суспендировали ее в физ.растворе, высушили и зафиксировали над пламенем спиртовки.
Для приготовления мазка из культуры №2на предварительно обезжиренное предметное стекло нанесли 3-4 капли МПБ с находящимися там микроорганизмами. Мазок высушили и зафиксировали над пламенем спиртовки.
На фиксированный мазок из культур №1 нанесли краситель метиленовый синий на 5 мин., а на мазок из культуры №2 - краситель фуксин Пфейффера на 1-2 мин. Затем слили красители и промыли мазки дистиллированной водой, просушили фильтровальной бумагой.
Полученные препараты из культур №1 и №2 микроскопировали с иммерсионной системой.
В мазке из культуры №1 обнаружили кокки в виде «гроздьев винограда» синего цвета, из культуры №2 – палочки красного цвета.
Рисунок
Заключение
На основании полученных результатов считаем, что предположительно, в мазке из культуры №1 обнаружены, стафилококки, из культуры №2 – палочки средних размеров.
Протокол № 2 Окраска препаратов сложным методом по Граму
При окраске препаратов сложным методом использовали смесь неизвестных микроорганизмов в физ.растворе, из которой готовили фиксированный препарат.
Окрашивали препарат по Граму следующим образом:
1)на фиксированный мазок накладывали фильтровальную бумагу, на которую наносили раствор генциан-виолета на 1-2 мин., затем раствор сливали;
2)обрабатывали мазок раствором Люголя 30-60 с. и, не промывая его водой, сливали раствор;
3)обесцвечивали мазок путем нанесения на стекло 95% спирта на 20-50 с., далее промывали препарат водой;
4)наносили на мазок фуксин Пфейффера, через 1-2 мин. краситель сливали, препарат промывали водой, высушивали фильтровальной бумагой и микроскопировали с иммерсионной системой.
Вмазке обнаружили Грам+ бактерии – кокки, расположенные в
виде «гроздьев винограда» фиолетового цвета, и Грамбактерии – палочки средних размеров, окрашенные в красный цвет, расположенные хаотично
Рисунок
Заключение
На основании полученных результатов считаем, что в исследованной смеси микроорганизмов содержатся, предположительно, микроорганизмы, относящиеся к роду Staphylococcus, и палочковидные бактерии.
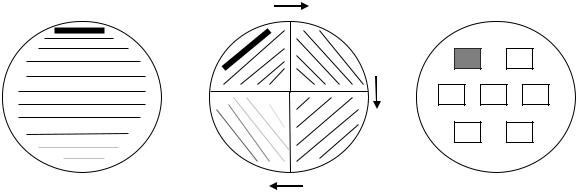
Протокол № 3 Выделение чистых культур аэробных и факультативно-анаэробных
бактерий и их идентификация
1 этап исследования
Для выделения чистой анаэробных микроорганизмов петлей – секторами, штрихами МПА.
культуры аэробных и факультативнопроизвели посев смеси микроорганизмов и шпателем – площадками на пластинки с
|
I |
II |
|
8 |
|
8 |
|
|
|
|
|
● |
|
●●● |
8 |
8 8 8 8 |
8 8 8 |
8 |
|
|
|
|
IV |
III |
штрихами |
секторами |
площадками |
Посевы поместили в термостат при +370С на сутки.
2 этап исследования
Учет роста.
На МПА обнаружены колонии микроорганизмов 2-х типов:
1 типа - средних размеров, круглой формы, с гладкой поверхностью, полупрозрачные;
2 типа - мелкие, округлые, с гладкой поверхностью и ровным
краем, выпуклые, непрозрачные, золотистого цвета.
При окраске по Граму в мазках из колоний 1 типа обнаружены Грампалочки средних размеров, расположенные хаотично; 2 типа –Грам + кокки, расположенные в виде «гроздьев винограда».
Произвели посев культуры из колоний 1 и 2 типа на скошенный МПА для накопления выделенных чистых культур микроорганизмов. Посевы поставили в термостат на сутки.
3 этап исследования
Учет роста. На скошенном МПА с посевом культуры из колоний 1 типа обнаружен рост в виде полупрозрачного слизистого налета, 2 типа- золотисто-белого налета.
Для проверки чистоты выделенной культуры сделали мазки и окрасили по Граму. В мазках из культуры 1 типа – Грампалочки средних размеров, расположенные хаотично,2 типа - Грам+ кокки, расположенные в виде «гроздьев винограда».

Для идентификации выделенных чистых культур определили их ферментативную активность. Для этого произвели посев чистой культуры микроорганизмов 1 типа на среды короткого "пестрого" ряда с глюкозой, лактозой, маннитом, мальтозой, сахарозой (для обнаружения сахаролитических ферментов), в пробирки с МПБ и СИБами (для определения образования индола и сероводорода).
Посев чистой культуры микроорганизмов 2 типа произвели в пробирку с цитратной кроличьей плазмой (для определения фермента патогенности плазмокоагулазы), на пластинку МЖСА (для определения фермента патогенности лецитиназы), полужидкие среды Гисса с маннитом в аэробных условиях и глюкозой анаэробно (для выявления сахаролитических ферментов).
Посевы поместили в термостат на сутки.
4 этап исследования
Учет роста.
Впосеве культуры 1 типа на средах «пестрого ряда» обнаружено изменение цвета сред и пузырьки газа, что свидетельствует о наличии сахаролитических ферментов, разлагающих глюкозу, лактозу, маннит, мальтозу, сахарозу с образованием кислоты и газа. В МПБ индикаторная полоска на индол покраснела (индол «+»), на сероводород – диск остался без изменения цвета (Н2S «-»).
Впосеве культуры 2 типа обнаружено:
- в цитратной кроличьей плазме - образование сгустка, что свидетельствует о наличии фермента патогенности плазмокоагулазы,
-на МЖСА - колонии золотистого цвета с зонами опалесценции, что свидетельствует о наличии фермента патогенности лецитиназы,
-на средах с глюкозой и маннитом – изменение цвета сред на поверхности и внутри столбика, что свидетельствует на наличии ферментов, разлагающих глюкозу и маннит.
Спомощью сравнения полученных результатов со справочными таблицами (из инструктивных документов) провели идентификацию выделенных культур.
Регистрация результатов:
тесты |
глюкоза |
лактоза |
сахароза |
мальтоза |
маннит |
Н2S |
индол |
выделение |
|
|
|
|
|
|
|
К |
+ |
+ |
+ |
+ |
+ |
|
|
Г |
+ |
|
|
|
|
- |
+ |
Условные обозначения: К – выделение кислоты; |
Г – выделение газа |
|
|||||
Заключение
На основании полученных результатов считаем, что из смеси микроорганизмов выделены культуры рода Esherichia и вида Staphilococcus
аureus.
Протокол № 4 Выделение чистой культуры анаэробных бактерий и ее
идентификация
1 этап исследования
Произвели посев суспензии из почвы в регенерированные кипячением и охлажденные до +450С питательные среды: Китт-Тароцци, Вильсон-Блер и молоко по Тукаеву. Посевы поместили в термостат при +370С на сутки.
2 этап исследования
Учет роста через 5 часов культивирования. На среде Китт-Тароцци обнаружено диффузное помутнение и пузырьки газа на кусочках паренхиматозных органов. На среде молоко по Тукаеву – образование творожистого сгустка, выброшенного газами на поверхность среды, ВильсонБлер – почернение и разрывы среды вследствие газообразования.
Для выделения чистой культуры анаэробных микроорганизмов произвели разведение культуры, выросшей на среде Китт-Тароцци, по методу Вейнберга (схема 1) с помощью пастеровской пипетки, которую последовательно вносили в среду Китт-Тароцци с посевом, три пробирки с физ.раствором и три пробирки с расплавленным и остуженным МПА. Из последней пробирки (№6) содержимое (МПА и культура микроорганизмов) внесли в чашку по Перетцу. Посевы поместили в термостат.
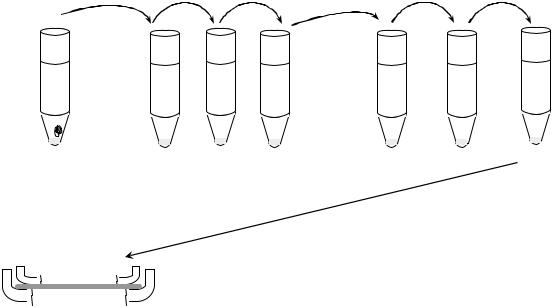
Схема 1.
Разведения культуры по методу Вейнберга с последующим посевом по Перетцу
исследуемая |
|
|
|
физиологический |
расплавленный и остуженный |
||||
культура в |
|
|
|
раствор |
МПА |
||||
среде Китт- |
|
|
|
|
|
||||
Тароцци |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Посев по Перетцу
3 этап исследования
Учет роста. В пробирках с МПА обнаружили рост в виде мелких дискообразных непрозрачных колоний белого цвета или колоний в виде «комочков ваты».
В чашке с посевом по Перетцу обнаружили рост в виде мелких непрозрачных плотных колоний серо-белого цвета. Из отдельной колонии приготовили мазок и окрасили по Граму. В мазке – крупные Грам+ палочки.
Для накопления выделенной чистой культуры анаэробов произвели посев изолированной колонии на среду Китт-Тароцци. Посевы – в термостат.
4 этап исследования
Учет роста. На среде Китт-Тароцци обнаружили рост в виде осадка на дне пробирки, сопровождающийся выделением газа. Для проверки чистоты культуры сделали мазки и окрасили по Граму. В мазках – крупные Грам+ палочки.
Для идентификации выделенной чистой культуры анаэробов изучали сахаролитические свойства путем посева в среды Гисса - полужидкие, высоким столбиком в пробирках (глюкоза, сахароза, лактоза, галактоза, левулеза, мальтоза, глицерин).
Для определения клостридиального альфа-токсина произвели посев на пластинку яично-желточного агара (ЯЖА) и глюкозо-кровяного агара (ГКА).
Посевы поставили в термостат.
5 этап исследования
Учет роста. На ЯЖА обнаружен рост в виде крупных колоний округлой формы с ровными краями, окруженных зонами опалесценции, свидетельствующими о наличии лецитиназной активности.
На ГКА - крупные, округлые, сочные, сероватые колонии с зоной гемолиза, свидетельствующей о наличии гемолитической активности.
На средах Гисса - изменение цвета всех сред, сопровождающееся выделением газа, что свидетельствует о наличии соответствующих сахаролитических ферментов.
Произвели сравнение полученных результатов с помощью справочной таблицы для идентификации анаэробных микроорганизмов.
Заключение
На основании полученных результатов считаем, что из почвенной суспензии выделены микроорганизмы, относящиеся к виду Clostridium perfringens.
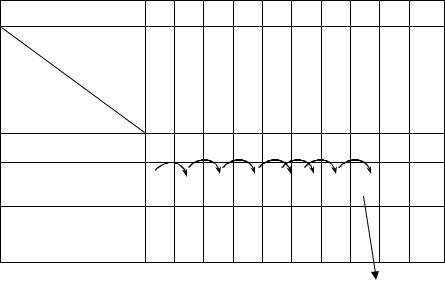
Протокол № 5 Определение чувствительности микроорганизмов к антибиотикам
методом серийных разведений
В качестве исследуемого материала использовали взвесь культуры S.aureus густотой 0,5 по стандарту мутности McFarland (108 м.т./мл) и раствор бензилпенициллина в концентрации 100мкг/мл в буферном р-ре.
Все ингредиенты внесли в лунки планшета микрометодом в соответствии с «МУК по определению чувствительности микроорганизмов к антибактериальным препаратам» по схеме.
Схема определения чувствительности S.aureus к бензилпенициллину |
|||||||||||
|
|
методом серийных разведений |
|||||||||
№ лунок |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Разведение анти- |
|
|
|
|
|
|
|
|
|
|
|
биотика |
|
|
12,5 |
6,25 |
3,12 |
1,56 |
0,78 |
0,39 |
КК |
КАБ |
|
мкг/мл |
50 |
25 |
|||||||||
|
|||||||||||
Ингредиенты |
|
|
|
|
|
|
|
|
|
|
|
МПБ (мкл) |
0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 |
||||||||||
бензилпенициллин |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
– |
0,1 |
|
(100 мкг/мл) |
|||||||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
взвесь S.aureus |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
– |
|
(мкл) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
0,1 мкл в дез.раствор |
|
|
|||||
Посевы инкубировали при +370С 24часа.
Условные обозначения:
«+» - рост в виде диффузного помутнения среды «-» - отсутствие роста (прозрачная среда)
МПК бензилпенициллина составила 1,56 мкг/мл (последняя лунка, где рост отсутствовал). Оценку результатов проводили с использованием справочной таблицы из МУК, в соответствии с которой установили, что МПК бензилпенициллина находится в диапазоне резистентности (превышает 0,25 мкг/мл).
Заключение
На основании полученных результатов считаем, что исследованная культура S.aureus резистентна к пенициллину (МПК – 1,56 мкг/мл).
Протокол № 6 Определение чувствительности микроорганизмов к антибиотикам
диско-диффузионным методом
1 этап исследования
В качестве исследуемого материала использовали взвесь S.aureus густотой 0,5 по стандарту мутности McFarland (108 м.т./мл). Произвели ее посев в объеме 1 мл «сплошным газоном» на пластинку агара МюллераХинтона в соответствии с «МУК по определению чувствительности микроорганизмов к антибактериальным препаратам». Засеянную поверхность подсушили и наложили на нее на одинаковом расстоянии друг от друга и от края чашки 2 см с помощью стерильного пинцета бумажные диски, содержащие определенную дозу антибиотиков: бензилпенициллин, оксациллин, эритромицин, линкомицин, ципрофлоксацин, гентамицин, доксициклин.
Посев инкубировали при +370С 24 часа.
2 этап исследования
Учет результатов. Произвели измерение диаметров (в мм) зон задержки ростаS.aureus вокруг дисков с антибиотиками:
бензилпенициллин–10 мм, оксациллин – 10 мм, эритромицин – 25 мм, линкомицин – 25 мм, ципрофлоксацин – 23 мм, гентамицин – 10 мм, доксициклин – 14 мм.
Оценку результатов проводили по таблице из МУК, сопоставляя полученные диаметры зон задержки роста с диаметрами для резистентных, промежуточных и чувствительных культур.
Заключение
На основании полученных результатов считаем, что исследованных штамм S.aureus чувствителен к эритромицину, линкомицину и ципрофлоксацину; резистентен к бензилпенициллину и оксациллину; проявляет промежуточную чувствительность к доксициклину.
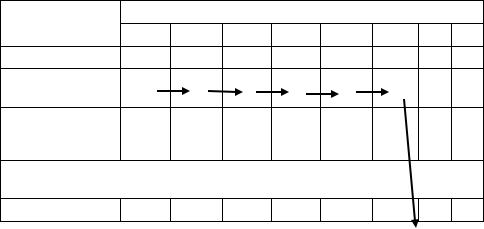
Протокол № 7 Постановка развернутой реакции агглютинации (РА) в пробирках
по типу Видаля
Вкачестве исследуемого материала использовали сыворотку больного
сподозрением на брюшной тиф в разведении 1/25.
Произвели титрование сыворотки в пробирках согласно схеме с изотоническим раствором хлорида натрия (ИХН) путем приготовления последовательных двукратных разведений от 1/50 до 1/1600. Для этого в шесть опытных и две контрольные пробирки (КС – контроль сыворотки, КА
– контроль антигена) внесли по 0,5 мл физ. раствора. В 1-ю пробирку ряда добавили 0,5 мл исследуемой сыворотки, перемешали и 0,5 полученного раствора перенесли во 2-ю пробирку; снова перемешали и так далее до 6-й пробирки, из которой избыточный объем 0,5 мл удалили в емкость с дез.раствором.
Во все опытные пробирки и КА добавили по 2 капли антигена - брюшнотифозного диагностикума, представляющего собой взвесь убитых брюшнотифозных бактерий.
|
|
Схема постановки РА по Видалю |
||||||
Ингредиенты |
|
Разведения исследуемой сыворотки |
|
|
||||
|
1/50 |
1/100 |
1/200 |
1/400 |
1/800 |
1/1600 |
КС |
КА |
ИХН |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
Исследуемая |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
- |
сыворотка |
|
|
|
|
|
|
|
|
Брюшнотифозный |
2к. |
2к. |
2к. |
2к. |
2к. |
2к. |
- |
2к. |
антигенный |
|
|
|
|
|
|
|
|
диагностикум |
|
|
|
|
|
|
|
|
Пробирки встряхивают и помещают в термостат при 370 С на 2 ч., затем сутки |
||||||||
|
выдерживают при комнатной температуре. |
|
|
|
||||
Учет |
++++ |
++++ |
++++ |
+++ |
+++ |
- |
- |
- |
|
|
|
|
|
|
дез.раствор |
||
Учет проводим по 4-х крестной системе в зависимости от выраженности хлопьевидного осадка и степени прозрачности надосадочной жидкости. КА – отрицателен (равномерное помутнение)
КС – отрицателен (прозрачный раствор)
Титр исследуемой сыворотки с брюшнотифозным диагностикумом составил 1/800 (диагностический титр при брюшном тифе – 1/100-1/200).
Заключение
На основании полученных результатов РА установили, что в исследованной сыворотке антитела к возбудителю брюшного тифа находились в титре 1/800, что превышало диагностический титр.
