
6_Lektsia_Obmen_kholesterola_zhelchnykh_kislot_i_ketonovykh_tel
.pdf
ОБМЕН ХС И ЖЁЛЧНЫХ КИСЛОТ
ХС относится к группе стероидов. Эти соединения имеют в своей структуре циклопентанпергидрофенантреновое ядро. Среди стероидов выделяют соединения стеринов (или стеролов). Характерным для них является наличие НО-
группы в третьем положении и боковой цепи в семнадцатом положении.
ХС (холестерол) – производное стеринов, представляющее собой мононенасыщенный спирт (рис. 18).
Кольцевая структура ХСа отличается значительной жёсткостью, но боковая цепь довольно подвижна. Наличие в третьем положении кольца А ОН-группы позволяет отнести ХС к полярным липидам, способным образовывать сложные эфиры с жирными кислотами.
Образование эфиров ХСа
1. В цитоплазме клеток, в эндоплазматическом ретикулуме происходит этерификация ХСа под действием ацилхолестеролацилтрансферазы (АХАТ).
Этерификация ХСа в эндоплазматическом ретикулуме
2. В плазме крови этерификация ХСа, входящего в состав ЛПВП происходит под действием лецитинхолестеролацилтрансферазы (ЛХАТ). ЛХАТ синтезируется в гепатоцитах, а затем секретируется в кровоток, где образует прочный комплекс с ЛПВП. Источником жирной кислоты для этерификации является лецитин, входящий в состав ЛПВП. В молекуле лецитина ЛХАТ отщепляет молекулу ненасыщенной жирной кислоты во втором положении и присоединяет её к НО-группе ХС. В результате образуется сложный эфир ХСа и жирной кислоты и лизолецитин.
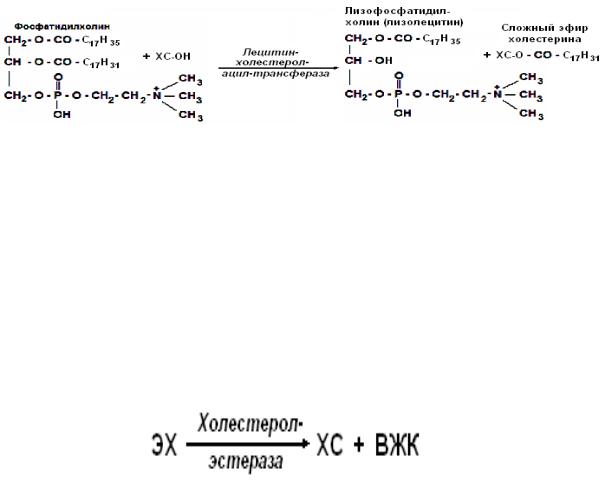
ЭХС преобладают в крови и находятся, в основном, в составе ЛПВП, в
лейкоцитах, миндалинах и лимфоузлах, а также в цитоплазме клеток надпочечников и гепатоцитов. Небольшое количество эфиров ХСа содержит эпидермис, жировая ткань и клетки кишечника (около 10% от общего содержания ХСа). Следовые количества эфиров ХСа находятся в нервной ткани. При патологических состояниях эфиры ХСа накапливаются в нервной ткани.
Эфиры ХСа рассматриваются как запасная форма ХСа. В лизосомах клеток имеется фермент холестеролэстераза, который в зависимости от условий и потребности клетки расщепляет эфиры ХСа на ХС и жирные кислоты.
С возрастом в плазме крови, коже, соединительной и жировой тканях, во внутренней оболочке сосудов происходит увеличение содержания ХСа,
преимущественно за счёт накопления его эфиров, образованных с олеиновой и линолевой жирными кислотами.
В целом, в организме млекопитающих свободный ХС преобладает над эфирами ХСа. Свободный ХС локализован в клеточных мембранах, миелиновых оболочках, эритроцитах, адипоцитах, желчи, в клетках слизистой кишечника (80-
90% свободного ХСа). В клетке свободный ХС распределяется следующим образом:
больше всего – в мембранах
меньше – в митохондриях
еще меньше – в ядрах
и меньше всего – в клеточной жидкости.
Втеле взрослого человека содержится около 210-250 г ХС. Метаболизм ХС в различных тканях протекает с различной скоростью, в связи с чем, выделяют несколько пулов ХСа:
1. Быстро обменивающийся пул (в течение 30 суток). Это ХС печени, эпителия кишечника, плазмы (в составе ЛП) и других паренхиматозных органов. Этот пул составляет около 30 грамм из общего количества ХСа.
2. Медленно обменивающийся пул (в течение нескольких месяцев). Это ХС жировой ткани. На него приходится около 50 г от общего количества ХС.
3. Очень медленно обменивающийся пул (в течение года). Это – ХС, который содержится в головном и спинном мозге, в соединительной ткани. На него приходится 60 г из 140 г общего ХС.
Особое значение имеет быстро обменивающийся пул ХС:
1.ХС печени окисляется в жёлчные кислоты (в сутки 0,5 г);
2.синтез стероидных гормонов (0,1 г в сутки);
3.избыток ХС удаляется в виде вторичных жёлчных кислот (0,5 г в сутки) с фекалиями;
4.ХС удаляется со слущенным эпителием кишечника, кожи и секретом сальных желёз (0,1 г в сутки).
Итак, ежесуточно расход ХС составляет 1,2 г. Восполнение фонда ХС идёт за
счёт:
1)синтеза de novo (0,8 г в сутки);
2)экзогенного ХС, поступающего с пищей (0,4 г в сутки).
Вплазме крови взрослого человека уровень ХСа составляет 3,9 – 6,0 ммоль/л (их них 70% - эфиры ХСа (норма = 2,5-4,9 ммоль/л) и 30% свободный ХС (норма =
1,4-1,6 ммоль/л)). С возрастом уровень ХС повышается.
У новорождённых уровень ХС составляет 1,9 ммоль/л. У детей ХС необходим для клеточного деления и построения новых цитоплазматических мембран.
Нарушение процесса поступления ХС нарушает психическое и физическое развитие ребёнка.
С возрастом замедляется процесс окисления и выведения ХС, что сопровождается накоплением ХС в мембранах и изменяет физико-химических свойств последних. Такое явление получило название «холестериноз».
Атеросклероз можно рассматривать как его осложнение.
У пожилых людей уровень ХС составляет 6,0 ммоль/л и выше. Увеличение уровня ХС выше 6,7 ммоль/л называется гиперхолестеролемией, а уменьшение ниже 3,9 ммоль/л гипохолестеролемией. Гиперхолестеролемия является фактором риска развития ИБС и других заболеваниях, связанных с атеросклерозом. Отложение ХС на стенках сосудов приводит к атеросклерозу, а в жёлчном пузыре к образованию жёлчных камней.
Биосинтез ХС
Способностью синтезировать ХС обладают все клетки животных и человека, за исключением зрелых эритроцитов. В значительных количествах ХС синтезируется в печени (50-70%), в стенке слизистой тонкой кишки (15-
20%) и коже (около 5%). Гепатоциты и клетки слизистой тонкой кишки синтезируют ХС не только для своих нужд, но и на экспорт. Биосинтез ХС можно разделить на 3 стадии:
1)биосинтез мевалоновой кислоты;
2)образование из мевалоната сквалена;
3)циклизация сквалена и образование ХС.
Биосинтез мевалоновой кислоты
Реакция протекает в цитоплазме, в аэробных условиях, после приёма пищи,
богатой углеводами. Основным субстратом биосинтеза ХС является ацетил-КоА,
преимущественно углеводного происхождения и ацетил-КоА, образованный из аминокислот.
3,5-дигидрокси, 3-метилвалериановая (мевалоновая кислота)
Ацетил-КоА попадает в цитоплазму при помощи цитратного челночного механизма. В биосинтезе мевалоновой кислоты имеются реакции восстановления, что требует присутствия НАДФН++Н+. Источниками последнего являются: пентозофосфатный путь окисления глюкозы, окислительное декарбоксилирование малата в пируват, декарбоксилирование изоцитрата в α-
кетоглутарат. Далее протекают следующие реакции.
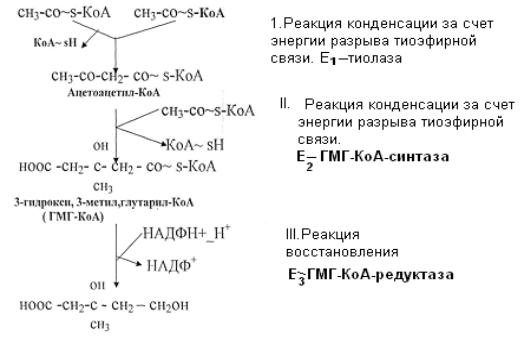
1.Реакция конденсации двух молекул ацетил-КоА за счёт энергии разрыва тиоэфирной связи с образованием ацетоацетил-КоА. Катализирует процесс фермент – тиолаза.
2.Реакция конденсации ацетоацетил-КоА с ацетил-КоА. Источником энергии также служит разрыв тиоэфирной связи. Реакция протекает с участием воды,
катализирует процесс фермент – ГМГ-КоА-синтаза. В результате образуется 3-
гидрокси-3-метилглутарил-КоА (ГМГ-КоА).
3. Реакция восстановления ГМГ-КоА в мевалоновую кислоту. Источником протонов является НАДФН++Н+. Катализирует реакцию ГМГ-КоА-редуктаза.
Второй стадией биосинтеза ХСа является образование сквалена. Процесс протекает с затратой 3-х молекул АТФ.
Третья стадия характеризуется циклизацией сквалена под действием циклазы в ланостерин. Затем в ходе двадцати последовательных реакций ланостерин превращается в ХС.
Регуляция биосинтеза ХС
Регуляторным ферментом биосинтеза ХС является ГМГ-КоА-редуктаза.
Различают метаболическую и гормональную регуляцию.
Метаболическая регуляция
Скорость синтеза ГМГ-КоА-редуктазы в печени подвержена суточным колебаниям. Максимум приходиться на полночь, минимум – на утренние часы.
Впечени скорость синтеза ХС регулируется по механизму отрицательной обратной связи. Это значит, что ХС как конечный продукт синтеза ингибирует активность ГМГ-КоА-редуктазы. Помимо этого, пищевой ХС угнетает синтез эндогенного ХС de novo.
Вэнтероцитах хенодезоксихолевая кислота также подавляет синтез эндогенного ХСа (de novo), поэтому можно считать, что в энтероцитах синтез ХС регулируется преимущественно концентрацией жёлчных кислот.
Гормональная регуляция
На активность ГМГ-КоА-редуктазы влияют гормоны: инсулин, Т3 и Т4,
повышающие активность фермента; глюкагон и глюкокортикоиды – снижают активность. Гормональная регуляция осуществляется по механизму ковалентной модификации – фосфорилирование/дефосфорилирование. Регуляторный фермент
– ГМГ-КоА-редуктаза активен в дефосфорилированной форме.
Инсулин, Т3 и Т4 активируют протеинфосфатазу, которая катализирует дефосфорилирование ГМГ-КоА-редуктазы и, таким образом, стимулирует синтез ХС. Кроме того, инсулин поддерживает ГМГ-КоА-редуктазу в дефосфорилированной форме за счёт перевода киназы ГМГ-КоА-редуктазы в дефосфорилированную, то есть неактивную форму.
Глюкагон активирует протеинкиназу, которая катализирует фосфорилирование белков, в том числе и ингибитора протеинфосфатазы, переводя его в активную
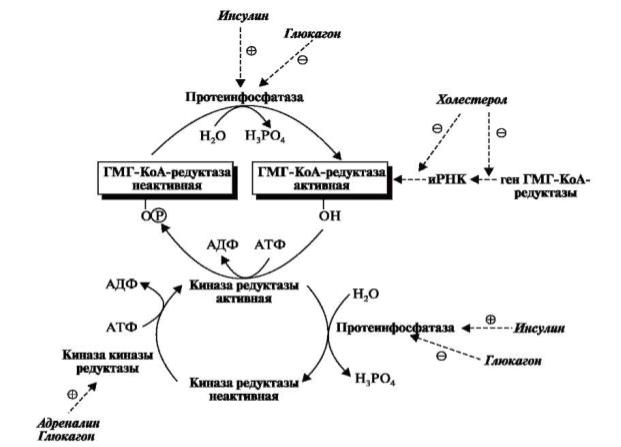
форму. В результате блокируется активность регулируемого фермента ГМГ-КоА-
редуктазы и, как следствие, синтез ХС.
Кроме того, глюкагон поддерживает ГМГ-КоА-редуктазу в фосфорилированной неактивной форме с помощью киназы ГМГ-КоА-редуктазы, которая активна в фосфорилированной форме.
Регуляция синтеза ХС
Катаболизм ХС
В клетках животных тканей нет ферментов, которые могли бы катализировать окисление ХС с разрывом стеринового кольца, не говоря уже об окислении до СО2 и Н2О. И, тем не менее, ХС в организме подвергается катаболизму с образованием различных продуктов, содержащих неразорванное стериновое кольцо, и отличающихся друг от друга не только химическими, но и физиологическими особенностями. В надпочечниках и плаценте из ХС образуются кортикоидные гормоны. В половых железах из ХС синтезируются стероидные гормоны. В печени катаболизм ХС протекает с образованием жёлчных кислот.
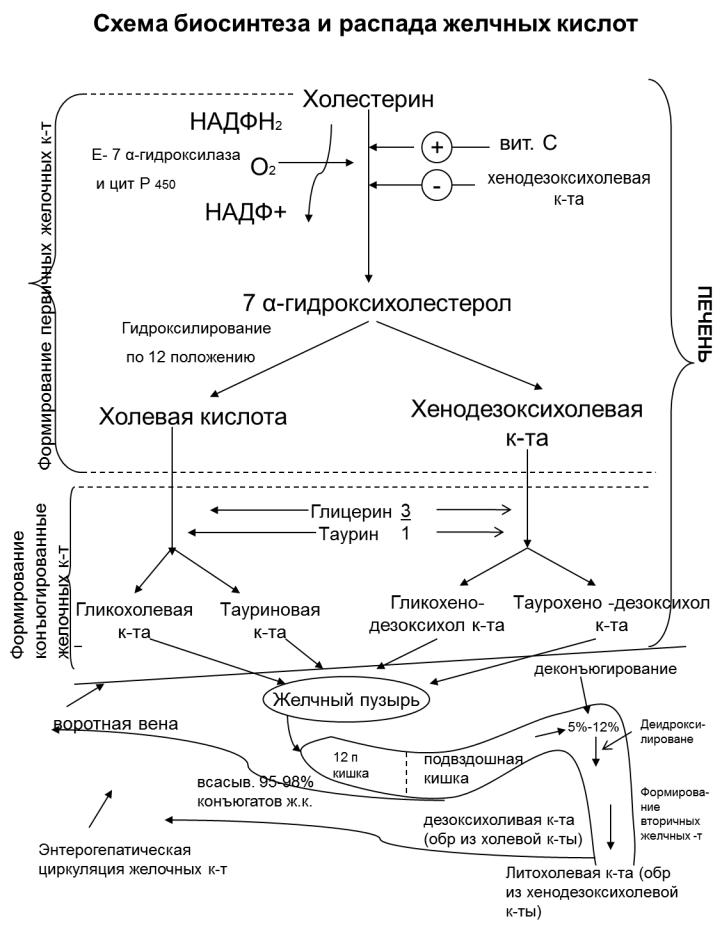
Образование жёлчных кислот
Первичные жёлчные кислоты образуются из ХС в печени. Среди жёлчных кислот в количественном отношении преобладает холевая кислота. Холевая и дезоксихолевая кислоты имеют общего предшественника, образующегося из ХС
–7-α-гидроксихолестерол.
Первым этапом образования жёлчных кислот является 7-α-гидроксилирование.
Реакция является скорость-лимитирующим звеном всего процесса. Реакция протекает с участием О2, НАДФН++Н+, цитохрома Р-450 и витамина С,
катализирует процесс фермент – 7-α-гидроксилаза.
7-α-гидроксилаза – это монооксигеназа, как и остальные ферменты последующих стадий гидроксилирования. При недостатке витамина С образование жёлчных кислот на стадии 7-α-гидроксилирования тормозится, что приводит к накоплению ХСа и развитию атеросклероза.
Путь биосинтеза жёлчных кислот разветвляется на ранней стадии. Одна из ветвей приводит к образованию холевой кислоты, имеющей дополнительную ОН-группу в двенадцатом положении, другая – к образованию хенодезоксихолевой кислоты
(при отсутствии ОН-группы в двенадцатом положении).
Холевая и хенодезоксихолевая – это первичные жёлчные кислоты. По сравнению с ХС они обладают выраженными гидрофильными свойствами. В норме жёлчные кислоты поступают в состав желчи в виде конъюгатов с глицином и таурином. В
основе конъюгации лежит образование пептидной связи между НОО С-группой жёлчной кислоты и NH2-группой глицина (NH2 – CH2 – COOH) или таурина (NH2
–CH2 – CH2 –SO3H).
Врезультате конъюгации образуются гликохолевая, таурохолевая,
гликохенодезоксихолевая, таурохенодезоксихолевая кислоты. Конъюгации подвергается 90% жёлчных кислот. Конъюгированные жёлчные кислоты являются более гидрофильными соединениями, чем соли жёлчных кислот. У
человека соотношение конъюгатов жёлчных кислот с глицином и таурином в норме составляет 3/1, так как количество таурина ограничено.
Поскольку жёлчь содержит значительное количество ионов Na и К и имеет щелочную реакцию, то принято рассматривать жёлчные кислоты и их конъюгаты в форме солей, откуда и возникает термин «жёлчные соли».
Затем, соли жёлчных кислот выделяются в составе желчи из жёлчного пузыря в просвет двенадцатиперстной кишки. Выполнив свою функцию, около 95% солей жёлчных кислот в подвздошной кишке всасываются и через воротную вену возвращаются в печень и повторно используются в эмульгировании жиров. Этот путь жёлчных кислот называют энтерогепатической циркуляцией. Каждая молекула жёлчной кислоты проходит этот путь 6-8 раз.
В кишечнике часть первичных жёлчных кислот (≈5%, в том числе и конъюгированные) под действием кишечных бактерий подвергаются деконъюгации и 7-α-дегидроксилированию, в результате чего образуются вторичные жёлчные кислоты: из холевой – дезоксихолевая, из хенодезоксихолевой – литохолевая.
Дезоксихолевая кислота всасывается в кишечнике, попадает в печень и там превращается в первичную – холевую кислоту. Литохолевая кислота плохо растворима в воде и не всасывается в кишечнике, а выводится в составе фекалий.
За сутки из организма выводится 500-600 мг жёлчных кислот. Путь выведения жёлчных кислот является и основным путём выведения ХСа из организма.
Гормональная регуляция
Тиреоидные гормоны индуцируют синтез 7-α-гидроксилазы и контролируют его активность. Эстрогены в детородном возрасте репрессируют синтез 7-α-
гидроксилазы. Такое влияние эстрогенов на синтез жёлчных кислот объясняет тот факт, что у женщин после менопаузы желчнокаменная болезнь встречается в
3-4 раза чаще, чем у мужчин. Гормональная регуляция осуществляется с помощью ковалентной модификации по механизму фосфорилирование/дефосфори-лирование. 7-α-гидроксилаза активна в фосфорилированной форме. Процесс фосфорилирования и дефосфорилирования контролируют тиреоидные гормоны через тирозинкиназу и тирозинфосфатазу, а
те, в свою очередь, активируют протенкиназу и протенфосфатазу.
Образование и распад жёлчных кислот
