
6_Lektsia_Obmen_kholesterola_zhelchnykh_kislot_i_ketonovykh_tel
.pdf
Регуляция образования жёлчных кислот
ОБМЕН КЕТОНОВЫХ ТЕЛ
Биосинтез кетоновых тел
К кетоновым телам относятся ацетоацетат, β-гидроксибутират и ацетон.
Синтез кетоновых тел происходит только в печени. Субстратом для синтеза является ацетил-КоА липидного происхождения (образованный в процессе
β-окисления жирных кислот), либо аминокислотного (образованный в процессе превращения кетогенных аминокислот ала, цис, сер, лиз). Процесс синтеза локализован в матриксе митохондрий. В физиологических условиях образование кетоновых тел идёт с небольшой скоростью и это нормальный непрерывный процесс. В крови здорового человека кетоновые тела содержаться в очень небольшом количестве – 0,03 – 0,2 ммоль/л. Выделение кетоновых тел с мочой не превышает 20 – 50 мг/сут. Этот уровень кетоновых тел в моче обычными клиническими методами не обнаруживается. Они
являются патологическими компонентами мочи. Начальный этап синтеза
кетоновых тел аналогичен биосинтезу ХС.
1.Реакция – конденсации, катализирует процесс фермент – трансфераза. В
результате слияния двух молекул ацетил-КоА образуется ацетоацетил-КоА.
2.Реакция конденсации, катализирует процесс фермент – ГМГ-КоА-
синтетаза. В ходе реакции ацетоацетил-КоА конденсируется с ацетил-КоА и Н2О с образованием ГМГ-КоА.
3. Реакция расщепления, катализирует реакцию фермент – ГМГ-КоА-лиаза. В
ходе реакции ГМГ-КоА расщепляется на ацетоацетат и ацетил-КоА. Ацетил-
КоА включается в ЦТК.
Судьба ацетоацетата
1. Может подвергаться восстановлению с образованием β-гидроксибутирата.
Фермент β-гидроксибутиратдегидрогеназа (кофактор – НАДН++Н+), реакция обратимая.
2. Спонтанное декарбоксилирование с образованием ацетона.

СН3 – СО ~SКоА |
СН3 – СО ~SКоА |
НSКоА |
1: р-я конденсации |
трансфераза
СН3 – СО ~ СН2 – СО ~SКоА
АцетоацетилSКоА
АцетилSКоА Н2О
НSКоА
2: р-я конденсации ГМГ-КоА-синтетаза
ГМГ-КоА
3: р-я расщепления ГМГ-КоА-лиаза
СН3 – СО - СН2 – СООН |
|
СН3 – СО ~SКоА |
|
Ацетоацетат |
|
|
ацетил-SКоА |
НАДН+Н+ |
НАДН+Н+ |
|
|
|
Восстановление |
СО2 |
|
НАД+ |
НАД+ |
спонтанное декарбоксилирование |
|
β-гидроксибутират-ДГ |
|
|
|
СН3 – СН - СН2 – СООН |
|
СН3 – С – СН3 |
|
│ |
|
|
║ |
ОН |
|
|
О |
β-гидроксибутират |
|
ацетон |
|
Схема синтеза кетоновых тел
Окисление кетоновых тел
Кетоновые тела печенью не утилизируются, так как в ней отсутствует фермент – ацетил-КoA-трансфераза. Кетоновые тела из печени поступают в кровь и транспортируются к клеткам периферических тканей, где используются в качестве энергетических субстратов. Клетками миокарда,
мышечной ткани, коркового слоя почек кетоновые тела используются предпочтительнее, чем свободная глюкоза или жирные кислоты. При длительном голодании кетоновые тела используются в качестве энергетического субстрата и клетками ЦНС.
β-гидроксибутират окисляется до ацетоацетата. Катализирует процесс фермент β-гидроксибутиратдегидрогеназа, кофермент - НАД+. В ходе реакции образуется НАДН++Н+, из которого при окислении в дыхательной цепи синтезируется 3 молекулы АТФ.
Ацетоацетат превращается до ацетоацетил-SКоА по двум путям (идет активация ацетоацетата):
1 путь катализируется ферментом ацетоацетил-KoA-синтетазой.с затратой 1
молекулы АТФ и КоАSН с образованием ацетоацетил-КоА, АМФ и 2ФН.
2 путь катализируется ферментом трансферазой с затратой 1 молекулы ГТФ и сукцинил-КоА с образованием ГДФ, сукцината и ацетоацетил-SKoA.
Ацетоацетил-KoA под действием тиолазы при участии KoASН превращается в две молекулы ацетил-KoA, которые включаются в ЦТК и обеспечивают синтез 24 молекул АТФ (1 молекула ацетил-KoA обеспечивает синтез 12
молекул АТФ).

Обмен кетоновых тел
Окисление кетоновых тел
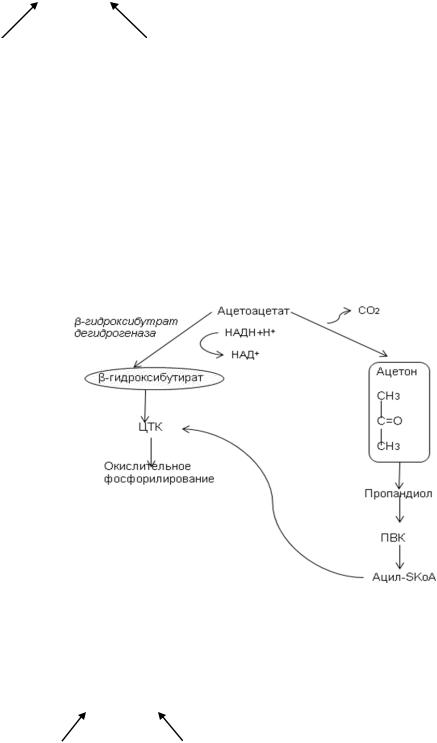
Энергетический эффект окисления β-гидроксибутирата:
3 АТФ + 24 АТФ – 1 АТФ (затрачивается на активацию) = 26 АТФ
НАДН+Н+ 2 молекулы ацетил-SКоА
Помимо этого, ацетоацетат может восстанавливаться в β-гидроксибутират
(фермент - β-гидроксибутиратдегидрогеназа, кофактор НАДН++Н+). Это обратимая реакция. Ацетоацетат также может подвергаться нефементативному декарбоксилированию с образованием ацетона. Ацетон затем превращается в пропандиол, из которого синтезируется ПВК. Из ПВК в ходе окислительного декарбоксилирования образуется ацетилSKoA,
который включается в ЦТК.
Метаболизм ацетоацетата в мозговой ткани при голодании.
Энергетический эффект окисления ацетоацетата: 3 АТФ + 12 АТФ = 15 АТФ
НАДН+Н+ 2 ацетилSКоА
(окислительное декарбоксилирование ПВК).
Регуляция обмена кетоновых тел
Первый пункт координации кетогенеза – это уровень свободных жирных кислот в крови. Источником ВЖК является липолиз ТАГ в жировой ткани.
Печень захватывает 30% ВЖК, циркулирующих в крови, в результате чего повышается их концентрация в печёночной ткани. Это приводит к блокированию биосинтеза жирных кислот за счёт ингибирования ацетил- KoA-карбоксилазы (регуляторный фермент биосинтеза ЖК), а значит, и
снижению уровня малонил-KoA.
Второй пункт координации кетогенеза – митохондриальная ацил-карнитин транспортная система (перенос ацил-КоА в матрикс митохондрий).
Регулируемым ферментом данной системы является ацил-
карнитинтрансфераза I, а его отрицательным модулятором является малонилKoA. Снижение концентрации малонил-KoA снимает блок с ацил-
карнитинтрансферазы I и ацил-КоА поступает в матрикс митохондрий, где подвергается β-окислению с образованием большого количества ацетил-KoA.
Третий пункт координации кетогенеза – скорость ЦТК, которую регулирует фермент цитратсинтаза. Для осуществления ЦТК необходима высокая концентрация оксалоацетата (ОАА). При дефиците углеводов (глюкозы)
уровень ОАА уменьшается, так как он является субстратом глюконеогенеза.
В условиях дефицита ОАА уменьшается скорость синтеза цитрата, что приводит к накоплению ацетил-KoA. В матриксе митохондрий ацетил-KoA
используется в синтезе кетоновых тел. Поэтому можно сказать, что «жиры сгорают в пламени углеводов».
Печень не использует кетоновые тела, т.к. в ней отсутствуют ферменты их утилизации. Поэтому кетоновые тела поступают в кровь и транспортируются к органам и тканям, которые используют их в качестве энергетических субстратов. Сердечная мышца и корковый слой почек предпочтительно используют в качестве энергетического субстрата ацетоацетат, а не глюкозу.
В противоположность этому глюкоза является главным субстратом окисления для мозга у лиц, получающих сбалансированную пищу. При голодании и диабете мозг адаптируется к кетоновым телам.
Кетонемия – это повышение уровня кетоновых тел в крови. При патологических состояниях (сахарный диабет, голодание) концентрация
кетоновых тел в сыворотке крови увеличивается до 16-20 ммоль/л (в норме
0,03-0,2 ммоль/л). Кетонемия может привести к нарушению КОС крови. В
результате развивается кетоацидоз (метаболический ацидоз). 90% β-
гидроксибутирата находится в ионизированном состоянии. Следовательно,
увеличивается количество Н+ (протонов). В результате снижается рН крови:
СН3 – СН – СН2 – СООН ↔ СН3 – СН – СН2 – СОО- + Н+
│ |
│ |
ОН |
ОН |
Кетонурия – это появление кетоновых тел в моче. Кетоновые тела относятся к патологическим компонентам мочи.
Для коррекции кетоацидоза организм запускает защитные механизмы.
Первая линия защиты КОС – буферные системы крови
1. Бикарбонатная буферная система: [НСО3]/[CO2] = 20/1; Н+ + НСО3 →Н2СО3
Следовательно, увеличивается парциальное давление СО2.
Следующая система, которая начинает работать, это:
1.Гемоглобиновая буферная система:
СО2
Эритроцит СО2 + Н2О → Н2СО3
эффект
Н2СО3 + НbО2- Бора О2 + ННb + НСО3-
в кровь
Буферные системы крови
Второй линией защиты являются лёгкие и почки.
Через лёгкие удаляется избыток СО2. В почках повышается реабсорбция бикарбоната и кислые продукты – кетоновые тела - выводятся с мочой. 50%
кетоновых тел удаляется в молекулярном виде (сами протонируются),
остальные 50% удаляется в комплексе с щелочными металлами (Na+, K+).
В результате в организме усиливается синтез NH3, который играет роль
«оберегающего компонента», сберегая Na+, K+:
Глутамин + Н2О→ глутаминовая кислота + NH3.
Причина кетозов – дефицит углеводов. При недостатке углеводов усиливается липолиз ТАГ в адипоцитах и в кровь поступают СЖК, 30%
которых захватывает печень. Повышенное количество жирных кислот усиливает кетогенез. Различают непатологические и патологические кетозы.
Непатологические кетозы возникают при углеводном голодании и при усиленной физической нагрузке.
Патологические кетозы возникают при тяжёлых формах сахарного диабета,
так как снижается поступление глюкозы в органы и ткани.
Гиперинсулинизм приводит к тканевому углеводному голоданию и кетозу.
При дефиците глюкокортикоидов, например, кортизола (стероидный диабет),
снижается скорость глюконеогенеза и возрастает чувствительность клеток к инсулину, что может привести к гипогликемии и кетозу.
При мочекислом диатезе у детей отмечается гиперурикемия (повышение уровня мочевой кислоты), которая сопровождается гипокалиемией,
кетонемией и кетонурией. Этот эффект можно объяснить тем, что мочевая кислота в адипоцитах ингибирует аденилатциклазу и нарушает передачу гормонального сигнала глюкагона и, как следствие, развивается гипогликемия и кетоз.
