
ФХ лр37
.pdf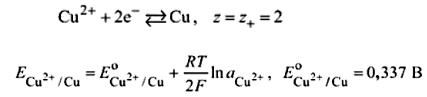
Работа №37
Определение термодинамических функций реакций, протекающих в окислительно-восстановительных элементах
Цель работы: ознакомиться с методикой составления гальванических элементов, содержащих окислительно-восстановительные электроды, изучить влияние температуры на ЭДС элемента, а также рассчитать изменения термодинамических функций в процессе протекания электрохимической реакции.
Литература: Практикум 1986, с.286-296, 310-313; метод. пособие 4724, А.М. Мерецкий, В.В. Белик, Основы электрохимической термодинамики. - М., 2011, с. 15-27, 54-62, 67-90, 145-148; метод. пособие Балицкий В.Н. Равновесные электрохимические процессы в гальванических элементах. -М., 1997, пособие 3931, с.1-19 (лаб.работа 4).
Теоретическая часть
Проводниками 1-го рода являются металлы в твердом и расплавленном состоянии, сульфиды и карбиды ряда металлов, графит. В таких проводниках перенос электричества осуществляется за счет движения электронов (электронная проводимость).
Проводники 2-го родя (электролиты) – химические соединения, которые находясь в твердом, растворенном или расплавленном состоянии проводят электрический ток. Носителями тока выступают ионы вещества – катионы и анионы (ионная проводимость).
Электродом (полуэлементом) называется электрохимическая система, включающая как минимум две контактирующие проводящие фазы, одна из которых является металлом (проводником 1-го рода), полупроводником или ионной мембраной, а другая - раствором или расплавом электролита (проводником 2-го рода).
Под обтатимыми электродами понимают электроды, на которых при изменении направления электрического поля (тока) на противоположное протекает та же самая по химической природе электродная полуреакция, но в обратном направлении.
Обратимый электрод 1-го рода - электрохимическая система, состоящая из металла (неметалла), помещенного в раствор, содержащий ионы того же металла (неметалла).
Электрод, обратимый по катиону:  электродная полуреакция:
электродная полуреакция:
уравнение Нернста:

Электрод, обратимый по аниону: электродная полуреакция:
уравнение Нернста:
Электроды 2-го рода представляют собой металлическую пластинку, покрытую слоем малорастворимого соединения этого металла и помещенную в раствор электролита, который содержит анионы, одноименные с анионом малорастворимого соединения.
Хлорсеребрянный электрод: электродная полуреакция:
уравнение Нернста:
Газовые электроды состоят из металлического проводника, который контактирует одновременно и с электрохимически активным газм, пропускаемым через раствор электролита, и с самим раствором, содержащим ионы, природа которых соответствует продуктам окисления или восстановления этого газа на электроде
Водородный электрод: 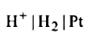 электродная полуреакция:
электродная полуреакция:
уравнение Нернста:
Окислительно-восстановительные электроды представляют собой инертный проводящий материал, погруженный в раствор, содержащий окисленную и восстановленную форму одного и того же элемента.
Элетрод: 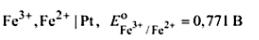 электродная полуреакция:
электродная полуреакция:
уравнение Нернста:
Гальваническим элементом называют электрохимическую систему,

которая вырабатывает электрическую энергию в результате самопроизвольно происходящих в ней химических превращений.
Электродный потенциал – ЭДС электрохимической цепи, составленной из электрода в сравнении.
Стандартный электродный потенциал – ЭДС электрохимической цепи, составленной из стандартного водородного электрода (слева) и исследуемого электрода (справа) при активности потенциалопределяющих веществ раной единице.
Термодинамические функции химической энергии:
Энергия Гиббса
,
где Е – электродвижущая сила гальванического элемента, z – число электронов, участвующих в элементарном акте электрохимической реакции, F – константа (число) Фарадея.
При положительной ЭДС элемента ( |
изменение энергии Гиббса |
|||||
реакции, протекающей в гальваническом элемента, |
||||||
|
Изменение энтропии |
|
||||
где ( |
|
|
) |
( |
|
) |
|
|
|
||||
|
|
температурный коэффициент ЭДС. |
||||
|
|
|||||
|
Изменение энтальпии |
|
||||
|
|
|
|
|
|
, |
где Т – температура протекания электрохимической реакции Электрохимическая форма уравнения Гиббса-Гельмгольца:
( )

Задача
В гальваническом элементе обратимо протекает реакция:
ЭДС этого гальванического элемента зависит от температуры по уравнению:
1.Напишите уравнения реакций, протекающих на электродах.
2.Приведите условную запись элемента и определите тип каждого электрода элемента.
3.Рассчитайте ЭДС элемента при температуре 70оС.
4.Определите изменение энергии Гиббса ΔG, изменение энтропии ΔS, изменение энтальпии ΔH и выделяющуюся или поглощающуюся теплоту Q для процесса, протекающего в гальваническом элементе при температуре 298К.
5.Сравните рассчитанные в п. 4 изменения термодинамических функций с табличными данными, используя табл. 44 (А. А. Равдель. Краткий справочник физико-химических величин.)
|
|
|
|
Решение |
|
1) |
На катоде: |
|
̅ |
|
1,36B |
|
|
||||
|
ноде |
|
|
̅ |
0,222B |
2) |
| | |
| | |
| |
|
|
электрод газовый второго электрод рода
3)При температуре 343К:
4)При температуре 298К
|
|
|
|
|
ж |
к ж |
( |
|
) |
|
В/К |
|
|
|
|
|
||||
( |
|
) |
Дж/К |
|
||
|
|
|||||
|
|
|
|
|
ж |
к ж |
|
|
|
|
ж |
к ж |
|
|
|
происходит нагрев элемента |
|
|
||

5) По справочным данным при температуре 298К
* |
к ж |
+ |
|
0 |
0 |
-126,78 |
|
|
||||
|
|
|
|
|
|
|||||||
|
мол |
|
|
|
|
|
|
|
||||
* |
|
|
ж |
|
+ |
42,55 |
222,98 |
96,23 |
|
|
||
мол |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||
* |
к ж |
+ |
|
0 |
0 |
-109,54 |
|
|
||||
мол |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
к ж |
|
|
|
( |
к ж) |
|||
|
|
|
|
|
|
|
|
|
|
ж |
( |
Дж/К) |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
кДж |
|
|
|
( |
к ж) |
|||
Как видим, различия между рассчитанными значениями и справочными данными несущественны
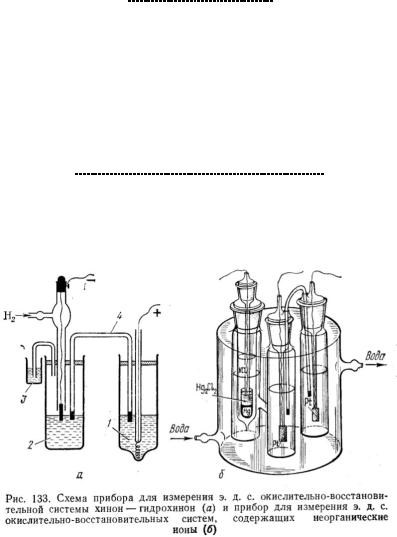
Экспериментальная часть
Задание на работу Изучить зависимость ЭДС от температуры.
По полученной зависимости рассчитать термодинамические функции реакций окисления-восстановления.
Гальванический эемент: |
|
|
||
|
| |
‖ |
| |
0,420 В |
|
|
Порядок выполнения р боты |
|
|
1. |
Собр т |
г л в нический элемент |
|
|
2. |
Собр т |
уст новку для измерения э д с |
|
|
3.Составить рабочий электролит из растворов, содержащих ионы различных степеней окисления, в равных объемных соотношениях.
4.Подкислить растворы H2SO4 с расчетом, чтобы электролитический ключ был заполнен кислотой.
5.Измерения потенциала проводить до постоянного его значения.
6.Растворы налить в термостатированную ячейку, погрузить платиновые электроды и присоединить элемент к потенциометрической измерительной схеме
7.Измерения ЭДС производить после установления температуры через каждые 15-20 минут до тех пор, пока четыре последующих измерения не покажут значения, совпадающие в пределах 0,5 мВ.
8.Далее произвести расчет
Обработка экспериментальных данных
T , K |
|
E, B |
|
E T |
p |
, B K |
|
r S , Дж K |
|
rG , |
кДж |
|
|
|
|
||||||||
|
|
|
|
|
|
||||||
288 |
|
0,413 |
|
-0,0006 |
|
-115,8 |
|
-79,709 |
|||
295 |
|
0,409 |
|
-0,0006 |
|
- |
|
- |
|
||
301 |
|
0,404 |
|
-0,0006 |
|
- |
|
- |
|
||
309 |
|
0,401 |
|
-0,0006 |
|
- |
|
- |
|
||
315 |
|
0,396 |
|
-0,0006 |
|
- |
|
- |
|
||
323 |
|
0,392 |
|
-0,0006 |
|
-115,8 |
|
-75,656 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
1. Гальванический элемент:
r H , кДж
-113,059
-
-
-
-
-113,059
| |
‖ |
| |
0,420 В |
2.Уравнения электрохимических реакций (полуреакций), протекающих на электродах:
На аноде (окисление): |
|
̅ |
1,19B |
к тоде восст новление |
̅ |
|
1,61B |
Уравнение Нернста:
3.Уравнение суммарной реакции, протекающей в элементе:
4.Уравнение Нернста для расчѐта ЭДС элемента:
5.Построим график зависимости E f (T ) , на основании которого
определим величину и знак температурного коэффициента ЭДС.
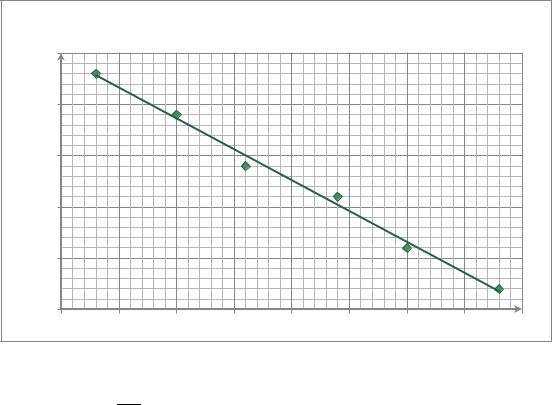
Е, В |
|
График зависимости E=f(T) |
|
|
||||
|
|
|
|
|
|
|
|
|
0,415 |
|
|
|
|
|
|
|
|
0,41 |
|
|
|
|
|
y = -0,0006x + 0,5865 |
||
|
|
|
|
|
|
|
|
|
0,405 |
|
|
|
|
|
|
|
|
0,4 |
|
|
|
|
|
|
|
|
0,395 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T,К |
0,39 |
|
|
|
|
|
|
|
|
285 |
290 |
295 |
300 |
305 |
310 |
315 |
320 |
325 |
Из данного графика температурнй коэффициент: |
|
|
|
|||||
( )
Как видим ( |
|
) |
, поэтому с ростом температуры величина ЭДС |
|
|||
понижается. |
|
||
6.Рассчитаем изменения термодинамических функций ( rS, rG, rН) для электрохимической реакции при различных температурах.
При Т = 288К
|
|
ж |
к ж |
( |
|
) |
Дж/К |
|
ж |
к ж |
При Т = 323К
|
|
ж |
к ж |
( |
|
) |
Дж/К |
|
ж |
к ж |
При Т = 298К
о |
|
|
ж |
к ж |
|
|
|
||
о |
( |
|
) |
Дж/К |
|
|
|||
о |
о |
о |
ж |
|
|
|
|
|
|
|
|
|
|
к ж |

7.Рассчитаем константу химического равновесия реакции по данным о стандартных электродных потенциалах при 298 K.
о
о
о
Вывод:
В ходе данной лабораторной работы мы познакомились с методикой составления гальванических элементов, содержащих окислительновосстановительные электроды на примере:
| |
‖ |
| |
Так же изучили влияние температуры на ЭДС элемента:
температурнй коэффициент: ( |
|
) |
, поэтому с ростом |
|
температуры величина ЭДС понижается. Рассчитаны:
изменения термодинамических функций в процессе протекания электрохимической реакции:
И определили, что реакция экзотермическая (т.к. же отрицательна r S <0.
константа химического равновесия реакции при
|
H |
r |
|
298
<0 ). Энтропия так
K:
