
ФХ лр8
.pdfРабота №8
Определение давления насыщенного пара индивидуальных жидкостей динамическим методом (методом точек кипения).
Цель работы: методом точек кипения определить давление насыщенного пара индивидуальных жидкостей. Изучить графические зависимости и рассчитать термодинамические константы.
Литература: "Фазовое равновесие в одно-, двух- и трехкомпонентных системах" (№ 4468), Изд. РХТУ, 2007, с.5-13 и Практикум 1986, с.153-158, 160-162 (работа 2)
Теоретическая часть
Гетерогенными фазовыми равновесиями называются равновесия, устанавливающиеся в физических процессах перехода веществ из одной фазы в другую. Любая гетерогенная система характеризуется определенным числом фаз, компонентов и числом степеней свободы.
Каждое вещество, которое может быть выделено из системы и существовать вне ее, называется составляющей системы. Вещества, концентрации которых определяют состав фаз данной равновесной системы, называется независимыми составляющими или компонентами системы.
Фазой системы называется совокупность всех гомогенных частей системы, имеющих одинаковые физические, химические свойства и отделенных от других частей системы видимыми границами (поверхностью) раздела.
Термодинамическая степень свободы – независимые термодинамические параметры, которые можно изменять в определенных пределах без изменения числа и природы фаз равновесной системы.
Условием равновесия в гетерогенной системе является равенство во всех фазах температуры, давления и химических потенциалов каждого компонента.
Правило фаз Гиббса: |
f = k – n + 2, |
где n – максимальное число фаз; k – количество компонентов; f – число термодинамических степеней свободы.
Метод физико-химического анализа: заключается в изучении зависимости численных значений физических свойств системы от ее химического состава и выражения результатов в графической форме – диаграмм состояния.
Данный метод основан на двух принципах:
Принцип непрерывности
Принцип соответствия

В случае однокомпонентных систем в уравнения состояния входят три переменные: температура, давление и объем. Но чаще всего в качестве независимых переменных берут температуру и давление (V=const)
Диаграмма состояния
Насыщенным паром называется пар, находящийся в равновесии с жидкостью
Температурой кипения называется температура, при которой давление насыщенного пара равно внешнему давлению
Уравнение Клапейрона-Клаузиуса - описывает термодинамику равновесных фазовых переходов
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
где |
– теплота фазового перехода, |
– изменение объема при |
|
|||
фазовом переходе. |
|
|
||||
Допущения для решения данного уравнения: |
|
|||||
|
Теплота испарения не зависит от температуры кипения ( |
) |
||||
Объем пара много больше объема жидкости (тогда |
) |
|||||
|
Пар подчиняется уравнению состояния идеальных газов (pV=RT) |
|
||||
Получаем уравнение Клапейрона-Клаузиуса в виде:
После интегрирования: |
|
|
|
|
|
|
|
|||||||
|
|
или |
|
|
, где |
|
, |
|||||||
|
|
|
|
|||||||||||
После определенного интегрирования: |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задача |
По зависимости давления насыщенного пара от температуры для |
||
бромбензола C6H5Br (справочник под ред. Равделя 1983г, с. 34) |
||
1. |
Постройте график |
(логарифм давления от обратной |
|
абсолютной температуры). |
|
2. |
Рассчитайте значения коэффициентов a и b в эмпирическом уравнении |
|
|
прямой |
. |
3.Определите среднюю теплоту испарения бромбензола.
4.Определите изменение энтропии при испарении 1 моля бромбензола при нормальной температуре кипения.
5.Рассчитайте эбуллиоскопическую константу бромбензола.
Решение
1)Построим график зависимости давления насыщенного пара от
температуры для бромбензола C6H5Br
Сводная таблица (из справочника под ред. Равделя 1983г)
p,Па |
|
T, К |
|
lgp |
(1/T)*103 |
133 |
276,05 |
|
2,124 |
|
3,623 |
667 |
300,95 |
|
2,824 |
|
3,323 |
1333 |
313,15 |
|
3,125 |
|
3,193 |
2666 |
326,95 |
|
3,426 |
|
3,059 |
5333 |
341,75 |
|
3,727 |
|
2,926 |
7999 |
351,25 |
|
3,903 |
|
2,847 |
13330 |
363,95 |
|
4,125 |
|
2,748 |
26660 |
383,25 |
|
4,426 |
|
2,609 |
53330 |
405,45 |
|
4,727 |
|
2,466 |
101320 |
429,35 |
|
5,006 |
|
2,329 |

График зависимости = (1/ )
6
5 |
|
|
|
|
4 |
|
|
|
|
3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
1/ |
1 |
|
|
|
|
0,002 |
0,0025 |
0,003 |
0,0035 |
0,004 |
2)Рассчитаем значения коэффициентов a и b в эмпирическом уравнении прямой
Получаем:
3) Определим среднюю теплоту испарения бромбензола:
или
Откуда
4)Определим изменение энтропии при испарении 1 моля бромбензола при нормальной температуре кипения:
Н.у.
5) Рассчитаем эбуллиоскопическую константу бромбензола:

Ответ:
Экспериментальная часть
Задание на работу 1) Определение констант уравнения вида: = + / ;
2)Расчет нормальной температуры кипения;
3)Определение среднего значения энтальпии парообразования;
4)Расчет энтропии парообразования при нормальной температуре кипения.
Порядок выполнения работы
1.Исследуемую жидкость (75-100мл) налить в сосуд 3. Для устранения местных перегревов и облегчения образования новой фазы поместить
несколько кусочков активированного угля.
2.Сосуд погрузить в термостат.
3.Первое измерение провести при комнатной температуре
4.Дальнейшие измерения производить, повышая каждый раз температуру на 4-6о.
Обработка экспериментальных данных
Амиловый спирт С5Н11ОН
№ |
Температура |
Т, К |
(1/Т)*10 |
3 |
p, мм Hg |
р, Па |
lgp |
п/п |
кипения, tоС |
|
|||||
1 |
44,9 |
318,05 |
3,144 |
|
10 |
1333,22 |
3,125 |
2 |
55,8 |
328,95 |
3,04 |
|
20 |
2666,44 |
3,426 |
3 |
68 |
341,15 |
2,931 |
|
40 |
5332,88 |
3,727 |
4 |
75,5 |
348,65 |
2,868 |
|
60 |
7999,32 |
3,903 |
5 |
85,8 |
358,95 |
2,786 |
|
100 |
13332,2 |
4,125 |
6 |
102 |
375,15 |
2,666 |
|
200 |
26664,4 |
4,426 |
7 |
119,8 |
392,95 |
2,545 |
|
400 |
53328,8 |
4,727 |
1) |
Определим среднюю теплоту испарения амилового спирта: |
|
|||||

5 |
График зависимости lg=f(1/T) |
|
|
|
|
lgp |
|
|
4,5 |
|
y = -2672,1x + 11,55 |
|
|
|
4 |
|
|
3,5 |
|
|
3 |
|
1/T |
|
|
|
0,0024 |
0,0029 |
0,0034 |
Из графика получаем |
|
|
или
Откуда
2)Определим значения коэффициентов А и В в эмпирическом уравнении прямой
Из графика получаем уравнение, описывающее линейную зависимость
Тогда Получаем , где давление выражено в Па, а
температура в К.
3)Определим температуру кипения жидкости при атмосферном давлении.
Откуда |
|
или Т = 135,15оС |
|
(в справочнике Т = 137,8оС )
4)
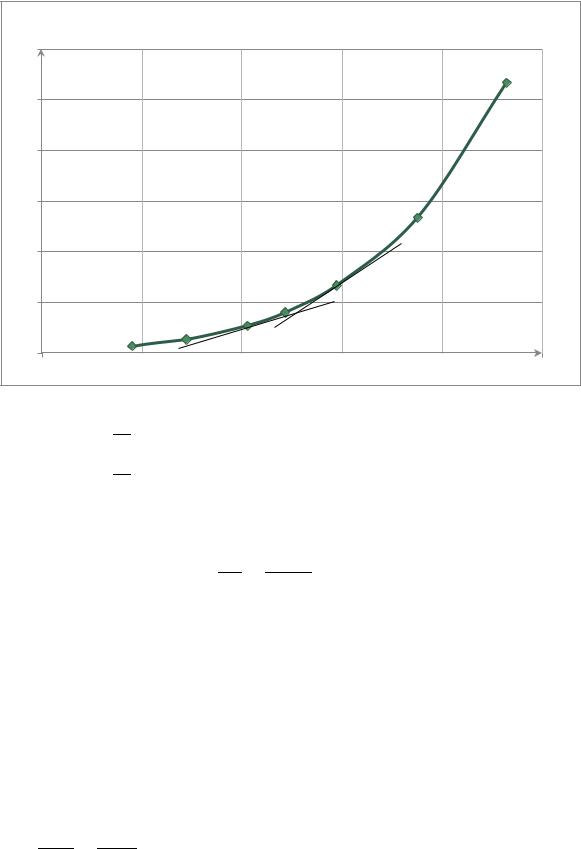
|
График зависимости р=f(Т) |
6 |
|
р*10-5, Па |
|
5 |
|
4 |
|
3 |
|
2 |
|
1 |
|
|
Т,К |
0 |
|
300 |
400 |
Из данного графика: |
|
При
При
По уравнению Клапейрона-Клаузиуса определим истинную теплоту испарения жидкости при определѐнной температуре:
Откуда |
|
|
|
|
|
|
|
||
При |
|
Дж/моль |
||
При |
|
Дж/моль |
||
Таким образом, при увеличении температуры значение |
так же |
|||
увеличивается. |
|
|
||
5) Определим изменение энтропии |
при нормальной температуре |
|||
кипения: |
|
|
||
Вывод:
В данной лабораторной работе была изучена зависимость давления амилового спирта С5Н11ОН от температуры динамическим методом (или

методом точек кипения).
Определили линейную графическую зависимость
,где давление выражено в Па, а температура в К.
По этой зависимости нашли среднюю теплоту испарения амилового спирта
Так же определили температуру кипения жидкости при атмосферном
давлении. Она составила или Т = 135,15оС. Различие со справочными данными (Т = 137,8оС ) не существенны.
Подтвердили, что при повышении температуры значение теплоты испарения так же увеличивается.
Рассчитали значение изменения энтропии при нормальной температуре кипения:
