
ФХ лр10
.pdf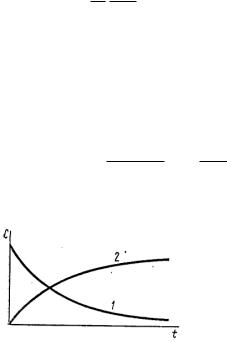
Работа №10
Изучение скорости разложения пероксида водорода газометрическим методом.
Цель работы: изучить реакцию разложения пероксида водорода, газометрическим методом определить константу скорости реакции. Используя результаты расчета и графические зависимости определить, протекает ли данная реакция по первому порядку.
Литература: Практикум 1986, с.319-324, 328-333, 339-340, 354-356 или Практикум 1974, с.322-346, 365-367.
Теоретическая часть
Скорость химической реакции определяется изменением количества данного компонента в единицу времени в единице объема:
|
|
1 |
dn |
i 0 |
|
|
|||
i |
|
V d |
||
|
|
|||
где n-число молей данного компонента в объеме V данной фазы в момент времени t.
Если объем величина постоянная, то скорость определяется изменением концентрации реагирующего вещества за единицу времени:
V const : |
|
d n |
i |
/ V |
|
d c |
i |
|
|
|
|||||
i |
|
d |
|
d |
|||
|
|
|
|||||
Скорость реакции всегда положительна.
Кинетические кривые для исходных веществ(1) и продуктов реакции(2)
Основной постулат химической кинетики:
скорость реакции в каждый момент времени пропорциональна произведению возведенных в некоторую степень концентраций реагирующих веществ (закон действующих масс).
|
А |
А |
B |
B |
D |
D ... продукты, |
||
|
|
|
|
|
||||
|
|
|
|
d ci |
kcAp cBq cDr |
|||
|
|
|
|
|||||
|
|
|
|
|
i d |
|
||
Коэффициент пропорциональности k называется константой скорости химической реакции. Ее физический смысл: константа скорости равняется
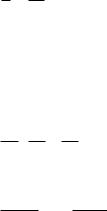
скорости реакции при единичной концентрации, поэтому ее называют также удельной скоростью реакции.
k (c |
1) |
i |
|
Величина константы зависит от всех факторов, которые влияют на скорость химической реакции, за исключением изменения концентрации реагирующих веществ. Числовое значение зависит так же от выбора единиц времени и концентрации. Размерность определяется тем кинетическим уравнением, по которому производится ее расчет, т.е. зависит от порядка реакции
Порядок реакции является эмпирической величиной. Частным называется порядок, характеризующийся изменением концентрации одного из веществ, вступающих в реакцию. Чтобы определить порядок по данному веществу, необходимо создать такие условия, чтобы в процессе реакции изменялась концентрация только данного вещества. Для этого концентрации всех остальных участников должны быть взяты в большом избытке. Сумма частных порядков дает общий порядок реакции.
Молекулярность реакции определяется числом частиц, участвующих в одном элементарном акте химического превращения.
Период полупревращения-это время, за которое исходная концентрация реагента уменьшится в 2 раза. Измерение периода полупревращения приносит большую пользу при исследованиях порядка реакции.
Математические выражения для расчета констант скорости реакций: 1. Необратимые реакции 1-го порядка
k1 ln c0
c
, k, с 1
2. Необратимые реакции 2-го порядка
|
1 |
|
1 |
|
1 |
|
|
1 |
|
x |
|
л |
|||
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
, k, |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
с |
|
|
|
|
c0 c0 x |
|
с моль |
|||||
|
|
|
с0 |
|
|
||||||||||
3. Необратимые реакции 3-го порядка
k |
1 |
|
1 |
|
|
|
|
2 |
|
|
2 |
|
c |
|
|
|
|
||
|
|
|
|
|
|
1 |
||
c |
2 |
||
|
|||
|
0 |
||
|
|
||
, k, |
л2 |
моль2 с |
4. Необратимые реакции нулевого порядка
k
c |
0 |
c |
|
|
|
|
|
|
,
k, |
моль |
|
л с |
||
|
Где с0– начальная концентрация исходных веществ, с – концентрация после протекания реакции, t – время, х – концентрация прореагировавшего вещества за промежуток времени
Методы определения порядка реакции 1. Интегральные методы определения порядка реакции
а) метод подбора уравнения
1)аналитический – суть метода состоит в подстановке ci реагирующего
вещества для различных моментов времени от начала реакции в кинетические уравнения различных порядков (1го, 2го , 3го и т.д ). Искомым является тот порядок, для которого наблюдается постоянство (неизменность) значения константы скорости реакции при различных концентрациях
2)графический – состоит в нахождении такой функции концентрации от времени, которая имела бы линейный характер:
1 порядок -
2 порядок -
3 порядок -
0 порядок -
lnc k const lnc0 |
, |
|||
1/ c k const 1/ c0 , |
|
, |
||
1/ c |
2 |
2 |
||
|
2k const 1/ c0 |
|
||
с k c0 .
б) метод Оствальда-Нойеса – использует зависимость
|
lg |
/ |
|
|
|
n |
1/ 2 |
1/ 2 |
1 |
||
lg c |
|
/ c |
|
||
|
0,2 |
0,1 |
|
||
|
|
|
|
||
1
2
f
c |
0 |
|
:
3. Дифференциальные методы Вант-Гоффа а) Аналитический метод – по двум значениям
dc d
при двух
c
1) по одной кинетической кривой – временной порядок
|
|
|
dc |
|
|
dc |
||
|
lg |
|
|
|
lg |
|
|
|
|
|
|
||||||
n |
|
|
d 1 |
|
|
d 2 |
||
|
|
lg c1 |
lg c2 |
|
|
|||
|
|
|
|
|
||||
2) по 2ум начальным концентрациям – концентрационный порядок
|
|
|
dc |
|
|
|
dc |
|
|
lg |
|
|
lg |
|
|||
n |
|
|
d |
0,1 |
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
lg c |
0,1 |
lg c |
0,2 |
||
|
|
|
|
|
|
|||
0,2
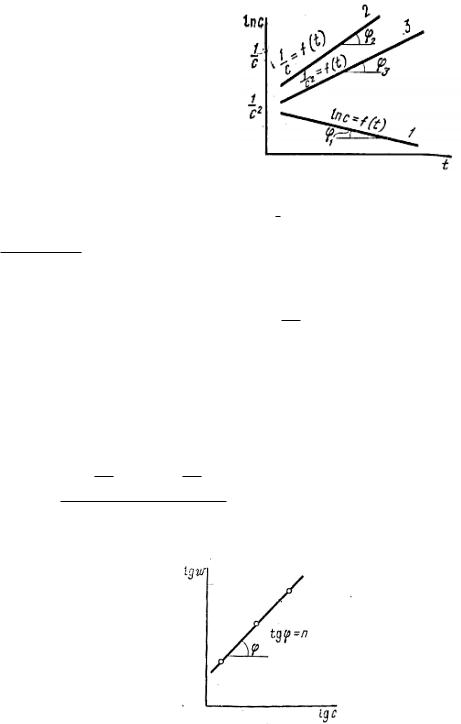
б) Графический вариант метода Вант-Гоффа
lg lg k n lg c
tg n
Задача
Кинетику реакции разложения N2O5 в жидком CCL4 изучали при температуре 42оС газоволюметрическим методом. Результаты измерений объемов кислорода, выделившегося в разные моменты времени, представлены в таблице:
t, |
5 |
10 |
15 |
20 |
30 |
40 |
60 |
80 |
100 |
∞ |
мин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VO2, |
12,45 |
23,8 |
34,15 |
43,5 |
59,85 |
73,3 |
93,7 |
107,7 |
117,7 |
138,1 |
мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Графическим вариантом дифференциального метода Вант-Гоффа определить порядок химической реакции: N2O5= N2O4 + ½ O2
Рассчитать среднюю аналитическую константу скорости реакции и период полупревращения исходного вещества при указанной температуре.
Решение.
Определим порядок реакции графическим методом. Для этого построим
график зависимости |
|
. По нему определим скорость реакции в |
определенный момент времени: |
. Далее построим график |
|
зависимости: |
, где |
|
, |
|
, где |
|
мл |
|
|
|
|
|
|
|
|
|
t, мин |
, мл |
|
) |
v, мл/мин |
lnv |
k, мин-1 |
|
|
|
|
|
|
|
5 |
125,65 |
4,83 |
|
- |
- |
0,01890 |
|
|
|
|
|
|
|
10 |
114,3 |
4,74 |
|
2,17 |
0,775 |
0,01892 |
|
|
|
|
|
|
|
15 |
103,95 |
4,64 |
|
1,97 |
0,678 |
0,01894 |
|
|
|
|
|
|
|
20 |
94,6 |
4,55 |
|
1,7 |
0,531 |
0,01892 |
|
|
|
|
|
|
|
30 |
78,25 |
4,36 |
|
1,49 |
0,399 |
0,01894 |
|
|
|
|
|
|
|
40 |
64,8 |
4,17 |
|
1,11 |
0,104 |
0,01892 |
|
|
|
|
|
|
|
60 |
44,4 |
3,79 |
|
0,86 |
-0,151 |
0,01891 |
|
|
|
|
|
|
|
80 |
30,4 |
3,41 |
|
0,6 |
-0,511 |
0,01892 |
|
|
|
|
|
|
|
100 |
20,4 |
3,02 |
|
- |
- |
0,01912 |
|
|
|
|
|
|
|
∆ |
2 |
, |
|
График зависимости ∆ 2= ( ). |
|
||
|
|
|
|
|
|
|
|
мл |
|
|
|
|
|
|
|
140 |
|
|
|
|
|
|
|
120 |
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
t, мин |
|
|
|
|
|
|
|
|
0 |
|
|
20 |
40 |
60 |
80 |
100 |
Из данного графика : |
|
|
При |
мл/мин |
|
При |
мл/ мин |
|
При |
мл/ мин |
|
При |
мл/ мин |
|
При |
мл/ мин |
|
При |
мл/ мин |
|
При |
мл/ мин |
|
Далее построим график зависимости: |
, по которому и |
|
определим порядок реакции: |
|
|
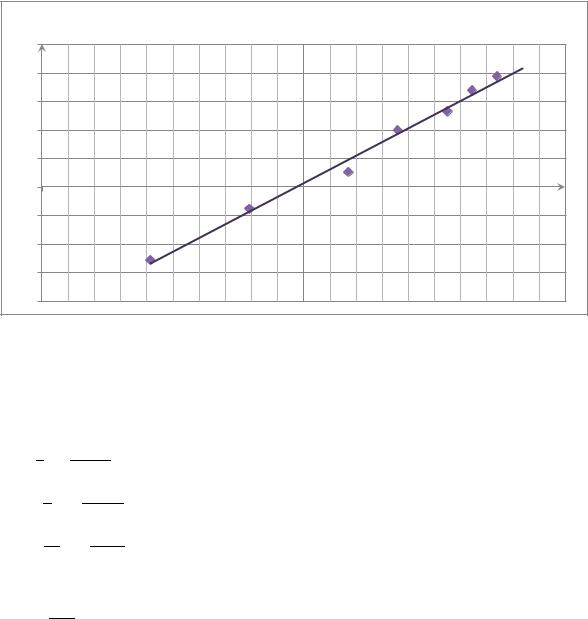
|
График зависимости: = ( ∆ |
) |
|
1 |
|
2 |
|
|
y = 0,9635x - 3,8232 |
||
|
|
||
|
|
|
|
0,8 |
|
|
|
0,6 |
|
|
|
0,4 |
|
|
|
0,2 |
|
|
∆ 2 |
|
|
|
|
0 |
|
|
|
3 |
|
4 |
5 |
-0,2 |
|
|
|
-0,4 |
|
|
|
-0,6 |
|
|
|
-0,8 |
|
|
|
Из графика |
|
. Т.е. реакция первого порядка |
|
Рассчитаем среднюю аналитическую константу скорости реакции: |
|||
|
) - |
для 1-го порядка |
|
( |
) |
мин-1 |
|
( ) мин-1
Аналогично рассчитываем для остальных значений (см. таблицу выше)
∑0,01894 мин-1
Период полупревращения исходного вещества:
⁄ |
|
|
|
мин |
|
|
|||
|
|
|
|
Ответ:
n=1, т.е. реакция N2O5= N2O4 + ½ O2 1-го порядка (доказано графическим вариантом дифференциального метода Вант-Гоффа)
0,01894 мин-1
⁄ мин
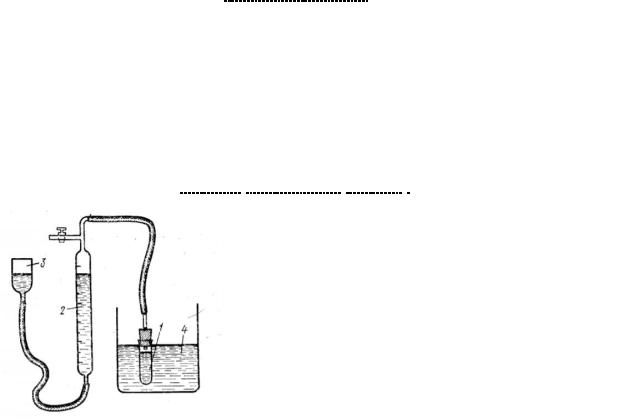
Экспериментальная часть
Задание на работу Исследовать процесс разложения пероксида водорода:
Н2О2 = Н2О + 0,5О2 Условия проведения эксперимента:
Катализатор: ионы Fe2+ , Fe3+, Cr2O72- , CrO42-, WO42-, MoO42-; CuSO4+MoO42-, CuSO4+NiSO4
Порядок выполнения работы
Схема установки для изучения скорости разложения Н2О2 газометрическим методом: 1-реакционный сосуд 2-бюретка 3-уравнительный сосуд 4-термостат
1.Термостатировать раствор катализатора
2.Влить в колбу с раствором катализатора определѐнное количество пероксида водорода.
3.Раствор тщательно размешать и поместить в предварительно термостатированный реакционный сосуд и поместить в термостат.
4.Уравнительный сосуд и бюретку наполнить подкрашенной водой и, присоединив реакционный сосуд к бюретке, проверить установку на герметичность.
Установить одинаковые уровни жидкости в бюретке и уравнительном сосуде.
Записать первое и последующие измерения с интервалом 2-5 минут.
5.После того, как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню на некоторое время. Реакция считается законченной, если уровень газа в бюретке не изменяется.
6.После полного разложения пероксида водорода реакционный сосуд охладить до температуры термостата.
7.Произвести расчет.

Обработка экспериментальных данных
№ |
t, мин |
VO2, мл |
, мл |
) |
k, мин-1 |
п/п |
|
|
|
|
|
|
|
|
|
|
|
1 |
5 |
6,4 |
60,8 |
4,108 |
0,02002 |
|
|
|
|
|
|
2 |
7 |
12,0 |
55,2 |
4,011 |
0,0281 |
|
|
|
|
|
|
3 |
9 |
17,2 |
50 |
3,912 |
0,0329 |
|
|
|
|
|
|
4 |
11 |
21,6 |
45,6 |
3,820 |
0,0353 |
|
|
|
|
|
|
5 |
13 |
25,8 |
41,4 |
3,723 |
0,0373 |
|
|
|
|
|
|
6 |
15 |
29,6 |
37,6 |
3,627 |
0,0387 |
|
|
|
|
|
|
7 |
17 |
32,8 |
34,4 |
3,538 |
0,0394 |
|
|
|
|
|
|
8 |
19 |
35,4 |
31,8 |
3,459 |
0,0394 |
|
|
|
|
|
|
9 |
21 |
37,2 |
30 |
3,401 |
0,0384 |
|
|
|
|
|
|
10 |
23 |
39,6 |
27,6 |
3,318 |
0,0387 |
|
|
|
|
|
|
11 |
25 |
42,0 |
25,2 |
3,227 |
0,0392 |
|
|
|
|
|
|
12 |
27 |
44,4 |
22,8 |
3,127 |
0,04003 |
|
|
|
|
|
|
13 |
29 |
46,2 |
21 |
3,045 |
0,0401 |
|
|
|
|
|
|
14 |
31 |
47,6 |
19,6 |
2,976 |
0,0397 |
|
|
|
|
|
|
15 |
33 |
49,4 |
17,8 |
2,879 |
0,0403 |
|
|
|
|
|
|
16 |
35 |
51,0 |
16,2 |
2,785 |
0,0406 |
|
|
|
|
|
|
17 |
37 |
52,2 |
15 |
2,708 |
0,0405 |
|
|
|
|
|
|
18 |
39 |
53,4 |
13,8 |
2,625 |
0,0406 |
|
|
|
|
|
|
19 |
41 |
54,2 |
13 |
2,565 |
0,04007 |
|
|
|
|
|
|
∞ |
∞ |
67,2 |
- |
- |
- |
|
|
|
|
|
|
Рассчитаем среднюю аналитическую константу скорости реакции:
,
где - объем кислорода, выделившийся после разложения всего Н2О2, - объем кислорода, выделившийся в момент измерения t.
( |
|
|
|
) |
|
|
|
( |
|
|
) |
мин-1 |
|
|
|
|
|
|
|
|
|||||||
( |
|
) |
|
|
( |
|
|
) |
мин-1 |
||||
|
|
|
|
|
|||||||||
|
( |
) |
( |
) |
|
мин-1 |
|
|
|
Аналогично рассчитываем для остальных значений, данные занесены в |
|||||||||
таблицу выше. |
|
|
|
|
|
|
|
|
|
Тогда получаем, |
|
∑ |
0,03733 мин-1 |
|
|
|
|||
|
|
|
|
|
|||||
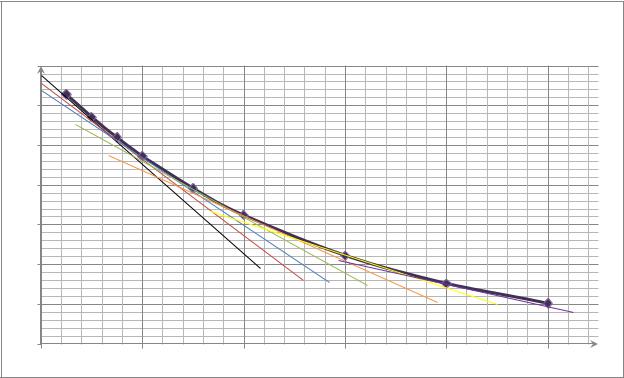
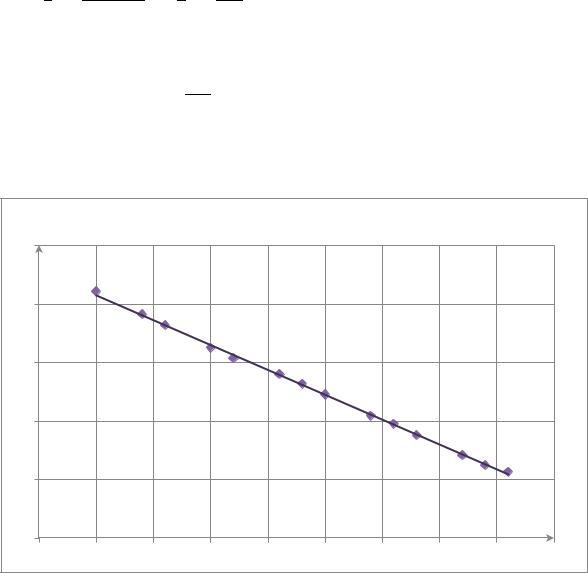
Теперь определим константу скорости графическим методом. Для этого |
|||||||||
построим график зависимости в координатах |
|
) = f(t) |
|
||||||
|
График зависимости в ( |
− ) = f(t) |
|
||||||
4,5 |
|
|
|
|
|
∞ |
|
|
|
( ∞− ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
y = -0,0428x + 4,2918 |
||
4 |
|
|
|
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
t, мин |
|
|
|
|
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
По графику |
|
|
; |
|
|
|
|
|
|
Из этого следует, что |
|
мин-1 |
|
|
|
|
|||
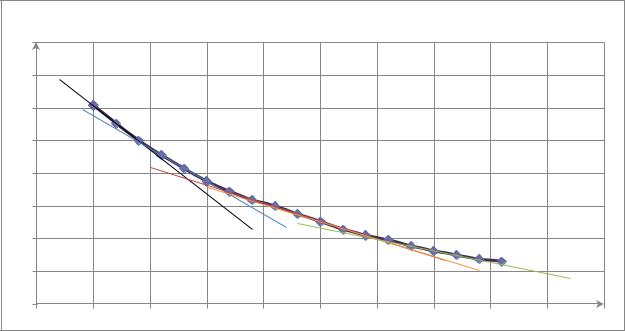
Определим порядок реакции графическим методом. Для этого построим |
|||||||||
график зависимости |
|
|
. По нему определим скорость реакции |
||||||
в определенный момент времени: |
|
. Далее построим график |
|||||||
зависимости: |
|
|
|
, где |
|
|
|
|
|
|
|
|
График зависимости ( |
∞ |
− )= ( ). |
|
|
|||||
80 |
∞− , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
мл |
|
|
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
, мин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
Из данного графика : |
|
|
При |
мл/мин |
|
При |
мл/мин |
|
При |
мл/мин |
|
При |
мл/мин |
|
При |
мл/мин |
|
Далее построим график зависимости: |
, по которому и |
|
определим порядок реакции: |
|
|
при
при
при
при
при
