
ФХ Лр26
.pdf
Работа №26
Изучение зависимости электрической проводимости растворов сильных электролитов от концентрации
Цель работы: изучить зависимость электрической проводимости растворов сильных электролитов от концентрации; на основании данных о зависимости молярной электрической проводимости от концентрации исследуемого раствора определить графически константу уравнения
Кольрауша (Λ=Λ∞-А√ ) и рассчитать предельную проводимость ионов.
Литература: Практикум 1986, с.269-273, 278-280, 282-285 или Практикум 1974, с. 268-280., метод. Пособие 4949, А.М. Мерецкий, В.В.Белик, Растворы электролитов.- М., 2013,с. 11-12, 16-21, 58-69, 71-81, 93-96, 99-102.
Теоретическая часть
Согласно теории Аррениуса, электролитыэто вещества, способные при растворении в различных растворителях распадаться на ионы. Электролиты различают сильные и слабые.
Сильные электролиты: практически полностью диссоциируют в растворах при любых концентрациях и поэтому хорошо проводят ток
Слабые электролиты диссоциируют незначительно и, вследствие, проводят ток хуже; ионы удалены друг от друга. Электролиты разделяют по силе, согласно их степени диссоциации.
При растворении электролиты диссоциируют на ионы не полностью. Доля молекул, распавшихся в состоянии равновесия на ионы, отвечает степени диссоциации :
= |
дис |
= |
с снедис |
|
с |
||
|
|
|
Степень диссоциации может изменяться в пределах от нуля (отсутствие диссоциации) до единицы (полная диссоциация) : .
Степень диссоциации слабого электролита зависит от концентрации и разведения:

С увеличением разведения степень диссоциации возрастает и в бесконечно разбавленном растворе приближается к своей предельной величине. При увеличении концентрации, наоборот, степень диссоциации падает
Количественно равновесие между ионами и недиссоциированными молекулами можно характеризовать константой диссоциации .
В соответствии с законом действующих масс для константы равновесия будем иметь:
К |
|
= |
|
|
= |
|
= |
|
|
|
( |
) |
|
( |
) |
Данное уравнение называют законом разведения Оствальда.
Термином «удельная электрическая проводимость» называют величину, обратную удельному сопротивлению:
=,
где R – сопротивление раствора (Ом), S- лощадь поперечного сечения проводника-электрода (м2), l – расстояние между электродами (м)
Удельная электрическая проводимость – электропроводность объема раствора электролита, заключенного между двумя плоско параллельными пластинами(электродами), площадью 1 м2 и расположенными на расстоянии 1 м друг от друга.
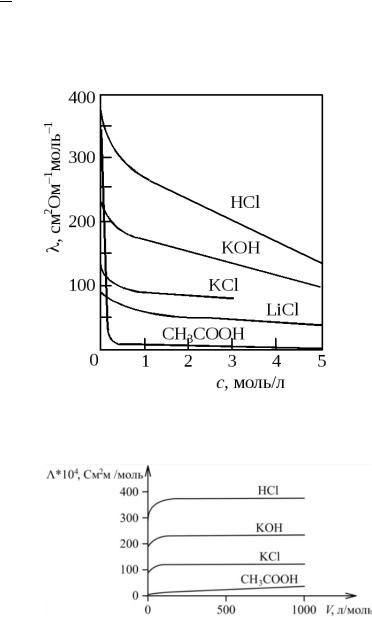
Зависимость =f(C) Самую высокую удельную
электропроводность имеют растворы сильных кислот, более низкую – растворы сильных оснований и солей, а самую наименьшую – растворы слабых кислот.
При С―›0 величина стремится к значению чистой воды.
С ростом концентрации удельная электропроводность сначала увеличивается за счет увеличения числа ионов в растворе. Затем, достигнув некоторого максимума, электропроводность уменьшается.
Для сильных электролитов уменьшение обусловлено усилением электростатического взаимодействия между ионами (эффект торможения, ассоциации ионов с образованием ионных пар, тройников и т.д.)
Для слабых электролитов с ростом концентрации уменьшается α, равновесие смещается в сторону недиссоциированных молекул.
В общем случае с увеличением С электролитов увеличивается вязкость раствора, что так же способствует уменьшению электропроводности.
Молярная электрическая проводимость – электропроводность объема раствора электролита, содержащего 1 моль растворенного вещества и находящегося между двумя электродами, расположенными на расстоянии одного метра друг от друга Она связана с удельной электропроводностью:
= = ,
где Λ – молярная электропроводность (См*м2/моль), κ –удельная электропроводность( м/м), – молярная концентрация (моль/м3), V – разведение(м3/моль).
Зависимость Λ=f(C) Молярная электропроводность
падает с ростом концентрации С, при С―›0 она наибольшая.
Для сильных электролитов падение молярной электропроводности связано с многочисленными электростатическими взаимодействиями, усиливающиеся с ростом концентрации Для слабых электролитов падение
молярной электропроводности связано с уменьшением степени диссоциации.
Зависимость Λ=f(C)
Для слабых электролитов молярная электропроводность монотонно возрастает с увеличением разведения.
Для сильных электролитов молярная электропроводность резко возрастает, выходит на плато и величина электрической проводимости быстро достигает величин, близких к предельной Λ∞
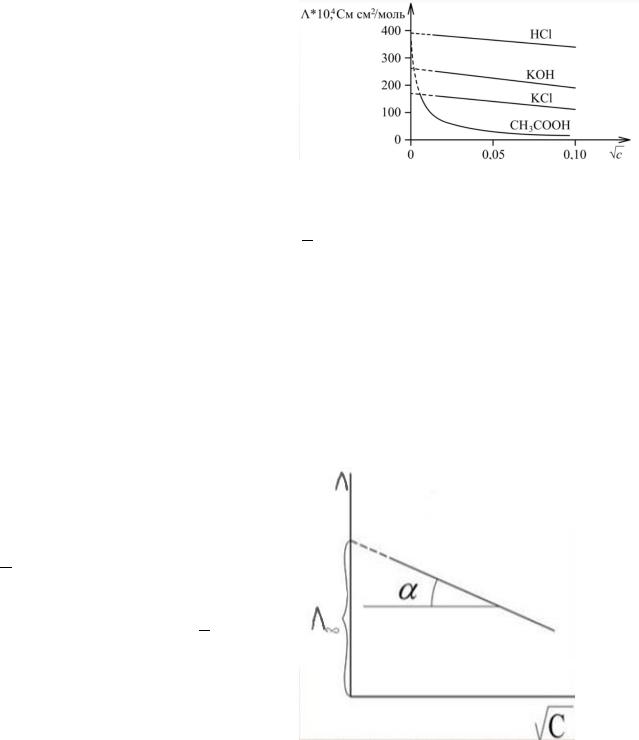
Так как молярная электрическая проводимость сильного электролита линейно зависит от корня квадратного из концентрации, то данную зависимость используют для нахождения величины предельной электрической проводимости.
Для определения молярной проводимости растворов сильных электролитов при бесконечном разведении:
Λ=Λ∞-А√ -
уравнение Кольрауша, где Λ∞ - предельная молярная электропроводность, С – концентрация электролита,
А – эмпирическая константа, зависящая от природы электролита и растворителя, температуры и давления.
Экспериментально определяют величины удельной электропроводности при последовательном уменьшающихся значениях молярной концентрации электролита. Далее вычисляют значения Λ по уравнению:
= , где κ – удельная
электропроводность, – молярная концентрация; строят
график в координатах Λ - √ .
Экстраполируя опытны данные на нулевую концентрацию, определяют Λ∞.
Для определения эмпирической константы: А= - tgα

Задача
На основании данных о зависимости молярной электрической проводимости
(Λ) от концентрации раствора нитрата лития (LiNO3) при 18˚С :
С, |
0,001 |
0,005 |
0,01 |
0,05 |
0,1 |
моль/л |
|
|
|
|
|
Λ, |
92,9 |
90,3 |
88,6 |
82,7 |
79,2 |
См*см2/моль
Определите графически константы уравнения Кольрауша (Λ=Λ∞-А√ ). Каков их физический смысл? Рассчитайте предельную электрическую
проводимость ионов NO3-, если |
= 32.8 См*см2/моль |
|
||||||
|
|
|
|
|
|
|
||
√ , (моль/ |
0,0316 |
0,0707 |
|
0,01 |
0,2236 |
0,3162 |
||
|
|
л)1/2 |
|
|
|
|
|
|
|
|
Λ, |
92,9 |
90,3 |
|
88,6 |
82,7 |
79,2 |
См*см2/моль |
|
|
|
|
|
|
||
96 |
|
Зависимость Λ=Λ∞-А√С |
|
|
|||
Λ, См*см2/моль |
|
|
|
|
|
||
|
|
|
y = -47,552x + 93,798 |
||||
94 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
92 |
|
|
|
|
|
|
|
90 |
|
|
|
|
|
|
|
88 |
|
|
|
|
|
|
|
86 |
|
|
|
|
|
|
|
84 |
|
|
|
|
|
|
|
82 |
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
√С, |
78 |
|
|
|
|
|
|
√(моль/л) |
|
|
|
|
|
|
|
|
0 |
0,05 |
0,1 |
0,15 |
0,2 |
0,25 |
0,3 |
0,35 |
По графику нашли зависимость y = -47,552x + 93,798 (Λ=Λ∞-А√ )
Предельная молярная электропроводность - Λ∞=93,798 См*см2/моль Эмпирическая константа - А= -tgα = 47,552
LiNO3 = Li+ + NO3- |
|
|
|
По закону Кольрауша : Λ∞= |
+ |
|
|
Откуда |
= Λ∞ - |
= 93,798 – 32,8 = 60,998 См*см2/моль |
|
Ответ: Λ∞=93,798 См*см2/моль |
|
||
|
А=47,552 |
|
|
|
= 60,998 См*см2/моль (в справ. |
= , м см /моль ) |
|
Экспериментальная часть
Задание на работу
Определить:
Удельную и эквивалентную электрические проводимости исследуемого электролита для шести концентраций;
Построить график зависимости молярной электрической проводимости от корня концентрации;
Определить графически константу уравнения Кольрауша
(Λ=Λ∞-А√ ) и рассчитать предельную проводимость ионов.
Порядок выполнения работы
1. обрать установку, согласно схеме:
Проверить плотность зажима контактов, исправность установки.
Перед измерением термостатированную ячейку залить раствором электролита и оставить на 10 минут.
2.По раствору KCl 0,02 н определить константу прибора.
3.После промыть ячейку дистиллированной водой и измерить ее электрическую проводимость.
4.Измерить электрическую проводимость
раствора электролита.
Для этого в ячейку налить 50 мл исследуемого раствора, погрузить платиновые электроды и выдержать раствор при температуре опыта в течении 10 минут. Электроды присоединить к мостовой схеме и приступить к измерению. Измерения проводить при трех известных сопротивлениях.
Последующие разбавления проводить пипеткой на 25 мл. Раствор перемешивать каждый раз.
Вынимать электроды из ячейки при разбавлении исходного раствора запрещается.
Результаты измерений занести в таблицы и произвести расчет.

Обработка экспериментальных данных
|
|
Сильный электролит |
|
|
|
|
№ п/п |
с, |
κ, |
Λ, |
√ |
с |
, |
|
моль/л |
мСм/см |
См*см2/моль |
(моль/ л)1/2 |
||
1 |
0,05 |
19,92 |
398,4 |
0,2236 |
||
2 |
0,02 |
8,16 |
408 |
0,1412 |
||
3 |
0,01 |
4,12 |
412 |
0,1 |
||
4 |
0,005 |
2,08 |
416 |
0,0707 |
||
5 |
0,002 |
0,84 |
420 |
0,0447 |
||
6 |
0,001 |
0,42 |
420 |
0,0316 |
||
Для построения графика в координатах Λ - √ |
|
|
найдем значение молярной |
||||||||||||||||||||||
электропроводности по формуле: |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
= |
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где κ –удельная электропроводность( м/см), – молярная |
|||||||||||||||||||||||||
концентрация (моль/л) |
|
|
|
|
|
|
|
|
|||||||||||||||||
1. |
= |
, |
|
|
|
|
|
|
|
|
|
|
= |
, |
м см /моль |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(моль/ л)1/2 |
|
|
|
|||||||
|
√ |
|
|
= √ , |
= |
, |
|
|
|
|
|||||||||||||||
|
с |
|
|
|
|
||||||||||||||||||||
2. |
= |
, |
|
|
|
|
|
|
|
|
|
= |
м |
см /моль |
|
|
|
||||||||
, |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(моль/ л)1/2 |
|
|
|
|||||||||
|
√ |
с |
= √ |
, |
|
= |
, |
|
|
|
|
||||||||||||||
3. |
= |
, |
|
|
|
|
|
|
|
|
|
= |
м |
см /моль |
|
|
|
||||||||
, |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
, (моль/ л)1/2 |
|
|
|
|||||||||||||
|
√ |
с |
= √ |
, |
|
= |
|
|
|
||||||||||||||||
4. |
= |
, |
|
|
|
|
|
|
|
|
|
= |
м |
см /моль |
|
|
|
||||||||
, |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
(моль/ л)1/2 |
|
|
|
|||||||||||
|
√ |
|
|
= √ , |
= |
, |
|
|
|
||||||||||||||||
|
с |
|
|
|
|||||||||||||||||||||
5. |
= |
, |
|
|
|
|
|
|
|
|
|
= |
м |
см /моль |
|
|
|
||||||||
, |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
(моль/ л)1/2 |
|
|
|
|||||||||||||
|
√ |
с |
= √ |
, |
|
|
= |
, |
|
|
|
||||||||||||||
6. |
= |
, |
|
|
|
|
|
|
|
|
|
= |
м |
см /моль |
|
|
|
||||||||
, |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
(моль/ л)1/2 |
|
|
|
||||||||||||||||
|
√ |
с |
= √ |
, |
|
= |
, |
|
|
|
|||||||||||||||
Строим графическую зависимость в координатах Λ - √ .
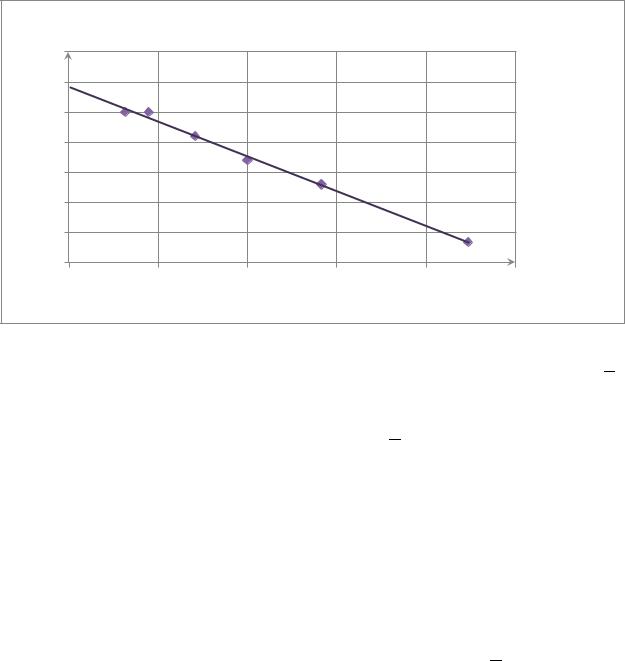
|
|
Зависимость Λ=f(√С) |
|
|||
430 |
|
|
|
|
|
|
425 |
Λ, См*см2/моль |
|
|
y = -115,73x + 424,21 |
|
|
|
|
|
|
|
||
420 |
|
|
|
|
|
|
415 |
|
|
|
|
|
|
410 |
|
|
|
|
|
|
405 |
|
|
|
|
|
|
400 |
|
|
|
|
|
|
395 |
|
|
|
|
√С, |
|
|
|
|
|
√(моль/л) |
||
0 |
0,05 |
0,1 |
0,15 |
0,2 |
||
0,25 |
||||||
По графику нашли линейную зависимость y = -115,73x + 424,21, что соответствует уравнению Кольрауша для сильных электролитов (Λ=Λ∞-А√ )
Получаем,
Λ = 424,21 - 115,73√
Откуда,
Предельная молярная электропроводность - Λ∞=424,21 См*см2/моль
Эмпирическая константа - А= -tgα = 115,73
Вывод:
В ходе данной лабораторной работы мы изучили зависимость электрической проводимости растворов сильных электролитов от концентрации:
Для сильных электролитов выполняется закон Кольрауша, и данная зависимость имеет линейный вид: Λ = 424,21 - 115,73√ .
Графическим методом (зависимость Λ=f(√С)) определили значения
-предельной молярной электропроводности - Λ∞=424,21 См*см2/моль -эмпирической константы - А = 115,73
По значению предельной молярной электропроводности (Λ∞=424,21 См*см2/моль) в соответствии со справочными данными можно предположить, что в данной работе исследуемым сильным электролитом является кислота.
