
- •Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.)
- •Атомы не могут связываться друг с другом произвольно. Каждый атом способен связываться с
- •Завершенная внешняя электронная оболочка обладает меньшей (т.е. более выгодной для атома) энергией, чем
- •Классическая теория химической связи, была предложена Косселем (ионная связь) и Льюисом (ковалентная связь)
- •Для квантово-механического описания образования ковалентной связи используют два подхода – метод валентных связей
- ••3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных
- •Два механизма образования общих электронных пар
- •В образовании σ-связи могут принимать участие следующие типы орбиталей: s-s (как при образовании
- •Образование молекулы кислорода (О2)
- •.Число общих электронных пар между связанными атомами
- •Если связь между двумя атомами образована тремя общими электронными парами, то такая связь
- •Валентность элементов в ковалентных соединениях
- •Пространственная конфигурация молекул по модели гибридизации валентных орбиталей.
- •Гибридизация - это смешивание и выравнивание по форме и по энергии орбиталей одного
- •sp-гибридизация
- •Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которые располагаются в
- •Атом бора образует с тремя атомами хлора три σ-связи по обменному механизму. Тип
- •sp3- гибридизация
- •Атом углерода образует четыре одинарные связи с атомами водорода, все эти связи –
- •Строение молекулы аммиака (NH3)
- •2. Донорно-акцепторный механизм образования ковалентной связи:
- •Количественные характеристики химической связи.
- •Полярность связей и молекул.
- •Межмолекулярные взаимодействия
- •Типы межмолекулярного взаимодействия
- •Взаимодействие диполь - индуцированный диполь (индукционное взаимодействие).
- •Дисперсионное взаимодействие.
- •Водородная связь
- •Металлическая связь
- •1.Химическая связь – это совокупность сил, удерживающих вместе два или несколько атомов или
Взаимодействие диполь - индуцированный диполь (индукционное взаимодействие).
Присутствие полярной молекулы вблизи другой, которая может быть полярной или неполярной, оказывает на вторую молекулу поляризующее действие и вызывает появление в ней индуцированного дипольного момента. Индуцированный дипольный момент имеет то же направление, что и постоянный. Взаимодействие постоянного диполя одной молекулы с наведенным диполем второй понижает энергию системы на величину, называемую энергией индукционного взаимодействия Еинд.
Eинд= −2 μ2α/r6,
где μ- момент наведенного диполя.
Дисперсионное взаимодействие.
Этот вид взаимодействия имеет место между неполярными молекулами. В чистом виде дисперсионноевзаимодействие проявляется у благородных газов, которые при понижении температуры сжижаются. В неполярных молекулах распределение электронной плотности симметрично и дипольный момент отсутствует, электронные облака постоянно колеблются относительно ядер, образуя временные или мгновенные диполи. Мгновенный диполь одной молекулы А поляризует другую молекулу В и вызывает появление в ней индуцированного диполя. Обе молекулы будут иметь дипольные моменты, направленные в одну сторону, и притягиваться друг к другу. В следующий момент диполь в молекуле А может быть направлен в противоположную сторону. И снова наведенный в молекуле В диполь станет таким, что между молекулами возникнет притяжение. Дипольные моменты возникают лишь на мгновение, но число молекул велико (6,02 *1023/моль) и суммарный эффект их взаимодействия — это постоянно действующие силы притяжения. В результате дисперсионного взаимодействия энергия системы понижается.
Eдисп= −2 μмгн2α2/r6,
где μ - момент мгновенного диполя. Силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими.
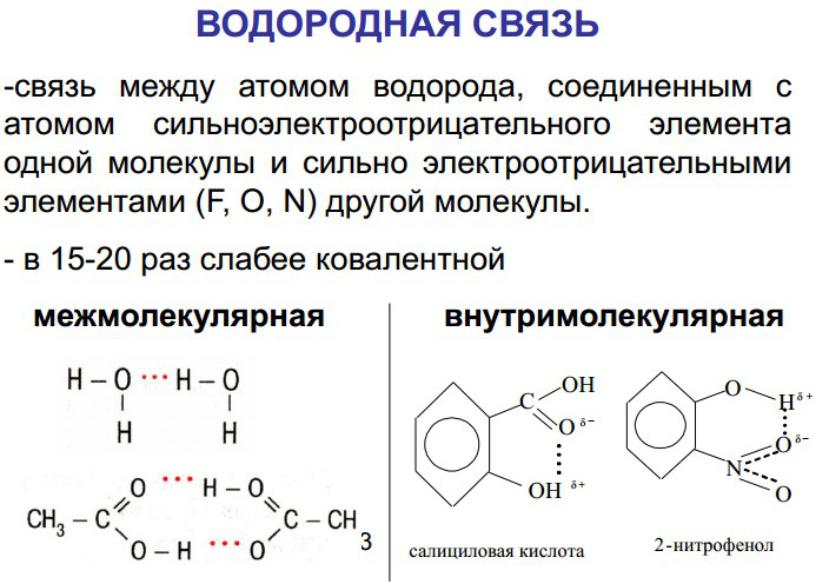
Водородная связь
Помимо универсального ван-дер-ваальсова взаимодействия между молекулами может возникать
водородная связь.
Водородная связь возникает между молекулами, в которых атом водорода связан с атомом элемента, обладающего высокой электроотрицательностью.
Металлическая связь
1.Химическая связь – это совокупность сил, удерживающих вместе два или несколько атомов или ионов.
2.Характер химической связи зависит от электронной структуры взаимодействующих частиц
3.На расстоянии, называемом длиной связи, потенциальная энергия системы минимальна и молекула обладает максимальной устойчивостью.
4.Если взаимодействующие атомы одинаковы, область перекрывания электронных облаков находится на одинаковом расстоянии от ядер атомов. Такая связь называется ковалентной неполярной. Электрический момент диполя равен нулю.
5.При взаимодействии атомов разных элементов область перекрывания электронных облаков смещена по направлению к атому, электроотрицательность которого выше. В этом случае связь называется ковалентной полярной. Чем больше полярность связи, тем выше электрический момент диполя
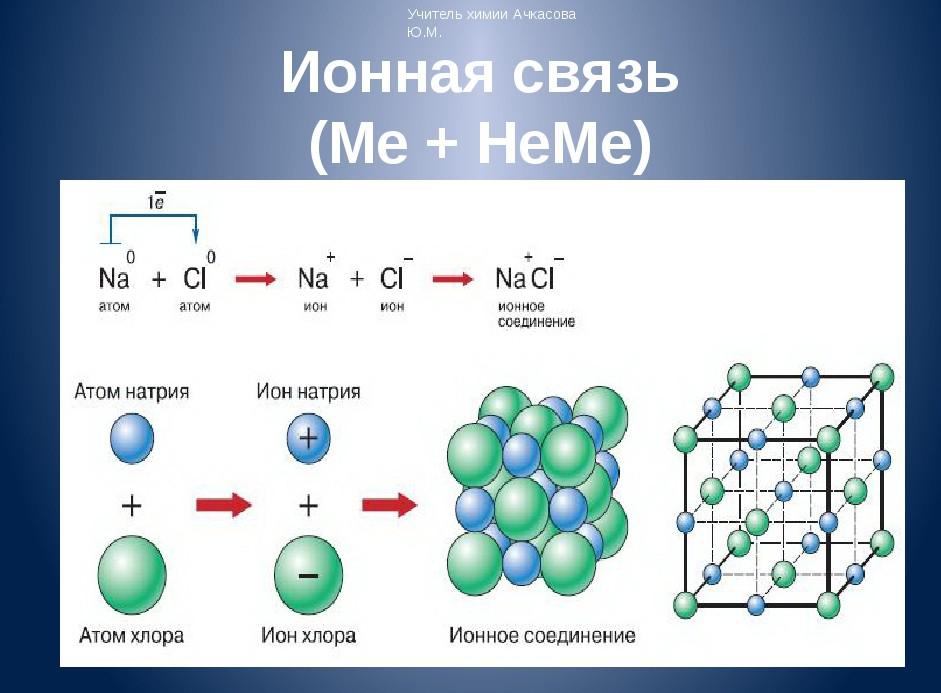
6.В предельном случае, когда разность электроотрицательностей очень высока, валентный электрон полностью переходит от одного атома к другому, образуя ионы. Ионы взаимодействуют электростатически. Такая связь называется ионной.
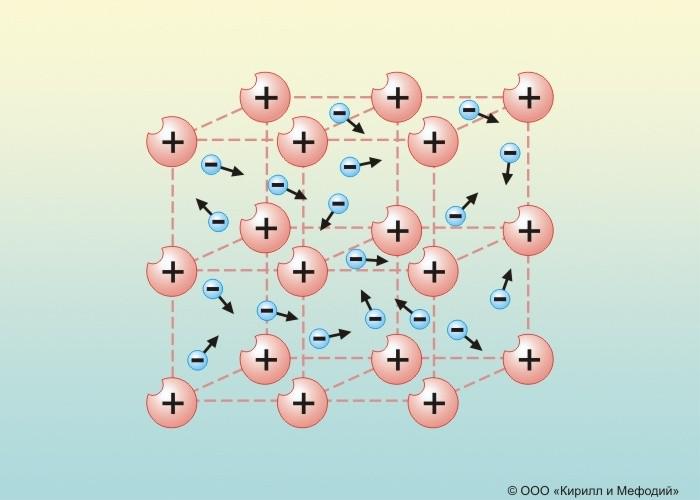
7.Металлическая связь осуществляется за счет общих электронов, свободно перемещающихся по кристаллу и связывающих между собой положительные ионы в кристаллах металлов.
8.Межмолекулярные взаимодействия Межмолекулярные взаимодействия
—взаимодействия между молекулами и/или атомами, не приводящие к образованию ковалентных (химических) связей.
Межмолекулярные взаимодействия имеют электростатическую природу.
