
- •Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.)
- •Атомы не могут связываться друг с другом произвольно. Каждый атом способен связываться с
- •Завершенная внешняя электронная оболочка обладает меньшей (т.е. более выгодной для атома) энергией, чем
- •Классическая теория химической связи, была предложена Косселем (ионная связь) и Льюисом (ковалентная связь)
- •Для квантово-механического описания образования ковалентной связи используют два подхода – метод валентных связей
- ••3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных
- •Два механизма образования общих электронных пар
- •В образовании σ-связи могут принимать участие следующие типы орбиталей: s-s (как при образовании
- •Образование молекулы кислорода (О2)
- •.Число общих электронных пар между связанными атомами
- •Если связь между двумя атомами образована тремя общими электронными парами, то такая связь
- •Валентность элементов в ковалентных соединениях
- •Пространственная конфигурация молекул по модели гибридизации валентных орбиталей.
- •Гибридизация - это смешивание и выравнивание по форме и по энергии орбиталей одного
- •sp-гибридизация
- •Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которые располагаются в
- •Атом бора образует с тремя атомами хлора три σ-связи по обменному механизму. Тип
- •sp3- гибридизация
- •Атом углерода образует четыре одинарные связи с атомами водорода, все эти связи –
- •Строение молекулы аммиака (NH3)
- •2. Донорно-акцепторный механизм образования ковалентной связи:
- •Количественные характеристики химической связи.
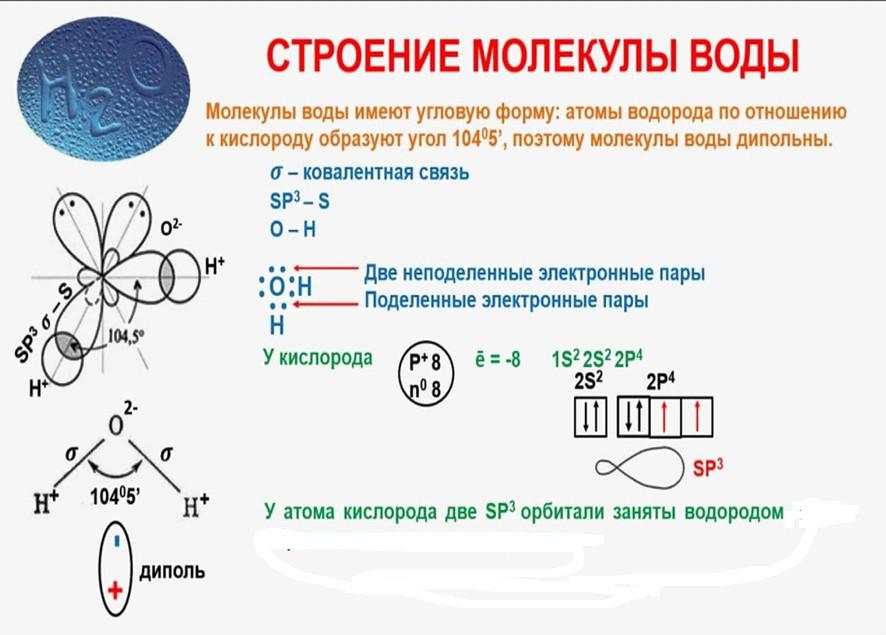
- •Полярность связей и молекул.
- •Межмолекулярные взаимодействия
- •Типы межмолекулярного взаимодействия
- •Взаимодействие диполь - индуцированный диполь (индукционное взаимодействие).
- •Дисперсионное взаимодействие.
- •Водородная связь
- •Металлическая связь
- •1.Химическая связь – это совокупность сил, удерживающих вместе два или несколько атомов или
Атом углерода образует четыре одинарные связи с атомами водорода, все эти связи – σ-связи
Все орбитали валентных электронов углерода гибридизуются. Четыре sp3 гибридные орбитали углерода располагаются вокруг ядра под углом 109о28′
Орбитали водорода перекрываются с sp3- гибридными орбиталями углерода. Образуется
прочная молекула метана с четырьмя связями.
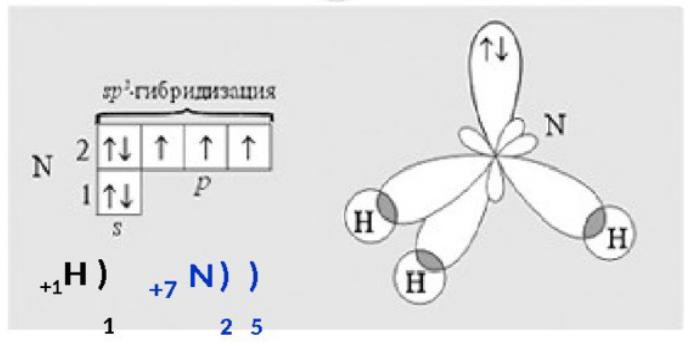
Строение молекулы аммиака (NH3)
В невозбужденном состоянии центральный атом азота в молекуле аммиака NH3 имеет 1s2 2s2 2p3 - электронную
конфигурацию.
Валентные углы в аммиаке равны 107о
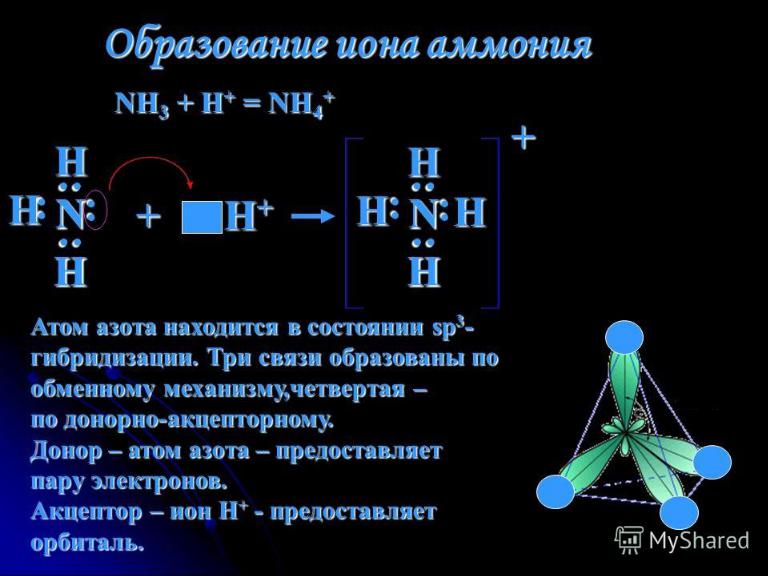
2. Донорно-акцепторный механизм образования ковалентной связи:
В этом случае образование ковалентной связи происходит за счет пары электронов, не участвовавшей ранее в образовании связи
(неподеленной электронной пары) и вакантной орбитали другого атома. Рассмотрим механизм образования иона NH4+
1) NH3 + H+ → NH4+
2) 7N 1s22s22p3 1H+ 1s0
3) Графическая схема:
Молекула NH3 образуется по обменному механизму, а при сближении ее с
ионом водорода неподеленная электронная пара азота занимает вакантную орбиталь атома водорода, что приводит к образованию общей электронной пары и, следовательно, к образованию ковалентной связи. Атом, предоставляющий электроны в общее пользование, называется донором (в данном случае это азот), а атом, имеющий вакантную орбиталь – акцептором (водород).
Количественные характеристики химической связи.
1.Энергия связи –минимальная энергия, небходимая для разрыва связи
2.Длина связи –расстояние между атомами (l)
3.Валентные углы
4.Электpоoтрицательность (χ) - способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру.
Это свойство проявляется в химических связях как
смещение электронов связи в сторону более электроотрицательного атома.
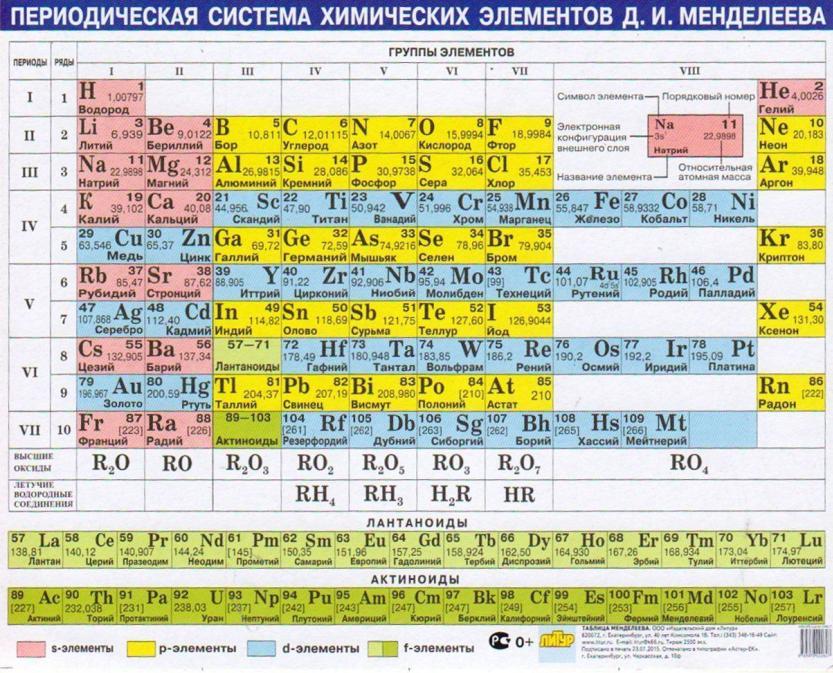
Электроотрицательность элементов растет
слева направо вдоль периода и снизу вверх в группах Периодической системы Д.И. Менделеева ( смотрите таблицу в методичке).
Полярность связей и молекул.
Молекула состоит из атомов разных элементов (НС1, СО и т. д.). В этом случае электроны смещены к атому с большей электроотрицательностью и центры тяжести положительных и отрицательных зарядов не совпадают, образуется электрический диполь
Электрический диполь - система из двух равных по величине и
противоположных по знаку зарядов q, находящихся на расстоянии l, называемом длиной диполя. Длина диполя - векторная величина. Ее направление условно принято от отрицательного заряда к положительному. Такие молекулы называют полярными молекулами или диполями.
Мерой полярности служит произведение q*l, называемое электрическим моментом диполя
μ= q·l.
Единицей измерения μ служит Дебай (Д). 1 Д = 3,3 · 10 -30 Кл·м.
В молекулах, состоящих из двух одинаковых атомов μ = 0. Эти молекулы называют неполярными.
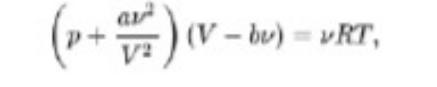
Межмолекулярные взаимодействия
Силы Ван-дер-Ваальса
Если бы взаимодействие между молекулами отсутствовало, то все вещества находились бы в состоянии идеального газа.
Уравнение состояния для идеального газа описывается уравнением Менделеева-Клапейрона
PV = νRT, где ν-число молей газа.
Силы межмолекулярного взаимодействия были названы именем голландского физика Ван-дер-Ваальса, который внес большой вклад в изучение процессов конденсации газов. Уравнение Ван-дер-Ваальса имеет следующий вид:
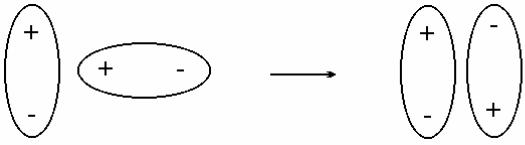
Типы межмолекулярного взаимодействия
Ориентационное взаимодействие.
Оно проявляется, если вещество состоит из полярных молекул -- диполей (диполь-дипольное взаимодействие).
Eор= −2 μ1μ2/4π ε0r3
μ1 и μ2 - дипольные моменты взаимодействующих диполей, r- расстояние между ними.
