
- •Химия (модуль I) Учебное пособие
- •Химия (модуль I) Учебное пособие
- •Оглавление
- •Введение
- •Строение атома и химическая связь. Биогенные элементы
- •1.1. Квантово-механическая модель строения атома
- •1.2. Периодический закон д.И. Менделеева
- •1.2.1. Периодическая система д. И. Менделеева
- •1.2.2. Типы химических элементов
- •1.3. Химическая связь и типы взаимодействия молекул
- •1.3.1. Ковалентная связь
- •1.3.2. Ионная связь
- •1.3.3. Металлическая связь
- •1.4. Биогенные элементы
- •1.4.1. Классификация по количественному содержанию в организме
- •1.4.2. Классификация по функциональной роли в организме
- •1.5. Нарушения обмена микроэлементов (микроэлементозы)
- •Элементы химической термодинамики и кинетики
- •2.1. Термодинамические системы и процессы. Стандартное состояние
- •2.2. Основные понятия термодинамики: внутренняя энергия, работа, теплота
- •2.3. Первое начало термодинамики. Энтальпия
- •2.4. Закон Гесса. Применение первого начала термодинамики
- •2.5. Второе начало термодинамики. Энтропия. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов
- •2.6. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения
- •2.7. Скорость реакции: средняя и истинная. Закон действующих масс
- •2.8. Классификация реакций, применяющихся в кинетике
- •2.9. Зависимость скорости реакции от концентрации. Молекулярность элементарного акта реакции. Порядок реакции. Кинетические уравнения реакций первого и нулевого порядков. Период полупревращения
- •2.10. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Энергия активации
- •2.11. Катализ гомогенный и гетерогенный. Ферментативный катализ
- •2.12. Химическое равновесие. Обратимые и необратимые реакции
- •2.13. Константа химического равновесия. Прогнозирование смещения химического равновесия
- •3. Растворы: коллигативные свойства, способы выражения концентраций. Гетерогенные равновесия
- •3.1. Особенности физико-химических свойств воды
- •3.2. Растворимость, коэффициент растворимости. Факторы, от которых зависит растворимость веществ
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Теория растворов и сильных электролитов. Ионная сила
- •Электрическая проводимость растворов. Жидкости и
- •3.7. Ионное произведение воды
- •3.8. Методы определения рН растворов. Индикаторы
- •3.9. Гетерогенные равновесия. Константа растворимости.
- •Основные типы химических равновесий и процессов в функционировании живых систем
- •4.1. Протолитическая теория кислот и оснований. Протолитические
- •4.2. Ионизация слабых кислот и оснований. Константа диссоциации слабых кислот и оснований. Закон разведения Оствальда
- •4.3. Гидролиз солей. Степень и константа гидролиза
- •4.4. Амфолиты. Изоэлектрическая точка
- •4.5. Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма
- •4.6. Буферные системы: определение, классификация
- •4.7. Зона буферного действия и буферная емкость. Расчет рН протолитических систем
- •4.8. Механизм действия буферных систем
- •Буферные системы крови: гидрокарбонатная, фосфатная,
- •4.10. Механизм сопряженного действия буферных систем
- •4.11. Понятие о кислотно-основном состоянии организма: рН крови, ацидоз, алкалоз, щелочной резерв крови
- •Лабораторно-практическая работа
- •Окислительно-восстановительные реакции. Химия комплексных соединений
- •Типы окислительно-восстановительных (редокс) реакций
- •Механизм возникновения электродного и
- •Сравнительная сила окислителей и восстановителей.
- •Физико-химические принципы транспорта электронов в
- •Основные положения координационной теории Вернера.
- •Центральный атом (комплексообразователь)
- •Лиганды
- •5.6. Классификация и номенклатура комплексных соединений
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •5.7. Изомерия и пространственное строение комплексных соединений
- •5.8. Полидентатные лиганды. Хелатирование.
- •5.9. Классы комплексных соединений: внутрикомплексные, макроциклические, многоядерные, сэндвичевые
- •5.10. Устойчивость комплексных соединений в растворах.
- •5.11. Представления о строении металлоферментов и других
- •Физико-химические основы дисперсных систем и поверхностных явлений
- •6.1. Поверхностная энергия Гиббса и поверхностное натяжение.
- •6.2. Адсорбция. Уравнение Ленгмюра
- •6.3. Поверхностно-активные (пав) и
- •6.4. Дисперсные системы и их классификация
- •6.5. Получение лиофобных коллоидных растворов.
- •6.6. Свойства лиофобных коллоидных растворов: молекулярно-кинетические, оптические, диализ, электродиализ
- •6.7. Устойчивость коллоидных растворов: седиментационная, агрегативная. Факторы, влияющие на устойчивость лиозолей
- •6.8. Коагуляция. Пептизация
- •6.9. Грубодисперсные системы: суспензии, эмульсии, аэрозоли
- •6.10. Электрокинетические явления в дисперсных системах: электрофорез, электроосмос
- •6.11. Мембраны и кровь как грубодисперсные системы
- •Список используемой литературы
- •Учебное пособие
5.9. Классы комплексных соединений: внутрикомплексные, макроциклические, многоядерные, сэндвичевые
Внутрикомплексные соединения - клешневидные соединения, хелатные соединения, один из классов комплексных соединений. Например, гликоколят меди:

Адденд (радикал гликокола строения NH2CH2COO-) присоединяется к центральному атому (Cu) одновременно двумя функциональными группами. Связь Cu-O ионная, связь Cu-N ковалентная. Центральный атом (Cu) оказывается как бы втянутым внутрь адденда; отсюда и название соединений такого типа. Внутрикомплексные соединения характеризуются малой растворимостью в воде, аномальными окрасками, сильно различающимися для различных ионов металлов, что обеспечило им широкое применение в аналитической химии в качестве высокочувствительных и селективных реактивов. Хорошо известен специальный объёмный метод аналитической химии - комплексонометрия, - основанный на образовании внутрикомплексных соединений различных металлов с многоосновными аминокислотами, в частности с трилоном Б (динатриевой солью этилендиаминтетрауксусной кислоты). Важнейшие природные пигменты – хлорофилл и гемоглобиг, являются внутрикомплексными соединениями.
Комплексы с макроциклическими соединениями
Среди природных комплексных соединений особое место занимают макрокомплексы на основе циклических полипептидов, содержащих внутренние полости определенных размеров, в которых находится несколько кислородсодержащих групп, способных связывать катионы тех металлов, в том числе натрия и калия, размеры которых соответствуют размерам полости. Такие вещества, находясь в биологических материалах, обеспечивают транспорт ионов через мембраны и поэтому называются ионофорами. Например, валиномицин транспортирует ион калия через мембрану (рис. 5.3).

Рис. 5.3. Комплекс валиномицина с ионом K+
С помощью другого полипептида - грамицидина А осуществляется транспорт катионов натрия по эстафетному механизму. Этот полипептид свернут в «трубочку», внутренняя поверхность которой выстлана кислородсодержащими группами. В результате получается достаточно большой длины гидрофильный канал с определенным сечением, соответствующим размеру иона натрия. Ион натрия, входя в гидрофильный канал с одной стороны, передается от одной к другой кислородным группировкам, подобно эстафете по ионопроводящему каналу.
Итак, циклическая молекула полипептида имеет внутримолекулярную полость, в которую может войти субстрат определенного размера, геометрии по принципу ключа и замка. Полость таких внутренних рецепторов окаймлена активными центрами (эндорецепторами). В зависимости от природы иона металла может происходить нековалентное взаимодействие (электростатическое, образование водородных связей, ван-дер-ваальсовы силы) со щелочными металлами и ковалентное со щелочноземельными металлами. В результате этого образуются супрамолекулы - сложные ассоциаты, состоящие из двух частиц или более, удерживаемых вместе межмолекулярными силами.
|
Многоядерные комплексы
Если в комплексном ионе или нейтральном комплексе содержатся два и более комплексообразователей, то этот комплекс называется многоядерным. Среди многоядерных комплексов выделяют мостиковые, кластерные и многоядерные комплексы смешанного типа.
Атомы комплексообразователя могут быть связаны между собой с помощью мостиковых лигандов, функции которых выполняют ионы OH-, Cl-, NH2-, O22-, SO42- и некоторые другие.
Так, в комплексном соединении (NH4)2[Co2(C2O4)2(OH)2] мостиковыми служат бидентатные гидроксидные лиганды:

В роли мостикового лиганда может выступать полидентатный лиганд, имеющий несколько донорных атомов (например, NCS- с атомами N и S, способными участвовать в образовании связей по донорно-акцепторному механизму), либо лиганд с несколькими электронными парами при одном и том же атоме (например, Cl- или OH-.
В том случае, когда атомы комплексообразователя связаны между собой непосредственно, многоядерный комплекс относят к кластерному типу. Так, кластером является комплексный анион [Re2Cl8]2-

в котором реализуется четверная связь Re–Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов.
Многоядерные
комплексы смешанного типа содержат как
связь комплексообразователь–комплексообразователь,
так и мостиковые лиганды.
Примером
комплекса смешанного типа может служить
карбонильный комплекс кобальта состава
[Co2(CO)8],
имеющий следующее строение:

Здесь имеется одинарная связь Co-Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей.
«Сандвичевые» («сэндвичевые») комплексные соединения – обширный класс, родоначальником которых является ферроцен. Ферроцен представляет собой желто-оранжевые кристаллы металлоорганического соединения, в котором атом железа располагается между двумя высокосимметричными пятичленными кольцами, образованными атомами углерода.
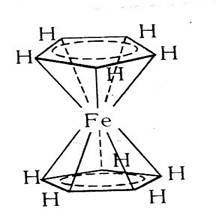
Рис. 5.4. Структура ферроцена
