
- •I. Химия белка
- •Функции белков:
- •5. Классификация и характеристика простых белков (альбумины, глобулины, гистоны, протамины, протеиноиды).
- •1. Альбумины
- •2. Глобулины
- •3.Гистоны
- •4.Протамины
- •5.Протеноиды
- •6. Классификация и характеристика сложных белков (липопротсины, хром-мопротеины, нуклеопротеины, гликопротеины, фосфопротеины).
- •II. Ферменты. Витамины.
- •7. Химическая природа ферментов, Активный и аллостерический центры фермента, их роль.
- •8. Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности.
- •9. Мультиферментные комплексы и изоферменты. Клиническое значение определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •11. Классификация ферментов. Общая характеристика класса оксидоредуктаз. Основные подклассы. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •12. Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •13. Классификация ферментов. Общая характеристика гидролаз. Основные подклассы гидролаз.
- •14. Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных реакций.
- •15. Классификация ферментов. Общая характеристика изомераз и лигаз. Коферменты изомеразных или глазных реакций.
- •16. Классификация витаминов. Причины развития витаминной недостаточности в организме человека. Авитаминозы, гиповитаминозы, гипервитаминозы, Антивитамины.
- •17. Витамин в1, его химическая структура, признаки витаминной недостаточности. Нарушение углеводного обмена при - витаминной недостаточности.
- •18. Витамины pp и в2, их структура, участие в обмене веществ, признаки витаминной недостаточности.
- •19. Витамины с и р, их структура, признаки витаминной недостаточности и влияние на обмен веществ.
- •20. Витамин биотин, их структура, признаки витаминной недостаточности и участие в обмене веществ.
- •21. Витамин b12, и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •22. Витамины а, е, к. Признаки витаминной недостаточности, участие в обмене веществ.
- •23. Витамин d, химическая природа витамина, гормонально-активные формы, участие витамина в обмене веществ. Рахит. Основные пути метаболизма. БиоэнергетическиЙ обмен.
- •24. Понятие об обмене веществ. Катаболизм и анаболизм, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •26. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс - потенциалы ферментных систем. Ингибиторы переноса электронов.
- •27. Окислительное фосфорилирование. Значение и механизм процесса. Расообщение дыхания и фосфорилирования. Свободное окисление. Субстратное фосфорилирование.
- •28. Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
- •29. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •IV. Обмен углеводов.
- •30. Классификация и химическая структура углеводов, их роль в обеспечении жизнедеятельности организма. Переваривание и всасывание углеводов в пищеварительном тракте. Мальабсорбция.
- •32. Структура гликогена и его синтез в клетках печени и мышц. Функциональные отличия гликогена этих тканей. Распад гликогена. Гликогенозы.
- •33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
- •II этап - окислительное декарбоксилирование пвк
- •III этап - Цикл Кребса
- •35. Апотомический путь обмена глюкозы (пентозный цикл). Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
- •36. Глюконеогенез. Основные субстраты и ключевые ферменты процесса. Цикл Кори.
- •38. Патология углеводного обмена. Сахарный диабет. Нарушения углеводного и липидного обменов при этом заболевании.
- •V. Обмен липидов
- •39. Классификация и химическая структура липидов. Роль липидов в обеспечении жизнедеятельности организма.
- •40. Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •41. Холестерин, его биосинтез и биологическая роль. Гиперхолестеринемия. Атеросклероз. Роль липопротеинов в обмене холестерина.
- •1)Наследственная.
- •42. Классификация и химическая структура фосфолипидов. Биологическая роль, переваривание, биосинтез и распад фосфолипидов. Липотропные вещества.
- •43. Переваривание и всасывание липидов, роль желчи в этом процессе. Желчные кислоты. Ресинтез липидов в клетке эпителия кишечника. Транспортные формы липидов. Биологическая роль жировых депо.
- •44. Липолиз триглицеридов в тканях. Окисление глицерина. Биоэнергетика процесса.
- •45. Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жирных кислот с нечетным количеством углеродных атомов и ненасыщенных жирных кислот.
- •46. Синтез жирных кислот. Внутриклеточная локализация, ферменты и коферменты процесса. Биосинтез триглицеридов.
- •47. Образование и распад кетоновых тел. Кетогенез в норме и при патологии.
- •48. Гормональная регуляция липидного обмена. Патология липидного обмена: гиперлипидемии, липоидозы, жировое перерождение печени, ожирение, атеросклероз.
- •3. Конденсация йодтирозинов
- •1. Аминокислоты и их производные:
- •2. Пептиды
3. Конденсация йодтирозинов


Тиреоглобулин – большой йодированный белок. 70% йодида в этом белке находится в составе неактивных предшественников МИТ и ДИТ. 30% - в виде Т3 и Т4.
Тиреоглобулин – форма хранения Т3 и Т4 в коллоиде, обеспечивает поступление этих гормонов в кровь.
Синтез тиреоглобулина:контролируется по цепочке: тиролиберин ТТГ синтез тиреоглобулина
ограничивается:тиреоидными гормонами, которые подавляют секрецию тиролиберина, протеиназами плазмы, которые расщепляют тиролиберин во время его транспорта кровью.
Тироксин выделяется в кровь после гидролиза тиреоглобулина протеазами лизосом фолликулярных клеток щитовидной железы.Тироксинсвязывающий белок преальбумин и альбумин транспортируют Т4.Концентрация тироксина контролируется ТТГ. При недостатке йода могут образоваться моно- и дииодтиронины. Распад Т3 и Т4 происходит в клетках печени.
Механизм действия тироксина Тироксин легко проходит через клеточную мембрану.
Внутри клетки имеет рецепторы в: ядре, митохондриях, цитоплазме.
Действие тироксина Тироксин активирует аденилатциклазу в чувствительных к нему тканях: печень, почки, сердце, жировая ткань, скелетные мышцы.
Тироксин действует на все ткани и обмены.
Он необходим для нормального роста, развития, дифференцировки тканей. Тироксин вначале стимулирует энергопотребляющую систему (активный мембранный перенос ионов натрия).
За этим следует поглощение кислорода тканями, усиление синтеза белка, необходимое для образования митохондрий, а затем наполнение их ферментами. Тироксин – анаболик в малых дозах в детстве. В больших дозах во взрослом организме тироксин – катаболик: стимулирует распад белков, липидов, активирует глюконеогенез.
Действие тироксина увеличивает скорость основного обмена, усиливает поглощение кислорода тканями, обеспечивает теплопродукцию, стимулирует синтез белков, ускоряет синтез многих ферментов, повышает активность ферментов.
Функция щитовидной железы в норме и патологии При недостатке тироксина возникает: кретинизм в детстве микседема у взрослых.
Кретинизм - врождённое нарушение синтеза тироксина. Клинические проявления: остановка роста, изменения кожи, волос, мышц, нарушения психики.
Микседема – слизистый отёк. Чаще встречается у женщин.
Клинические проявления: нарушение водно-солевого, основного, жирового обменов, патологическое ожирение, выпадение волос и зубов, психические расстройства, вялость, отёчность.
Эндемический зоб обусловлен недостатком йода в питьевой воде, почве и растениях определённых районов земного шара.
В регионах средней степени эндемии – тугоухость, нарушения речи, лёгкие моторные нарушения.
Тиреотоксикоз обусловлен повышенным содержанием в крови гормонов щитовидной железы. Тироксин разобщает тканевое дыхание и окислительное фосфорилирование, снижается концентрация АТФ, идёт распад белков, жиров, углеводов.
Клинические проявления: худоба, тахикардия, экзофтальм, остеопороз, раздражительность, психические расстройства, нарушение сна, потливость, повышение температуры тела, астения, снижение психической активности.
77. Адреналин и норадреналин, их синтез и влияние на обмен веществ.
Синтез

Осуществляется в клетках мозгового слоя надпочечников (80% всего адреналина), синтез норадреналина (80%) происходит также в нервных синапсах.
Регуляция синтеза и секреции
Активируют: стимуляция чревного нерва, стресс.
Уменьшают: гормоны щитовидной железы.
Механизм действия
Механизм действия гормонов разный в зависимости от рецептора. Конечный эффект гормонов зависит от преобладания типа рецепторов на клетке и концентрации гормона в крови. Например, в жировой ткани при низких концентрациях адреналина более активны α2-адренорецепторы, при повышенных концентрациях (стресс) – стимулируются β1-, β2-, β3-адренорецепторы.
-Аденилатциклазный механизм
при задействовании α2-адренорецепторов аденилатциклаза ингибируется,
при задействовании β1- и β2-адренорецепторов аденилатциклаза активируется.
-Кальций-фосфолипидный механизм
при возбуждении α1-адренорецепторов.
Мишени и эффекты
---При возбуждении α1-адренорецепторов (печень, сердечно-сосудистая и мочеполовая системы):
активация гликогенолиза,
сокращение гладких мышц кровеносных сосудов и мочеполовой системы.
---При возбуждении α2-адренорецепторов (жировая ткань, поджелудочная железа, почки):
подавление липолиза (уменьшение стимуляции ТАГ-липазы),
подавление секреции инсулина и секреции ренина.
---При возбуждении β1-адренорецепторов (есть во всех тканях):
активация липолиза,
увеличение силы и частоты сокращений миокарда.
---При возбуждении β2-адренорецепторов (есть во всех тканях):
стимуляция гликогенолиза в печени и мышцах, и глюконеогенеза в печени,
расслабление гладких мышц бронхов, кровеносных сосудов, мочеполовой системы и желудочно-кишечного тракта.
В целом катехоламины отвечают за биохимические реакции адаптации к острым стрессам, связанным с мышечной активностью – "борьба или бегство":
усиление липолиза и продукция жирных кислот в жировой ткани для мышечной активности,
гипергликемия за счет глюконеогенеза и гликогенолиза в печени для повышения устойчивости ЦНС,
стимуляция гликогенолиза в мышцах,
активация протеолиза в лимфоидной ткани для обеспечения глюконеогенеза субстратом (аминокислотами),
снижение анаболических процессов через уменьшение секреции инсулина.
Адаптация также прослеживается в физиологических реакциях:
мозг – усиление кровотока и стимуляция обмена глюкозы,
мышцы – усиление сократимости,
сердечно-сосудистая система – увеличение силы и частоты сокращений миокарда,
легкие – расширение бронхов, улучшение вентиляции и потребления кислорода,
кожа – снижение кровотока.
Патология
Гиперфункция - Опухоль мозгового вещества надпочечников феохромоцитома. Ее диагностируют только после проявления гипертензии и лечат удалением опухоли.
78. Гормоны островкового аппарата поджелудочной железы. Химическая структура и влияние на обмен веществ.
Гормоны островкового аппарата поджелудочной железы
Инсулин – первый гормон, для которого расшифрована белковая природа. Его удалось получить синтетическим путём. Инсулиноподобные вещества вырабатываются в печени, почках, эндотелии сосудов головного мозга, слюнных железах, гортани, сосочках языка.Инсулин – простой белок.
Состоит из двух полипептидных цепей: а- и в-. а-цепь содержит 21 аминокислотный остаток, в-цепь – 30.
Инсулин синтезируется в виде неактивного предшественника проинсулина, который путём ограниченного протеолиза превращается в инсулин. При этом от проинсулина отщепляется С-пептид из 33 аминокислотных остатков.
Основной эффект инсулина – повышение проницаемости клеточных мембран для глюкозы.
Инсулин активирует гексокиназную реакцию, синтез глюкокиназы, гликолиз, все фазы аэробного распада, пентозный цикл, синтез гликогена, синтез жира из глюкозы. Инсулин ингибирует: распад гликогена, глюконеогенез.
Инсулин является анаболиком. способствует синтезу гликогена, жира, белка. оказывает белоксберегающий эффект, так как тормозит глюконеогенез из аминокислот.Органы – мишени инсулина и характер метаболического влияния

Глюкагон вырабатывается а-клетками островков Лангерганса, состоит из 29 АМК, молекулярная масса 3500.
Органы-мишени: печень, жировая ткань.
Действует глюкагон через цАМФ.
Рецепторами являются липопротеины мембран.
Биологическая роль глюкагона стимулирует фосфоролиз гликогена печени, стимулирует глюконеогенез, усиливает липолиз в жировой ткани и печени, увеличивает клубочковую фильтрацию, ускоряет ток крови, способствует экскреции соли, мочевой кислоты, стимулирует протеолиз, увеличивает кетогенез, стимулирует транспорт АМК в печени, снижает концентрацию калия в печени.
79. Гормоны передней доли гипофиза, их химическая структура и влияние на обмен веществ. Последствия изменений продукции соматотропного гормона в организме.
Химическая природа гормонов передней доли гипофиза
СТГ – белок, ТТГ – гликопротеин, АКТГ – пептид, ГТГ: пролактин – белок, ФСГ – гликопротеин, ЛГ - гликопротеин. β-липотропин – пептид.
Соматотропный гормон
Анаболик: стимулирует синтез ДНК, РНК, белка, усиливает проницаемость клеточных мембран для АМК, усиливает включение АМК в белки протоплазмы,уменьшает активность внутриклеточных протеолитических ферментов, обеспечивает энергией синтетические процессы, усиливает окисление жиров, вызывает гипергликемию, которая связана с активацией, а затем с истощением инсулярного аппарата, стимулирует мобилизацию гликогена, повышает глюконеогенез. под влиянием СТГ период роста костей увеличивается , стимулируются клеточные деления, образование хрящей.
Регуляция синтеза СТГ Регуляция секреции СТГ по типу обратной связи осуществляется в вентромедиальном ядре гипоталамуса.Соматолиберин – стимулирующий регулятор секреции. Соматостатин – тормозящий регулятор,ингибирует мобилизацию кальция. Ростостимулирующее действие СТГ опосредуется ИФР-1(инсулиноподобный фактор роста 1), который образуется в печени.ИФР-1 регулирует секрецию СТГ, подавляя высвобождение соматолиберина и стимулирует высвобождение соматостатина. Лица с дефицитом ИФР-1 лишены способности к нормальному росту.
Стимулы для секреции СТГ гипогликемия, поступление избытка белка в организм, эстрогены, тироксин. Выделению СТГ способствуют: физические нагрузки, сон (в первые 2 часа после засыпания).Подавляют секрецию СТГ избыток углеводов и жиров в пище, кортизол. При недостатке СТГ возникает гипофизарный нанизм (карликовость).Гигантизм развивается, если в детстве повышена выработка СТГ.У гигантов понижена физическая выносливость. Акромегалия возникает, если избыток СТГ наблюдаетсяпосле периода полового созревании (после зарастания эпифизарных хрящей).
Тиреотропный гормон
Гликопротеин, молекулярная масса около 30 000, синтез и секреция ТТГ контролируются тиролиберином, связывается с рецепторами плазматических мембран и активирует аденилатциклазу, ТТГ стимулирует все стадии биосинтеза и секрецию трииодтиронина ( Т3 ) и тироксина ( Т4 ),повышает синтез белков , фосфолипидов и нуклеиновых кислот в клетках щитовидной железы. Тиреоидные гормоны: транспорт и метаболизм в клетке
Адренокортикотропный гормон ( АКТГ )
Пептид, синтез и секреция АКТГ контролируются кортиколиберином, регулирует эндокринные функции надпочечников,
АКТГ стимулирует синтез и секрецию кортизола. АКТГ стимулирует: 1. захват ЛПНП, 2. гидролиз запасенных эфиров холестерина в коре надпочечников и увеличение количества свободного холестерина, 3.транспорт холестерина в митохондрии, 4.связывание холестерина с ферментами, превращающими его в прегненолон.
Лютеинизирующий гормон ( ЛГ )
Гликопротеин, продукция ЛГ регулируется гонадолиберином, регулирует синтез и секрецию половых гормонов и гаметогенез, связывается со специфическими рецепторам плазматических мембран и стимулирует образование прогестерона клетками желтых тел и тестостерона клетками Лейдига. Роль внутриклеточного сигнала действия ЛГ играет цАМФ.
ФСГ
Гликопротеин, продукция ФСГ регулируется гонадолиберином, регулирует синтез и секрецию половых гормонов и гаметогенез, стимулирует секрецию эстрогенов в яичниках.
Пролактин
Белок, продукция пролактина регулируется пролактолиберином, участвует в инициации и поддержании лактации, поддерживает активность желтого тела и продукцию прогестерона, действует на рост и дифференцировку тканей.
β-липотропин
Пептид, действует через цАМФ, оказывает жиромобилизующее, кортикотропное, меланоцитостимулирующее действие, обладает гипокальциемической активностью, оказывает инсулиноподобный эффект.
80. Гормоны гипоталамуса и нейрогипофиза, их химическая структура и влияние на обмен веществ.
Гормоны гипоталамуса •соматолиберин,
•пролактолиберин,•тиролиберин,•кортиколиберин,•люлиберин,
•меланолиберин,•фоллилиберин•соматостатин,•меланостатин,
•пролактостатин.
Гормоны задней доли гипофиза
Вазопрессин и окситоцин синтезируются в нейронах гипоталамуса, связываются с белками нейрофизинами и транспортируются в
нейросекреторные гранулы гипоталамуса, затем вдоль аксона в заднюю долю гипофиза, где происходит пострибосомальная достройка.
Вазопрессин
•стимулятор аденилатциклазы:цАМФ образуется в мембране эпителия почечных канальцев, в результате повышается проницаемость для воды,
•повышает артериальное давление из-за стимуляции сокращения гладкой мускулатуры сосудов,
•способствует уменьшению диуреза из-за воздействия на канальцевый аппарат нефрона, повышения реабсорбции воды.
Механизм действия АДГ
Несахарный диабетвозникает из-за нарушения:
•синтеза,
•транспорта,
•секреции вазопрессина.
При заболевании с мочой теряется до 40 л воды в
сутки, возникает жажда.
Несахарный диабет бывает при атрофии задней доли гипофиза.
Синдром Пархана возникает из-за
повышенной секреции вазопрессина.
•усиливается реабсорбция воды в почках,
•появляются отёки.
Окситоцин
•стимулирует сокращения гладкой мускулатуры матки, гладких мышц кишечника, уретры,
•стимулирует сокращение мышц вокруг альвеол молочных желёз, способствуя молокоотдаче.
Окситоциназа разрушает гормон.
При родах её активность падает в 100 раз.
81. Паратгормон и тиреокальцитонин. Влияние гормонов на обмен кальция и фосфора в организме человека.
Паратгормон
- пептид из 84 аминокислот.
Выделяется при уменьшении содержания кальция в крови.
Органы-мишени: почки, костная ткань
-способствует резорбции кости остеокластами и вымыванию солей кальция в кровь
-снижает экскрецию кальция и повышает экскрецию фосфора почками посредством стимуляции синтеза кальцитриола в почках увеличивает эффективность всасывания кальция в кишечнике.
-В крови при действии паратгормона возрастает концентрация кальция.
Тиреокальцитонин
- пептид из 32 аминокислот
Секретируется клетками щитовидной железы.
Мишень кальцитонина – костная ткань
Кальцитонин способствует:
-отложению кальция и фосфора в кости в результате деятельности остеобластов,
-подавлению резорбции кости (ингибитор остеокластов).
При действии кальцитонина концентрация кальция в крови уменьшается и возрастает в костях.
Х. БИОХИМИЯ БИОЛОГИЧЕСКИХ Жидкостей и тканей
82-83-84. Кровь, биологическая роль в организме. Химический состав плазмы. Белки плазмы крови. Калликреин-кининовая система. Белки свертывающей и антисвертывающей систем крови. Роль Са и витамина К в свертывании крови. Белки плазмы крови, место их синтеза, биологическая роль. Изменения белкового спектра сыворотки крови при различных заболеваниях. Белки "острой" фазы.
Кровь – ткань из форменных элементов и плазмы.
Состав крови: плазма - 55%, эритроциты - 44%, остальные клетки – 1%.
Функции крови дыхательная, транспортная, трофическая, выделительная, регуляторная, защитная, поддержание постоянства внутренней среды организма:
изоосмия – постоянство осмотического и онкотического давления (7,8 – 8,1 атм)
изогидрия – постоянство рН (рН 7,36)
изотермия – постоянство температуры (37-37,5)
изоиония – поддержание ионного состава.
Отличия плазмы и сыворотки крови
•Плазма содержит ряд факторов, которые расходуются в процессе свёртывания и в сыворотке отсутствуют.
•Сыворотка содержит продукты деградации этих факторов свёртывания, а в плазме этих продуктов в норме нет.
В плазме содержится 90% - воды, 10% - сухого остатка
![]()

Калликреин - кининовая система:
Кинины
пептиды,
местные гормоны,
освобождаются из неактивных предшественников (кининогенов), присутствующих в межтканевой жидкости ряда тканей и в плазме крови.
Важнейшие кинины плазмы крови: брадикинин, каллидин, метионил-лизил-брадикинин.
Эффекты кининов:
гипотензивный, повышают проницаемость сосудов,
вызывают боль в заушной области,
увеличивают приток крови к верхней части туловища,
регулируют тонус гладко-мышечных волокон,
передача сигнала в нервном синапсе,
кооперативные эффекты с простагландинами, участие в развитии воспаления.

Схема превращений основных компонентов системы:
В норме кининов мало в крови 3 нг/мл повышаются при шоке, воспалении, сердечно-сосудистых заболеваниях, патологии ЖКТ, опухолях, ожоговой болезни, сепсисе.
Основыные эффекты брадикинина:
вызывает дилатацию резистивных сосудов, снижает артериальное давление,
увеличивает скорость локального кровотока,
повышает проницаемость сосудов микроциркуляторного русла,
обладает прямым сосудорасширяющим эффектом в коронарных сосудах,
увеличивает частоту и силу сердечных сокращений,
инициирует болевые ощущения,
стимулирует выработку эндотелием сосудов соединений (простациклина, монооксида азота),
стимулирует миграцию лейкоцитов в зону воспаления,
стимулирует синтез простагландинов,
обладает инсулиноподобным эффектом.
Функции плазменного каликреина:
атака кининогена и активация БАВ,
активирует плазминоген,
активирует компоненты комплемента,
активирует гемокоагуляцию (XII e XIIA),
активирует фибринолиз,
активирует проренин,
мощный регулятор в образовании кининов и ангиотензинов,
участвует в процессинге БАВ: атриоуретического пептида, опиоидных пептидов,
участвует в обмене ЛПНП,
участвует в выделении протеаз из нейтрофилов.
Регуляция плазменного протеолиза:

Синтез белков:
В печени синтезируются альбумины, фибриноген, 80% глобулинов (все α-глобулины и частично β-глобулины).
В-лимфоциты синтезируют иммуноглобулины.
Макрофаги синтезируют α2-макроглобулины, белки системы комплемента.
Эритропоэтин синтезируется клетками почек.
Катаболизм белков плазмы происходит: в клетках эндотелия капилляров, в мононуклеарных фагоцитах, в клетках почечных канальцев.
Белки плазмы крови 65-85 г/л.
альбумины 37-55 г/л, глобулины 20-30 г/л, фибриноген 2-4 г/л.
Функции белков крови:
1. Регуляция агрегатного состояния крови: свёртывание, фибринолиз, калликреин-кининовая система, система комплемента.
2. Транспортная функция.
3. Защитная функция (антитела).
4. Регуляторная функция.
5. Ферменты.
6. Резерв аминокислот.
7. Поддержание рН крови.
8. Регуляция распределения внеклеточной жидкости.
9. Буферная функция.
10. Поддержание онкотического давления.




Альбумины: (40-50 г/л, 60% от всех белков)
-молекулярная масса – 70 000,
-растворимы в дистиллированной воде, в солях,
-истинные белки, без углеводного компонента,
-синтезируются в печени,
-в норме не проходят через почки.
Функции:
Связывание воды.
Поддерживают онкотическое давление плазмы. Снижение до 3% приводит к отёкам.
Транспорт магния, кальция, билирубина, жирных кислот, лизолецитина, прогестерона, лекарств (антибиотики, сердечные гликозиды).
Обеспечение клеток АМК
Регуляция антиоксидантной активности плазмы
Депо белка в организме.
Запас пластического материала.
Маркер синтетический способности печени
Маркер почечной недостаточности
Маркер недостаточности питания
Негативный белок острой фазы
Снижаются при заболеваниях печени, нарушениях функции ЖКТ, нефротическом синдроме
Преальбумин (0,18 -0,37 г/л)
транспортирует тироксин, витамин А.
• Концентрация преальбумина снижается при циррозе печени, хронических гепатитах.
• Концентрация преальбумина возрастает при нефротическом синдроме.
• Преальбумин – индикатор нарушения белоксинтезирующей функции печени.
Это первый пик на диск-электрофореграмме.
• Молекулярная масса – 21 кДл.
Глобулины (35-45 г/л, 40% от всех белков)
- грубодисперсные белки, не растворимы в воде,
- синтезируются в печени и лимфоидной ткани,
- появляются в моче при грубой патологии печени и почек,
- связаны с небелковым компонентом
- делятся на
1) α1-глобулины (составляют 2-5%)
α1 – антитрипсин (α1-АТ) (2-5 г/л)
гликопротеин,
ингибитор протеиназ: трипсина, химотрипсина, плазмина, калликреина, эластазы.
92% ингибиторной активности плазмы,
синтезируется клетками печени,
содержится в слюне, слезе, бронхиальном и назальном секретах, спинномозговой жидкости, дуоденальном содержимом,
возможны потери через ЖКТ, почки.
Физиологическая роль α1 – АТ
Защита организма от действия протеолитических ферментов эндогенного и экзогенного происхождения: протеиназ крови, тканей, бактерий, грибков.
Сыворотка крови обладает мощным антипротеиназным действием: 1мл сыворотки ингибирует 1 мг трипсина.
При врождённом дефиците α1 – АТ наблюдаются: эмфизема лёгких, цирроз печени, желтуха, холестаз.
Активность α1 – АТ возрастает при воспалениях, механических повреждениях тканей, панкреатите.
При ожоговой болезни снижается активность α1 – АТ, но возрастает протеолитическая активность.
α1 – гликопротеин (орозомукоид) (0,5 -1,4 г/л)
содержит до 40% углеводов,
не осаждается ТХУ (трихлоруксусная кислота),
участвует в транспорте стероидов,
активность возрастает при острых и хронических воспалениях, опухоли,
активность уменьшается при циррозе печени.
иммуномодулятор,
подавляет киллерную активность.
α-фетопротеин относится к α1 – глобулинам.
у доношенного здорового ребёнка не выявляется.
α-фетопротеин повышается при карциномах печени, тератокарциномах.
После удаления карцином исчезает, а при метастазах появляется вновь.
2) α2-глобулины (7-13%)
α2 –макроглобулин
цинксодержащий белок, включающий углеводный компонент (до 11%),
синтезируется вне печени,
составляет 10% всей антипротеиназной активности (ингибирует трипсин, тромбин, химотрипсин, плазмин, калликреин)
Транспортирует ферменты, гормоны, цинк
регулирует свёртывающую, фибринолитическую, калликреиновую систем.
α2 –макроглобулин повышается при: циррозе печени, нефротическом синдроме, микседеме, сахарном диабете
α2 –макроглобулин не меняется при остром воспалении.
α2 –макроглобулин снижается при: парапротеинозах, ревматическом полиартрите, остром панкреатите.
Церулоплазмин
голубой белок,
молекула содержит 8 атомов меди,
в норме концентрация этого белка 0,25-0,45 г/л.
Функции церулоплазмина:
переносчик ионов меди,
основной антиоксидант плазмы, перехватчик,
обладает ферментативными свойствами, осуществляет окисление Fe2+ в Fe3+ ,
увеличивает всасывание железа и способствует включению железа в трансферрин,
активатор гемопоэза,
белок острой фазы,
детоксикационная функция (окисляет диамины и полифенолы),
участвует в обмене адреналина, норадреналина, серотонина,
повышает пероксидазную активность плазмы и бактерицидные свойства крови.
Уровень церулоплазмина повышается при: беременности, остром воспалении, холестазе, ревматоидном артрите, неоплазме.
Уровень церулоплазмина снижается при: циррозе печени, хроническом гепатите, болезни Вильсона-Коновалова
Гаптоглобин (0,0-0,35 г/л)
Молекула белка состоит из двух субъединиц, каждая из которых содержит 4 полипептидные цепи.
Гаптоглобин связывает и транспортирует свободный гемоглобин в клетки ретикулоэндотелия.
Гаптоглобин является ассенизатором. Он связывает гемоглобин, препятствуя гемосидерозу тканей, почек.
Комплекс (Нв+Нр) повышает пероксидазную активность, бактерицидные свойства крови.
В кровотоке свободный гемоглобин и гем комплексируются со специальными белками плазмы: гаптоглобином и гемопексином. Эти комплексы удаляются из крови гепатоцитами.
Уровень гаптоглобина и гемопексина – биохимические маркеры степени внутрисосудистого гемолиза.
Уровень гаптоглобина повышается при воспалении, неоплазме.
Уровень гаптоглобина снижается при поражениях паренхимы печени, гемолитической анемии.
3) β-глобулины (8-14%)
Трансферрин
транспортирует Fe в крови,
2-4 г/л сыворотки,
уровень снижается при воспалении, нефротоксическом синдроме, заболеваниях печени или опухолях.
Гемопексин
связывает гем, порфирин и гемосодержащие хромопротеины, доставляя их в печень.
В печени распад комплексов гемопексина, где железо повторно используется.
Функция - уменьшение потери железа с мочой.
Снижен гемопексин при: гемолитической анемии, заболеваниях печени, нефротическом синдроме, экссудативной энтеропатии, поздней кожной порфирии.
Увеличен гемопексин при: воспалительных заболеваниях, опухолях, неоплазме.
Стероид-связывающий β-глобулин
гликопротеин,
увеличен при: опухолях, циррозе печени, беременности.
СРБ (С-реактивный белок)
синтезируется в печени (1-10 мг/сут) и клетками иммунной системы,
в 1000 раз увеличивается при острой фазе,
белок острой фазы,
ингибитор агрегации тромбоцитов,
неспецифический опсонин,
активирует комплемент,
связывает фосфатидилхолин, поликатионы, полианионы, липиды, углеводы,
участвует в формировании гемопротеинов и каталазы,
способен связывать компоненты микроорганизмов, токсинов, частиц повреждённых тканей, препятствуя их распространению.
СРБ – пентамерный белок, печеночного происхождения, в норме менее 5мг/л.
Способен преципитировать пневмококковый полисахарид С.
Преимущества СРБ для клинической практики
быстрое увеличение в первые 6-12 часов, максимальное – на 2-3 сутки,
возрастает в сотни раз,
отсутствие изменений при вирусной инфекции,
быстрая нормализация уровня,
простота и доступность определения.
СРБ назван так, потому что взаимодействует с С-полисахаридом пневмококков.
4) γ-глобулины (12-22%)
Включают в себя антитела, вырабатываемые организмом в ответ на введение чужеродных белков или других веществ с антигенной активностью.
Выделяют 5 классов иммуноглобулинов: Ig G, Ig A, Ig D, Ig M, Ig E.
Основу молекулярной структуры Ig составляют 4 полипептидные цепи: 2 тяжёлые и 2 лёгкие, соединённые дисульфидными мостиками.
Ig G
составляют 75% всех Ig,
поздние антитела,
синтезируются активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм
Ig A
составляют 10-15% всех Ig,
отвечают за местный иммунитет слизистых оболочек,
присутствуют в секретах желёз организма (слюна, молоко, пищеварительный сок, секреты дыхательных путей).
Ig E
связываются с рецепторами на поверхности тучных клеток и базофилов. После присоединения антигена клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина).
Увеличение количества Ig E может предшествовать развитию аллергических реакций.
Ig D – рецепторы В-лимфоцитов.
Ig M имеет 2 формы:
мембранно-связанная форма Ig M – первый антиген-распознающий рецептор,
секреторная форма Ig M.
Активированная система комплемента вызывает гибель бактериальной клетки.
Ig M – ранние антитела.
Фибриноген (2-4г/л)
растворимый гликопротеин плазмы,
синтезируется в печени,
молекулярная масса 34000,
молекула состоит из 6 полипептидных цепей,
повышает вязкость крови,
активирует свёртывание.
Из фибриногена образуется фибрин, который заполняет повреждённую ткань, защищает от действия протеиназ.
Фибриноген (тромбин) фибрин + фибринопептиды
Фибринопептиды обладают противовоспалительным действием.
Фибрин – нерастворимый белок.
Продукты деградации фибриногена обладают антисвёртывающим действием.
Тромбин – сериновая протеаза с молекулярной массой 34000, состоит из двух полипептидных цепей.
Является плазменным фактором гомеостаза
Снижается в крови при усиленном потреблении (ДВС-синдром)
Повышается при остром и хроническом воспалительном процессе, опухолях, системных заболеваниях, нефротическом синдроме
Является маркером риска развития СС заболеваний

Белки острой фазы (БОФ)
Понятие «белки острой фазы» объединяет до 30 белков плазмы крови, участвующих в совокупности реакций воспалительного ответа организма на повреждение.
Белки острой фазы – маркеры повреждения и воспаления.
Их концентрация повышается при воспалении, беременности, онкологических заболеваниях.
Концентрация существенно изменяется и зависит от стадии, течения заболевания, массивности повреждения. Увеличивается в течение первых 24-48 часов.
Белки острой фазы
синтезируются в печени.
являются гликопротеинами по химической природе,
К белкам острой фазы относятся: α1 – гликопротеин, α1 – АТ, церулоплазмин, гаптоглобин, СРП, гемопексин, фибриноген.
Регуляторы синтеза белков острой фазы в печени
ИЛ6 и сходные с ним ИЛ1, онкостатин М,
ИЛ 1 и сходные с ним ИЛ- α, ИЛ-1β, факторы некроза опухолей,
глюкокортикоиды,
факторы роста, инсулин, факторы роста гепатоцитов, фибробластов, тромбоцитов.
Особенности белков острой фазы
неспецифичность,
высокая корреляция концентрации в крови с активностью заболевания, стадией процесса.
Тест на белки острой фазы важен для мониторинга течения заболевания и контроля эффективности лечения.
Классификация БОФ по степени увеличения их концентрации
1. «Главные» реактанты острой фазы.
Увеличение концентрации в 100-1000 раз в течение 6-12 часов.
СРБ,
амилоидный белок А сыворотки.
2. Умеренное увеличение концентрации в 2-5 раз в течение 24 часов.
орозомукоид,
α1-антитрипсин,
гаптоглообин,
фибриноген.
3. Незначительное увеличение концентрации на 20-60% в течение 48 часов.
церулоплазмин,
С3-комплемент,
С4-комплемент.
4. Нейтральные реактанты острой фазы – белки, принимающие участие в острой фазе воспаления, а концентрация их остаётся в пределах нормы.
Ig G, Ig A, Ig M,
α2 –макроглобулин.
5. «Негативные» реактанты острой фазы. Уровень может снижаться на 30-60% в течение 12-48 часов.
альбумин,
трансферрин,
преальбумин,
α-липопротеин.
Компоненты свертывания:
Компоненты системы свертывания крови принято называть факторами.
Факторы бывают тканевыми, плазменными (12 факторов) и тромбоцитарными (около 30). Тканевые и плазменные факторы обозначаются римскими цифрами, а тромбоцитарные - арабскими.
Если фактор является активным, то за цифрой ставится буква "а". Например, переход неактивного двенадцатого фактора в активный можно обозначить так: фXII --------> фXIIa
(неактивный) (активный).
Большинство белков системы свертывания крови обладает ферментативной активностью.
6 плазменных факторов (II, VII, IX, X, XI, XII) и калликреин являются сериновыми протеиназами, которые катализируют реакции ограниченного протеолиза.
В ходе реакций свертывания крови все белки-ферменты сначала выступают в роли субстрата, а затем - в роли фермента.
Два белка (фV и фVIII), не обладают ферментативной активностью, но специфически ускоряют протекание ферментативной реакции (кофакторы, белки-регуляторы). Обеспечивают связывание активных факторов и их субстратов с фосфолипидами (↑ актив. в сотни тыс. раз).
Система свертывания — это разветвленная сложная мультиферментная система, работающая по принципу каскадности (усиление первично слабого сигнала), направленная на превращение фибриногена в фибрин, который является основой кровяного сгустка.
Два механизма свертывания крови
Внешний механизм - запускается с участием тканевого (тромбопластин) фактора – появляется при повреждении тканей.
Внутренний - при участии факторов, содержащихся в крови, начинается с контактной активации ф.XII и прекалликреина.
Различаются эти механизмы только начальными стадиями до активации протромбина (ф.II). Последующие стадии протекают одинаково.
Тромбин обеспечивает превращение фибриногена в фибрин и активирует ф.ХIII, стабилизирующий фибрин.
от фибриногена (ф.I) отщепляются пептиды, получившие название пептидов А и В, причем фибриноген превращается сначала в фибрин–мономер, а лишь затем в фибрин – полимер (сгусток).
Фибриноген тромбин Фибрин-мономер + пептиды А и В
фибрин–мономер полимеризация Фибрин-полимер (сгусток)
Различаются эти механизмы только начальными стадиями до активации протромбина (ф.II). Последующие стадии протекают одинаково.
Тромбин обеспечивает превращение фибриногена в фибрин и активирует ф.ХIII, стабилизирующий фибрин. От фибриногена (ф.I) отщепляются пептиды, получившие название пептидов А и В, причем фибриноген превращается сначала в фибрин–мономер, а лишь затем в фибрин – полимер (сгусток).
Через некоторое время фибриновый гель сжимается, из него выдавливается значительное количество сыворотки крови и остается более полный сгусток, состоящий из форменных элементов крови и фибрина
Система противосвертывания:
Естественные антикоагулянты синтезируются в тканях и поступают в кровь, где препятствуют акти-вации факторов свертывания крови. К ним относятся гепарин, антитромбин-III, α-2-макроглобулин и другие (всего 11).
Процесс тромбообразования постоянно контролируется антитромбином III - ингибитором сериновых протеиназ.
Гепарин значительно активирует антитромбин-III.
α-2-макроглобулин - ингибитор протеаз, в том числе многих ферментов, участвующих в работе системы свертывания крови и фибринолиза (тромбин, плазмин).
Плазмин - сериновая протеиназа, способна гидролизовать фибрин, фибриноген и др. на отдельные пептиды.
Плазмин образуется из плазминогена под действием активатора плазминогена.
Тканевой активатор плазминогена неактивен до тех пор, пока не вступит в контакт с фибрином. Когда фибрин будет гидролизован плазмином, активатор плазминогена теряет свою активность
Роль витаминов К и Са:
При дефиците вит. К нарушается образование в гепатоцитах карбоксилазы и, соответственно, конечный этап синтеза (карбоксилирование) факторов свертывания II, VII, IX, X. Нарушается также синтез двух антикоагулянтов: протеина С и протеина S.
Ионизированный кальций участвует в следующих процессах:
1. молекулярной конформации факторов свертывания в активную форму;
2. Фиксации взаимодействующих факторов на фосфолипидных матрицах;
3. Ускорение активации отдельных факторов (трансформация протромбина в тромбин ускоряется Ca++ в 1000 раз при присоединении его к γ-карбоксиглутамиловому остатку в амино-конце молекулы).
85. Ферменты крови. Энзимодиагностика.
1. Экскреторные – продукты жизнедеятельности тканей (ЩФ, ЛАП, ГГТ)
2. Секреторные (плазмоспецифические) – вырабатываются печенью и выделяются в кровь. (Ферменты свертывающей и противосвертывающей системы крови, ХЭ).
3. Индикаторные (клеточные) – выходят из клеток в кровь при цитолизе.
Специфические – вырабатываются в определенных органах (Аргиназа, ГлДГ)
Неспецифические – многими органами (АЛТ, АСТ, ЛДГ, КК, …).
Дигностическое значение ферментов:
Щелочная фосфатаза (ЩФ) – присутствует во всех органах человека. Выделено 11 изоферментов.
Высокая концентрация в растущих костях, гепатоцитах, плаценте, эпителии тонкой кишки и канальцев почек. ЩФ – маркер остеобластов
Повышение при:
Опухолях костей, рахите, остеомаляции
Закупорке желчных протоков, новообразованиях печени
Беременности
Снижение при гипотиреозе и замедленном росте у детей.
Лактатдегидрогеназа (ЛДГ) – во всех тканях организма (5 изоферментов).
ЛДГ1 – окисление лактата в пируват в тканях с высоким уровнем аэробного обмена (миокард, мозг, почки, эритроциты).
ЛДГ5 – превращение пирувата в лактат в тканях с высоким уровнем гликолиза (скелетные мышцы, печень).
ЛДГ3 – в лимфоидной ткани, тромбоцитах.

Глутаматдегидрогеназа (ГлДГ) – органоспецифичный, митохондриальный фермент печени.
Используется как критерий выздоровления – активность приходит в норму быстрее, чем морфологическая нормализация гепатоцитов.
Амилаза – образуется в поджелудочной и слюнной железах.
Повышение – при воспалении или закупорке протоков этих желез (пакреатит, паротит).
Энзимодиагностика - определение активности фермента.
Изоферменты ЛДГ органоспецифичны
ЛДГ5 - характерен для ткани, в которой анаэробные процессы.
ЛДГ1 - для ткани, в которой аэробные процессы.
В инфаркте миокарда кровь из сердца выходит с ЛДГ1, при заболеваниях печени - ЛДГ4 , ЛДГ5, при патологиях лёгких ЛДГ3.
АСТ - имеет двойную локализацию (митохондрии и цитоплазма)
АЛТ - локализуется только в цитоплазме.
Активность АЛТ увеличивается при заболеваниях печени. Активность АСТ увеличивается при инфаркте миокарда.
Коэфициент Де Ритиса <1 при патологиях печени – АСТ/АЛТ = 1,75
Активность щелочной фосфатазы увеличивается при рахите, механической желтухе и патологии костной ткани.
Активность кислой фосфатазы увеличивается при раке простаты.
Активность амилазы увеличивается при патологии слюнных желез и остром панкреатите.
Также при остром панкреатите Увеличена активность: амилаза крови и мочи, липаза, фосфолипаза, трипсин, химотрипсин.
А при гепатите Увеличена активность: АЛТ, АСТ, ЛДГ4,5, сорбитолдегидрогеназа.
Коэффициент де Ритиса <1
Лечение ферментами
86. Изогидрия. Механизмы поддерживания изогидрии. Ацидоз и алкалоз.
Изогидрия – постоянство рН, обусловленное действием буферных систем и физиологическим контролем.
В норме кислотно-основной баланс поддерживается тремя механизмами:
Буферные системы
Респираторный контроль CO2
Почечная компенсация
Буферные системы организма устраняют сдвиги рН: бикарбонатная, фосфатная, белковая, гемоглобиновая.
Физиологические механизмы восстанавливают и буферную ёмкость.
Ацидоз – избыточное содержание анионов кислот.
Компенсированный ацидоз – закисление без сдвига рН.
Некомпенсированный ацидоз – сдвиг рН в кислую сторону (при рН<6,8-смерть).
Газовый ацидоз –увеличение концентрации углекислоты и повышение парциального давления углекислого газа в крови, гиперкапния.
Развивается при уменьшении легочной вентиляции, при вдыхании воздуха с высокой концентрацией углекислого газа:
пребывание в непроветренном помещении,
при воспалительных процессах в лёгких,
при неправильном проведении искусственного дыхания.
Метаболический ацидоз – избыточное накопление кислот в организме.
Кетоацидоз – неполное окисление жиров и избыточное накопление ацетоновых тел при диабете, голодании.
Лактоацидоз – при усиленной физической работе, гипоксиях, кардиогенном шоке, тяжёлых поражениях печени, длительных лихорадочных состояниях, инфекциях.
Азотемический ацидоз – в крови и тканях в избытке накапливаются фосфаты, сульфаты, анионы органических кислот (при уремии).
При избыточном экзогенном введении органических кислот в организм (при отравлении уксусной кислотой, бесконтрольном приёме салицилатов, соляной кислоты).
Кишечный ацидоз - избыточная потеря HCO3- через почки или ЖКТ.
Диабетический кетоацидоз:
Анализ крови при кетоацидозе
pH = 7.15 Глюкоза = 22 ммоль/л, cHCO3- = 10 ммоль/л, cK+ = 2.5 ммоль/л.
Проведена терапия: инсулин Жидкость и калий, восполнение потерь Бикарбонат, нормализация pH Уровень глюкозы в крови определяется каждые 1-2 часа в комбинации с pH, электролитами и газами крови.
При метаболическом ацидозе:
снижаются стандартные бикарбонаты плазмы (щелочной резерв крови), так как кислоты вытесняют из гидрокарбонатов угольную кислоту,
увеличивается кислотность мочи и концентрация аммиака в моче.
Алкалоз- нарушение КЩР, при котором в крови увеличена концентрация катионов и снижена концентрация Н.
Компенсированный алкалоз – рН в крови в норме.
Некомпенсированный алкалоз – рН >7,45.
Различают:
газовый алкалоз,
метаболический алкалоз.
Газовый алкалоз:
вызывается повышенным выделением углекислого газа с выдыхаемым воздухом (гипервентиляционный), следствием чего является снижение парциального давления углекислоты,
сочетается со снижением концентрации кальция в крови, в результате чего возникает тетания,
снижение концентрации калия приводит к нарушениям сердечного ритма.
Причины газового алкалоза:
Стимуляция дыхательного центра
при энцефалитах, истерии, опухолях, сильном плаче у детей,
при отравлениях салицилатами,
под влиянием лекарств – возбудителей дыхательного центра (теофиллин, лобелин),
Рефлекторная стимуляция дыхательного центра при
горной болезни,
заболеваниях лёгких, икозах у детей (гипервентиляционный синдром
Метаболический алкалоз – в крови накапливаются основания, дефицит ионов водорода.
Причины:
чрезмерные потери желудочного сока, сопровождающиеся рвотой (гастритический алкалоз при пилоростенозе),
повышенное выделение ионов водорода, обусловленное гипокалиемией (при приёме диуретиков),
избыточное введение в организм солей щелочных металлов (при питье минеральных вод).
При метаболическом алкалозе:
увеличена концентрация HCO3-,
увеличен ВЕ,
снижена кислотность мочи,
уменьшается содержание аммиака в моче.
87. Особенности обмена веществ в эритроцитах. Эритроцитарные энзимопатиитии. Синтез гема. Порфирии.
Химический состав эритроцита:
65% - вода
33% - гемоглобин
2% - негемоглобиновые белки, липиды, глутатион, 2,3-дифосфаглицерол.
Ферменты эритроцитов:
Все ферменты гликолиза и пентозного цикла
Аденилатциклаза
СОД супероксиддисмунтаза
Кислая фосфатаза
Аденозиндезаминаза
АЛТ аланиламинотрансфераза
Каталаза
Ферменты антиоксиданты: Супероксиддисмутаза, Каталаза, Нероксидаза, Глутатионпероксидаза, Глутатионредуктаза
Глутатион
трипептид γ-глутамилцистеинилглицин (GSН) является основным антиоксидантом эритроцитов.
Глутатион — самое распространенное сульфгидрильное соединение в клетках. Окисленный глутатион восстанавливается флавопротеином глутатионредуктазой. Две молекулы восстановленной формы (GSH) при окислении образуют дисульфид (GSSG).
В окисленной форме глутатион - гексапептид (GSSG)
Эритроцитарные энзмопатии характеризуются:
Недостаточностью Г-6-ФДГ в эритроцитах
возникает из-за замены аминокислоты в структуре фермента,
1/20 человечества имеет этот дефект,
чаще встречается у мужчин,
возникают острые гемолитические кризы и гемолитическая анемия.
Г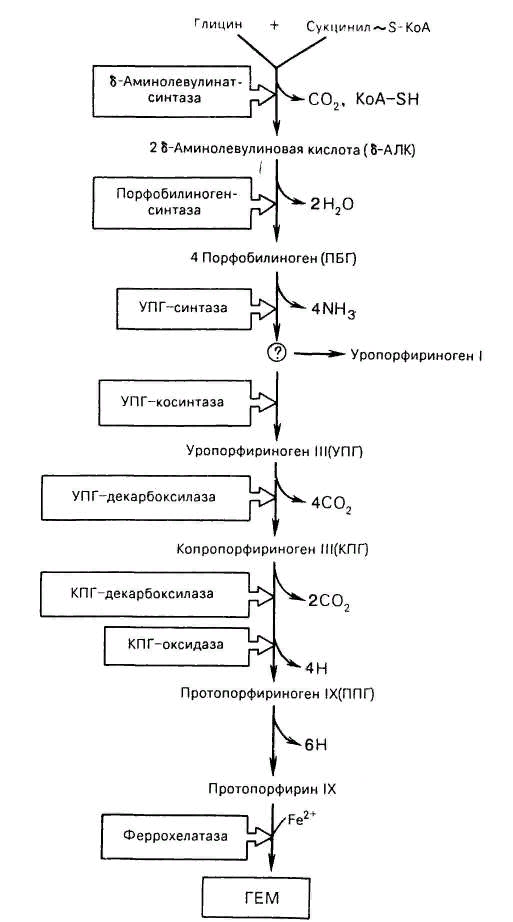 ем
ем
• Гем - это соединение циклического тетрапиррола – порфирина с железом.
• Атом железа имеет 6 связей: четыре – с атомами азота пиррольных колец, пятая – с гистидином, шестая – для связывания с кислородом.
Биосинтез гема: справа
Регуляция синтеза гема
Синтез гема - энергозависимый процесс.
Стимуляторы синтеза: ионы железа, Cu2+, витамин В12.
δ-Аминолевулинатсинтаза активируется стероидами и ингибируется гемом.
Эритропоэтин стимулирует синтез ферментов образования гема.
Порфирины
Пигменты порфирины синтезируются в ходе образования хромопротеинов (гемоглобина).
Выделяются с мочой, калом, желчью.
В норме с мочой выделяется 150 мкг порфиринов в сутки.
Порфиринурия – увеличенное выделение порфиринов с мочой.
Первичные порфирии - врождённые расстройства синтеза гема, обусловленные недостаточностью фермента, участвующего в его образовании.
Болезнь Гюнтера – врождённая порфирия: блок синтеза гема.
С мочой выделяются уро- и копропорфирины.
Клинические проявления: красная моча, розовые зубы, фотодерматоз, гемолитическая анемия, спленомегалия.
Острая порфирия – блок превращения порфобилиногена в полипирролы. С мочой выделяются порфобилиноген и аминолевулинат.
Клинические проявления: острые приступы с абдоминальными и неврологическими симптомами.
Вторичные порфиринурии возникают при циррозе печени, болезнях крови, аллергиях.

88. Гемоглобин, его структура, виды, синтез. Гемоглобинозы.
Гемоглобин – глобулярный белок, железосодержащий хромопротеин.
В состав гемоглобина входят 574 аминокислоты.
Молекулярная масса гемоглобина – 64500.
Гемоглобин состоит из 4 цепей белка глобина и четырёх гемов.
Среднее содержание гемоглобина в эритроците отражает показатель MHC=Гемоглобин/RBC (норма 26-34 пг)
Глобин - белок типа альбуминов,
• синтезируется в нормобластах
• состоит из четырёх полипептидных цепей: 2α -цепи по 141 АМК, 2β -цепи по 146 АМК.
• содержит много гистидина.
Первичная структура – последовательность АМК, соединённых пептидной связью.
Вторичная структура – ἀ-спираль. Спирализованные неподвижные участки (70%) прерываются подвижными неспирализованными.
Третичная структура – глобулярный белок.
Четвертичная структура – белок состоит из 4х полипептидных цепей, уложенных относительно друг друга. С каждой цепью связан один гем.
Гемоглобин имеет 4 специфических центра связывания: с кислородом, с ионами водорода, с С02, с 2,3 – дифосфоглицератом.
2,3 – дифосфоглицерат образуется из глюкозы.
2,3 –ДФГ снижает сродство гемоглобина к кислороду, так как сам присоединяется к гемоглобину.
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++).
У мужчин в крови содержится 157 ммоль/л (140—175) гемоглобина, у женщин — 138 (123—153) ммоль/л.
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA1 – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
В крови взрослого содержатся 3 вида гемоглобина:
HbA1– 96%,
HbA2– 2,5%,
HbF – 1,5%.

-Гемоглобинопатии (гемоглобинозы) — группа наследственных гемолитических анемий, обусловленных нарушениями первичной структуры гемоглобина (качественные гемоглобинопатии) или синтеза глобиновых цепей (количественные гемоглобинопатии).
Гемоглобинопатии – болезни, в основе которых лежит наследственное изменение структуры цепи нормального гемоглобина.
Серповидно-клеточная анемия – результат мутации.
В HbS глу в шестом положении с N-конца заменена на валин в β-цепях гемоглобина.
Эритроциты приобретают форму серпа.
Возникает стаз крови, гемолиз.
Талассемия – генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина
Различают : α-, β-, γ- талассемии.
Болезнь Кули (β- талассемия)
• гемолитическая анемия,
• нарушен синтез гема и метаболизм железа,
• снижено количество НbА1,
• повышено количество НbА2 и HbF.
89. Распад гемоглобина. Образование билирубина и продуктов его обмена.Характеристика прямого и непрямого билирубина. Классификация желтух. Диагностическое значение определения прямого и непрямого билирубина.
Срок жизни эритроцита – 120 дней
В сутки у человека обновляется 6 г Нb.
Распад гемоглобина происходит в микросомальной фракции ретикулоэндотелиальных клеток печени, селезенки и костного мозга.
Распад гемоглобина в тканях
Гем (в составе гемоглобина) (гемоксигеназа) Гем (в составе вердоглобина)
Вердоглобин глобин + Fe2+ + биливердин
Биливердин + НАДФН2 (биливердинредуктаза) билирубин + НАДФ


Билирубин
• Билирубин (лат. bilis желчь и ruber красный) желчный пигмент желто-красного цвета
• Молекулярная масса 548,68
• Билирубин представляет собой ромбические кристаллы коричневого цвета
В сутки образуется 250-350 мг билирубина.
Свободный билирубин является желчным пигментом, образуемым в момент распада гемоглобина и разрушения эритроцитов.
Непрямой (свободный, неконъюгированный) билирубин:
нерастворим в воде,
хорошо связывается с липидами,
токсичен,
даёт непрямую реакцию с диазореактивом Эрлиха (после обработки сыворотки крови спиртом),
связан с альбумином.
Токсичность непрямого билирубина:
- снижает потребление кислорода,
- повреждает мембраны,
- снижает активность дегидрогеназ,
- замедляет пробег электронов,
- разобщитель.
Свободный билирубин может проникать через гематоэнцефалический барьер, что приводит к токсической энцефалопатии.
Транспорт биллирубина
1 г альбумина связывает 15-16 мг билирубина.
Нарушение связи с альбумином вызывают: лекарственные препараты (салицилаты, сульфаниламиды, кофеин, морфин), ацидоз.
Метаболизм билирубина в печени
Этапы:
• поглощение билирубина клетками печени,
• конъюгация билирубина с УДФ-глюкуроновой кислотой,
• секреция билирубина в желчь.
Прямой (связанный с глюкуроновой к-той, коньюгированный) билирубин:
поступает из печени в желчный пузырь,
растворим в воде,
нетоксичен,
реагирует с диазореактивом прямо,
сразу выделяется с мочой,
легко проходит через мембраны,
Метаболизм прямого билирубина
• В кишечнике под действием бактериальных ферментов происходит гидролиз глюкуронидов. Из билирубина образуется уробилиноген.
• В норме большая часть бесцветных уробилиногенов в толстом кишечнике под действием микрофлоры окисляется в стеркобилин.
• Часть уробилиногена снова всасывается и попадает в печень через воротную вену, где расщепляется до дипирролов.
• Часть уробилиногена всасывается в кишечнике через геморроидальные вены в общий кровоток и выделяется с мочой в виде пигмента уробилина. В норме выделяется 0 - 4 мг уробилина в сутки.
• При патологии (болезни печени, гемолиз) происходит накопление непрямого билирубина. Уробилин мочи увеличен при гемолитической желтухе, а при паренхиматозной желтухе в моче увеличен уробилиноген.
В норме содержание общего билирубина в крови 1,7-20,5 мкмоль /л:
25% от общего билирубина в крови приходится на прямой билирубин (0,96-5,1 мкмоль /л).
75% от общего билирубина составляет непрямой билирубин (1,7-17,1 мкмоль /л).
Желтухи
Желтухи являются одним из ярких синдромов многих заболеваний печени, внепеченочных желчных протоков и поджелудочной железы. В их основе лежат нарушения обмена желчных пигментов.
Истинные желтухи, связанные с гипербилирубинемией (свыше 30-35 мкмоль/л)
Норма: 8,5-20,5 мкмоль/л
Ложные желтухи: лекарства, пищевые красители, морковь, тыква.
Синдром «желтуха» (icterus) включает:
• Желтое окрашивание кожи, склер, слизистых
• Зуд
• Гипербилирубинемию
• Изменение окраски кала и мочи
Источники образования билирубина
• 70-80% - гемоглобин «старых» эритроцитов
• 15% - неэффективный эритропоэз
• 15%
- гемсодержащие соединения неэритроцитарного
ряда (миоглобин, цитохромы)
15%
- гемсодержащие соединения неэритроцитарного
ряда (миоглобин, цитохромы)
Классификация желтух:
Гемолитическая:
Возникает при:
врождённых и приобретённых гемолитических анемиях,
интоксикациях ядами, фосфором, лекарствами,
переливании крови.
У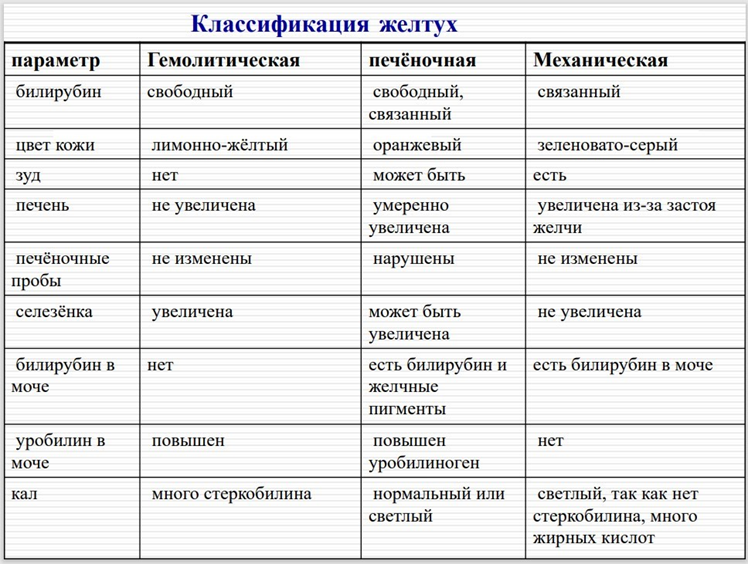 силен
распад эритроцитов.
силен
распад эритроцитов.
Способствуют развитию гемолитической желтухи
• Наследственные эритроцитарные энзимопатии и гемоглобинопатии;
• Врожденная микросфероцитарная гемолитическая анемия (болезнь Минковского-Шоффара);
• Серповидно-клеточная анемия;
• β-Талассемия;
• Гемолитическая болезнь новорождённых (конфликт антигенов ребенка и матери в системе AB0 или резус-фактор);
• Несовместимость антигенов донора и реципиента при гемотрансфузии;
• Укус ядовитой змеи;
• Отравление химическими ядами.
Печеночная:
Возникает при:
вирусных гепатитах,
токсическом поражении печени,
циррозах,
паразитарных заболеваниях печени.
Клинические проявления:
цитолиз,
сообщения между желчными путями, кровеносными сосудами,
повреждения стенок желчных ходов,
тромбы – препятствия для желчи.
Механическая:
Возникает при:
опухолях,
желчнокаменной болезни.
Клинические проявления:
увеличение правой почки,
рубцовые тяжи,
препятствия оттоку желчи, поступившей из печени в желчные протоки
увеличении правой почки,
рубцовых тяжах,
препятствиях оттоку желчи, поступившей из печени в желчные протоки.
90. Биологическая роль печени. Роль печени в обмене углеводов, липидов, аминокислот и белков. Антитоксическая функция печени.
Роль печени в углеводном обмене:
Печень – депо гликогена.
Печень обеспечивает постоянный уровень глюкозы в крови, регулируя соотношения между синтезом и распадом гликогена.
В печени протекают:
гликолиз,
гликогенолиз,
глюконеогенез,
гликогеногенез,
превращение фруктозы и галактозы в глюкозу,
синтез гепарина.
Роль печени в липидном обмене:
В печени осуществляется:
синтез желчных кислот (желчь необходима для переваривания и всасывания липидов),
синтез фосфолипидов (при дефиците АТФ и липотропных факторов фосфатидная кислота используется для синтеза нейтрального жира),
синтез холестерина (98%), его этерификация,
синтез ЛПВП,
синтез жирных кислот,
липолиз,
кетогенез,
распад фосфолипидов.
Роль печени в белковом обмене:
В печени протекает:
синтез белков (за сутки обновляется около 9 % собственных белков, 1/4 альбуминов плазмы):
альбуминов плазмы,
80 % a-глобулинов,
50 % b-глобулинов,
ряда ферментов, аминокислот.
трансаминирование и окислительное дезаминирование аминокислот,
синтез мочевины и мочевой кислоты,
синтез холина, креатинина,
синтез протромбина, фибриногена, проакцелерина.
Антитоксическая роль печени:
В печени происходит синтез мочевины (обезвреживание аммиака).
Путем образования парных соединений с ФАФС или глюкуроновой кислотами обезвреживаются:
продукты гниения аминокислот в кишечнике: индол, скатол, фенол, крезол, билирубин (путем образования моно- и диглюкуронидов), стероидные гормоны (в виде глюкуронидов).
Образование парных соединений в печени протекает также с участием гликокола и таурина:
желчные кислоты находятся в желчи в виде соединений с гликоколом и таурином,
бензойная кислота, соединяясь с гликоколом, превращается в гиппуровую кислоту.
При участии моно- и диаминоокисидаз (МАО, ДАО) в печени происходит окислительный распад - адреналина и гистамина.
Функции печени:
Метаболическая
Обмен липидов Обмен углеводов Обмен белков и аминокислот
Депонирующая
Депо гликогена (до 20% массы печени) Депо минеральных веществ Депо витаминов A, D, K, B12 и фолиевой кислоты
Экскреторная
вещества эндо- и экзогенного происхождения через желчные протоки выводятся с желчью (более 40 соединений), либо попадают в кровь, откуда выводятся почками
Гомеостатическая
синтез, накопление и выделение в кровь различных метаболитов
поглощение, трансформация, экскреция компонентов плазмы крови
Детоксикационная
Трансформация и инактивация: стероидных гормонов, этанола, лекарств, билирубина
91. Биохимический состав нормальной и патологической мочи.
Нормальные компоненты мочи:
Органический компонент:
Небелковые азотистые вещества
мочевина (↑ при усиленном распаде белков – голодание, ожоги, травмы; ↓ при нарушении фильтрации плазмы в клубочках);
мочевая кислота (↑ при избытке в пище нукл. кислот, заболеваниях с усиленным распадом клеток, повышенном синтезе пуринов);
креатинин (выводится пропорционально мышечной массе);
креатин (у детей, подростков, беременных. Креатинурия взрослых при заболеваниях мышц, переохлаждении тела, судорожных состояниях).
аминокислоты («следовые» кол-ва, ↑ при ускоренном распаде белков, нарушение реабсорбции в почечных канальцах);
Неорганический компонент:
В моче содержатся практически все минеральные вещества, которые входят в состав крови и других тканей организма.
катионы (K+, Na+, Ca2+, Mg2+, NH4+);
анионы (Cl−, SO42−, НРО42−);
другие ионы (в малых количествах).
Изменения наблюдаются при нарушениях водно-солевого и минерального обмена (гипофункция надпочечников, гиповитаминоз D, …)
Патологические компоненты мочи:
1. Белок. Протеинурии при заболевании почек:
Клубочковые – (гломерулонефрит)
Селективная протеинурия (избирательная, в моче белки с небольшой М.М. – альбумины)
Неселективная протеинурия – в моче появляются и глобулины (грубое поражение почек)
Канальцевые – тубулопатии – белки с небольшим М.М. (α-амилаза, α2-микроглобулины, инсулин, лизоцим). При отравлении солями тяжелых металлов (ртуть, свинец), нефротоксическими ядами, при отторжении пересаженной почки.
Смешанные.
2. Глюкоза. Глюкозурия.
Почечная – при поражении почечных канальцев и нормальном уровне глюкозы в крови.
Внепочечная – при гипергликемии (СД, ЧМТ …), превышение почечного порога (≈ 9,2 ммоль/л).
3. Кетоновые тела. Кетонурия. При СД, голодании.
4. Кровь. Гематурия при гломерулонефрите, почечных камнях; сепсис, ожоги.
5. Билирубин. Билирубинурия. Выделение с мочой прямого билирубина при механической (Зеленовато-желтый) и паренхиматозной желтухе + уробилиногенурия (желто-бурый цвет мочи - цвет пива)
6. Креатин. Креатинурия. Появляется при превышении в крови его почечного порога.
При мышечных дистрофиях, травме мышц, после хирургических операций.
7. Порфирины. Порфиринурия (розовая моча)
8. Гомогентизиновая кислота. Алкаптонурия (черная моча). Гомогентизиновая кислота
Меланин (меланурия)
Повышение относительной плотности мочи (> 1030 г/л):
глюкоза в моче при неконтролируемом сахарном диабете;
белок в моче (протеинурия) при гломерулонефрите, нефротическом синдроме;
лекарства и (или) их метаболиты в моче;
малое употребление жидкости;
большие потери жидкости (рвота, понос);
токсикоз беременных;
олигоурия.
Снижение относительной плотности мочи (<1010 г/л):
несахарный диабет (нефрогенный, центральный или идиопатический);
хроническая почечная недостаточность;
острое поражение почечных канальцев;
полиурия (в результате приема мочегонных, обильного питья).
Патологический цвет мочи:
Желто-оранжевый цвет - Прием витаминов группы В, фурагина
Красный цвет - Наличие эритроцитов в моче, присутствие гемоглобина, порфирина, миоглобина (Почечная колика, инфаркт почки, травма)
Цвет "мясных помоев" Гематурия (измененная кровь) Острый гломерулонефрит
Темно-бурый цвет Уробилинурия Гемолитическая анемия
Красно-коричневый цвет - Прием метронидазола, сульфаниламидов, препаратов на основе толокнянки. Отравление фенолами.
Черный цвет Гемоглобинурия Гомогентизиновая кислота Меланин (меланурия) Меланома
Цвет пива (желто-бурый) Билирубинурия + уробилиногенурия (Паренхиматозная желтуха)
Зеленовато-желтый цвет Билирубинурия (Механическая-обтурационная желтуха)
Молочный Хилурия, пиурия Лимфостаз почек, инфекция мочевыводящих путей
Белесоватый цвет. Липурия. Наличие фосфатов или липидов в моче
Бледный, водянистый, бесцветный Низкая концентрация урохромов Несахарный диабет, сниженная концентрационная функция почек, прием диуретиков, гипергидратация
92. Биохимия нервной ткани, ее химический состав, особенности обмена.
Биохимия нервной ткани
Структура нервных клеток
Нервная клетка состоит из: тела клетки (сомы), отростков (аксонов и дендритов), концевых пластинок
С помощью дендритов нейроны воспринимают, а посредством аксонов передают возбуждение. На периферии аксоны покрыты шванновскими клетками, образующими миелиновую оболочку с высокими изолирующими свойствами.
Функции нервной ткани
Генерация электрического сигнала (нервного импульса)
Проведение нервного импульса
Запоминание и хранение информации
Формирование эмоций и поведения
Мышление
Химический состав мозга
На долю головного мозга приходится 2% от массы тела. 25% составляет потребление O2 мозгом в покое от общего потребления его всем организмом. Особенно интенсивно расходуют кислород клетки коры мозга и мозжечка.
Серое вещество головного мозга - тела нейронов.
Белое вещество – аксоны.
В сером веществе 84% H2O, в белом 70%. Белки составляют ½ объёма плотного вещества в сером веществе, в белом 1/3. Липиды составляют больше ½ от сухого остатка в белом веществе и 1/3 в сером.
Белки мозга
40% сухой массы мозга приходится на белки. Более 100 белков выявлено в ткани мозга.
Простые белки
Нейроальбумины (на них 90% от всех белков), нейроглобулины, нейросклеропротеины (в беловом веществе), нейроколлаген, нейроэластины, нейростромины.
Сложные белки
Нуклеопротеины, липопротеины, протеолипиды (липидный компонент преобладает над белковым, сосредоточены в миелине) фосфопротеины, гликопротеины.
Ферменты, выделенные из ЦНС в кристаллическом виде ацетилхолинэстераза и креатинфосфокиназа.
В ткани мозга присутствуют ЛДГ, альдолаза, ГК, МДТ, ГЛДГ, КФ, МАО и др.
До 75% АМК мозга представлены глу, асп и их производными (N-ацетиласпарогиновая, глутамин, глутатион, ГАМК). Много таурина и цистатианина в ткани мозга
К нейропептидам относятся: вазопрессин, окситоцин, панкреатические пептиды, (глюкагон), нейротензины, кинины, ангиотензины, кальцитонин.
Нейромедиаторы
