
- •I. Химия белка
- •Функции белков:
- •5. Классификация и характеристика простых белков (альбумины, глобулины, гистоны, протамины, протеиноиды).
- •1. Альбумины
- •2. Глобулины
- •3.Гистоны
- •4.Протамины
- •5.Протеноиды
- •6. Классификация и характеристика сложных белков (липопротсины, хром-мопротеины, нуклеопротеины, гликопротеины, фосфопротеины).
- •II. Ферменты. Витамины.
- •7. Химическая природа ферментов, Активный и аллостерический центры фермента, их роль.
- •8. Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности.
- •9. Мультиферментные комплексы и изоферменты. Клиническое значение определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •11. Классификация ферментов. Общая характеристика класса оксидоредуктаз. Основные подклассы. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •12. Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •13. Классификация ферментов. Общая характеристика гидролаз. Основные подклассы гидролаз.
- •14. Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных реакций.
- •15. Классификация ферментов. Общая характеристика изомераз и лигаз. Коферменты изомеразных или глазных реакций.
- •16. Классификация витаминов. Причины развития витаминной недостаточности в организме человека. Авитаминозы, гиповитаминозы, гипервитаминозы, Антивитамины.
- •17. Витамин в1, его химическая структура, признаки витаминной недостаточности. Нарушение углеводного обмена при - витаминной недостаточности.
- •18. Витамины pp и в2, их структура, участие в обмене веществ, признаки витаминной недостаточности.
- •19. Витамины с и р, их структура, признаки витаминной недостаточности и влияние на обмен веществ.
- •20. Витамин биотин, их структура, признаки витаминной недостаточности и участие в обмене веществ.
- •21. Витамин b12, и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •22. Витамины а, е, к. Признаки витаминной недостаточности, участие в обмене веществ.
- •23. Витамин d, химическая природа витамина, гормонально-активные формы, участие витамина в обмене веществ. Рахит. Основные пути метаболизма. БиоэнергетическиЙ обмен.
- •24. Понятие об обмене веществ. Катаболизм и анаболизм, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •26. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс - потенциалы ферментных систем. Ингибиторы переноса электронов.
- •27. Окислительное фосфорилирование. Значение и механизм процесса. Расообщение дыхания и фосфорилирования. Свободное окисление. Субстратное фосфорилирование.
- •28. Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
- •29. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •IV. Обмен углеводов.
- •30. Классификация и химическая структура углеводов, их роль в обеспечении жизнедеятельности организма. Переваривание и всасывание углеводов в пищеварительном тракте. Мальабсорбция.
- •32. Структура гликогена и его синтез в клетках печени и мышц. Функциональные отличия гликогена этих тканей. Распад гликогена. Гликогенозы.
- •33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
- •II этап - окислительное декарбоксилирование пвк
- •III этап - Цикл Кребса
- •35. Апотомический путь обмена глюкозы (пентозный цикл). Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
- •36. Глюконеогенез. Основные субстраты и ключевые ферменты процесса. Цикл Кори.
- •38. Патология углеводного обмена. Сахарный диабет. Нарушения углеводного и липидного обменов при этом заболевании.
- •V. Обмен липидов
- •39. Классификация и химическая структура липидов. Роль липидов в обеспечении жизнедеятельности организма.
- •40. Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •41. Холестерин, его биосинтез и биологическая роль. Гиперхолестеринемия. Атеросклероз. Роль липопротеинов в обмене холестерина.
- •1)Наследственная.
- •42. Классификация и химическая структура фосфолипидов. Биологическая роль, переваривание, биосинтез и распад фосфолипидов. Липотропные вещества.
- •43. Переваривание и всасывание липидов, роль желчи в этом процессе. Желчные кислоты. Ресинтез липидов в клетке эпителия кишечника. Транспортные формы липидов. Биологическая роль жировых депо.
- •44. Липолиз триглицеридов в тканях. Окисление глицерина. Биоэнергетика процесса.
- •45. Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жирных кислот с нечетным количеством углеродных атомов и ненасыщенных жирных кислот.
- •46. Синтез жирных кислот. Внутриклеточная локализация, ферменты и коферменты процесса. Биосинтез триглицеридов.
- •47. Образование и распад кетоновых тел. Кетогенез в норме и при патологии.
- •48. Гормональная регуляция липидного обмена. Патология липидного обмена: гиперлипидемии, липоидозы, жировое перерождение печени, ожирение, атеросклероз.
- •3. Конденсация йодтирозинов
- •1. Аминокислоты и их производные:
- •2. Пептиды
47. Образование и распад кетоновых тел. Кетогенез в норме и при патологии.
Кетоновые тела образуются из ацетил-КоА, образующегося при бетта-окислении жиров, синтезируются в митохондриях гепатацитов. Содержание кетоновых тел в крови здоровых людей: 0,8 – 1,2 ммоль/л.
Используются в период голодания мышцами, почками, кишечником, мохгом и нервной тканью. При длительной работе – мышечной тканью.
При голодании и сахарном диабете ацетоацетат декарбоксилируется с образованием ацетона и СО2.
Печень не способна использовать кетоновые тела, т.к. лишена фермента (сукцинил-Ко-А-ацетоацетат-КоА-трансферазы), катализирующего активацию ацетоацетата.
Синтез кетоновых тел




Источники синтеза кетоновых тел: жирные кислоты, кетопластичные АМК.
Избыток ацетил-КоА, высвобожденный при окислении жирных кислот и не использованный печенью, превращается в кетоновые тела, которые переносятся кровью в периферические ткани, где используются в ЦТК.
Кетоновые тела – поставщики топлива для мышц, почек, мозга. Для мозга основным энергетическим субстратом являются глюкоза и кетоновые тела.
Использование ацетоуксусной кислоты

Регуляция
Инсулин активирует синтез жира, тормозит образование ОМГ, ингибирует образование ацетоновых тел,
Глюкагон активирует синтез ацетоновых тел, активирует синтез ОМГ, тормозит синтез жирных кислот за счёт блокады ацетил-КоАкарбоксилазы, усиливает β-окисление, тормозит обмен глюкозы.
Кетонемия, кетонурия наблюдаются при сахарном диабете, голодании, длительной мышечной работе, токсикозе беременных, приёме пищи, богатой жирами.
Развивается метаболический ацидоз.
В мозге новорожденных кетоновые тела потребляются в 3 раза интенсивнее, чем у взрослых. В раннем детстве они используются тканью мозга для синтеза жирных кислот при миелинизации мозга.
Склонность к кетозу повышена у детей в возрасте от 2 до 10 лет, так как снижена концентрация глюкозы и повышена концентрация НЭЖК, нарушен АМК обмен (кетогенные кислоты).
48. Гормональная регуляция липидного обмена. Патология липидного обмена: гиперлипидемии, липоидозы, жировое перерождение печени, ожирение, атеросклероз.
Инсулин
- Способствует синтезу липидов
- Тормозит образование ОМГ
- Ингибирует образование кетоновых тел
-Стимулирует распад глюкозы с образованием ацетил-КоА
-Активирует пентозный цикл, в котором синтезируется НАДФН2
-Активирует ацетил-КоА-карбоксилазу и синтетазу жирных кислот, усиливая синтез жирных кислот
-Стимулирует синтез триацилглицеринов
-Тормозит освобождение жирных кислот в результате активации гликолиза в жировой ткани
-Активирует фосфодиэстеразу цАМФ, что способствует снижению липолиза
-Ингибирует активность тканевой липазы
Простагландины
-Снижают мобилизацию жирных кислот из жировой ткани за счет угнетения аденилатциклазы
-Снижают влияние катехоламинов на аденилатциклазу
Пролактин
-Способствует синтезу липидов в жировой ткани в период грудного вскармливания
СТГ
-Увеличивает мобилизацию жира из жирового депо
-Увеличивает скорость β–окисления жирных кислот
-Увеличивает синтез аденилатциклазы и липазы
Адреналин
-Увеличивает мобилизацию липидов за счет активации аденилатциклазы
Глюкагон
-Активирует синтез ацетоновых тел
- активирует синтез кетоновых тел
- Тормозит синтез ЖК за счет блокады ацетил-КоА-карбоксилазы
- Усиливает бетта-окисление
- Тормозит обмен глюкозы
Тироксин
-Увеличивает окисление жирных кислот и липолиз жира
Половые гормоны
-Тормозят липогенез
АКТГ
-Способствуют синтезу аденилатциклазы
Глюкокортикоиды
-Увеличивают мобилизацию жирных кислот, активируя аденилатциклазу
-Способствует перераспределению жира по «буйволовому типу» ожирения
Дислипидемии (гиперлипидемии) – изменение состава и количества различных липидов в крови
I тип
Гиперхиломикронемия (экзогенная гиперлипидемия) – увеличение уровня хиломикронов в крови даже натощак (кровь как «борщ со сметаной»)
Причина – генетическая недостаточность липопротеидлипазы
В плазме много триглицеринов и хиломикронов
IIa тип
Увеличение уровня холестерина в составе ЛПНП
В крови – гиперхолестеринемия и гипер-β-липопротеинемия, уровень триглицеринов не изменен
Причины – врожденный дефект рецепторов тканей для ЛПНП
IIб тип
В крови увеличивается содержание ЛПНП (холестерина) и ЛПОНП (триглицеринов)
III тип
Эта форма гиперлипидемии проявляется увеличением хиломикрон и ЛППП, поэтому называется ещё дис-бета-липопротеинения. Наиболее частая причина — гомозиготность по одной из изоформ апоЕ — E2/E2, которая характеризуется нарушением связывания с ЛПНП-рецептором. Встречаемость в общей популяции — 0,02 %.
IV тип
Этот подтип гиперлипидемии характерен повышенной концентрацией триглицеридов, поэтому также называется гипертриглицеридемией. Частота встречаемости в общей популяции — 1 %.
V тип
Этот тип гиперлипидемии во многом похож на I тип, но проявляется не только высокими хиломикронами, но и ЛПОНП.
Атеросклероз:
Заболевание, связанное с накоплением холестерина в интиме сосудов с последующей дегенерацией, отложением в очаг поражения солей кальция, фиброзированием очага и тромбозом
Диагностические критерии:
гиперлипидемия,
гиперхолестеринемия
изменение состава и соотношения транспортных форм холестерина (увеличение ЛПНП и уменьшение ЛПНП)
Снижение соотношения фосфолипиды / холестерин
Снижение активности липопротеинлипазы
Уменьшение в составе триацилглицеринов полиненасыщенных жирных кислот и эфиров холестерина
Способствуют развитию атеросклероза: наследственная предрасположенность, гипертония, сахарный диабет, ожирение, стрессы
Ожирение:
Алиментарное – при избыточном питании
Наследственное
Эндокринное
Количество жировых клеток генетически запрограммировано. В результате избыточного питания количество жировой ткани переходит критическую величину, нарушается гормональная регуляция липидного обмена.
Жировые клетки не исчезают, требуют дополнительного питания (глюкозы), увеличивается аппетит
Вероятность ожирения у детей при ожирении одного родителя – 40 – 50%, при ожирении обоих родителей – 70 – 80%
Липоидозы:
Болезнь Гоше – наследственное заболевание, характеризующееся накоплением цереброзидов в клетках РЭС и нервной системы из-за недостатка глюкоцериброзидазы Химическая структура цереброзидов, накапливающихся при болезни Гоше, отличается от нормальной: в них до 70% углеводных компонентов приходится на долю глюкозы, тогда как в норме преобладает галактоза. Клиника – гепатоспленомегалия, поражение ЦНС (гибель нейронов), гипертония мышц, судороги.
Болезнь Нимана-Пика - Это наследственное заболевание, при котором происходит накопление сфингомиелина в мозге, печени, РЭС из-за дефицита сфингомиелиназы. Патогенез болезни Нимана – Пика связывается с нарушением ферментативного синтеза сфингомиелина, в состав которого «ошибочно» включаются жирные кислоты (стеариновая кислота), не свойственные молекуле нормального сфингомиелина. Клиника – через несколько месяцев после рождения развивается гепатоспленомегалия, увеличение лимфотических узлов, задержка психомоторного развития, признаки остеопороза и остеомаляции
Болезнь Тая-Сакса - Это генерализованный ганглиозидоз, обусловленный отсутствием активности фермента β-N-ацетилгексозаминидазы. Накапливаются ганглиозиды в лизосомах нервных клеток, что ведет к гибели нейронов. Клиника – умственная отсталость, слепота, гипотония, судороги, параличи
Болезнь Фарби — Это наследственное заболевание, при котором обнаруживается недостаточная активность α-галактозидазы. Этот липоидоз наследуется сцеплено с Х- хромосомой. Клиника – боли в конечностях, поражение почек и сосудов кожи (ангиокератомы), сосудов глаза, помутнение роговицы.
VI. ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
49. Роль белков в питании человека. Биологическая ценность пищевых белков. Полноценные и неполноценные белки. Азотистый баланс. Переваривание белков в желудке. Диагностическое значение определения кислотности желудочного сока.
Функции белков: структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, дыхательная, обезвреживающая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение, энергетическая,
Белковый обмен.
В организме человека содержится около 15 кг белков. Количество свободных АМК примерно 35 г. АМК и белки содержат 95 % всего азота в организме. Синтез белка подчиняется закону «все или ничего» и осуществляется при условии наличия в клетке полного набора всех 20 аминокислот.
Азотистый баланс – разность между общим количеством азота, поступившим в организм человека и количеством экскретируемого азота. Азотистое равновесие наблюдается у взрослого здорового человека. При этом количество синтезируемого белка, равно количеству экскретируемого.
Положительный азотистый баланс у детей, беременных, выздоравливающих, введении анаболиков. При этом синтез белка преобладает над распадом.
Отрицательный азотистый баланс при голодании, старении, истощающих заболеваниях, раке.
Избыток и недостаток белка. При недостаточном поступлении белка развивается белковая недостаточность. При белковых нагрузках вероятность возникновения дистрофических поражений почек, аллергических заболеваний, неопластических процессов повышается.
Белковый оптимум для человека умственного труда при средней физической нагрузке – 100 г в сутки, при работе в жарком климате – 120 г в сутки.
Белковый минимум 30-50 г в сутки - такое количество белка необходимо для поддержания азотистого равновесия. Даже при полном исключении из диеты всех белков с мочой выводится 4 г азота в сутки, то есть 25 г белка.
Идеальный белок 100% биологическая ценность, 100% усвоение в ЖКТ.
Биологическая ценность белков определяется
• сбалансированностью АМК состава,
• атакуемостью белков ферментами пищеварительного тракта (доступностью АМК).
Чем ближе аминокислотный состав принимаемого пищевого белка к аминокислотному составу белков тела, тем выше его биологическая ценность.
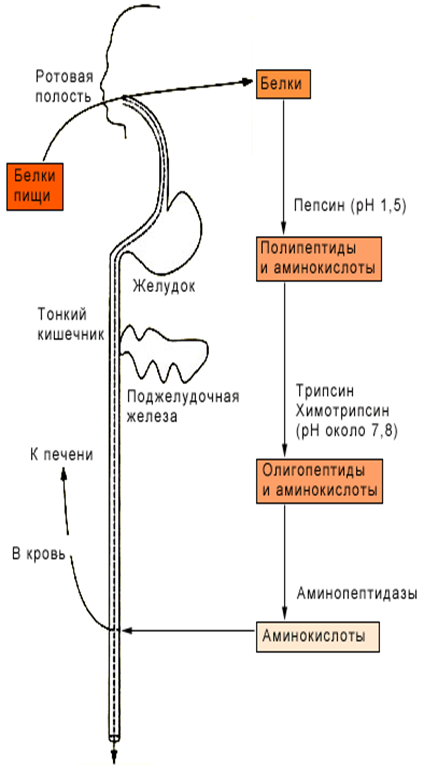
Переваривания
В ротовой полости нет переваривания белков,
Переваривания белков начинается в желудке.
Расщепление белка в ЖКТ. Желудочный сок - 95% - вода, 0,5% органические вещества, 2,5 литра.
Состав желудочного сока пепсин (7 изоферментов), соляная кислота, гастрин (гормон, стимулирующий желудочную секрецию), лизоцим (вырабатывается поверхностью эпителия желудка), слизь (гликопротеины) несёт защитную функцию, внутренний фактор Кастла.
Соляная кислота создаёт рН 1,5-2 у взрослого, рН 5-6 – у новорожденных.
Роль соляной кислоты вызывает денатурацию, набухание белка, активация пепсиногена, создаёт оптимум рН для пепсина, бактерицидное действие, нужна для всасывания железа, стимулирует работу внутреннего фактора
Общая кислотность желудочного сока - совокупность всех кислотореагирующих веществ желудочного сока. Связанная соляная кислота - соляная кислота, связанная с белками и продуктами их переваривания.
Свободная соляная кислота - соляная кислота, остающаяся в избытке.
Кислотность измеряется в титрационных единицах – количество NaOH, затраченное на титрование 100 мл желудочного сока.
Общая кислотность – 40-60 ТЕ.
Связанная соляная кислота – 20-30 ТЕ.
Свободная соляная кислота - 20-40 ТЕ.
Гипохлоргидрия – снижение концентрации соляной кислоты в желудочном соке.
Ахлоргидрия – отсутствие соляной кислоты в желудочном соке.
Гиперхлоргидрия – повышение концентрации соляной кислоты в желудочном соке.
Защитные факторы слизистой желудка от соляной кислоты и пепсина - образование слизи, секреция эпителием ионов НСОз, создающих рН 5-6, наличие гетерополисахаридов на поверхности мембран клеток слизистой, быстрая регенерация повреждённого эпителия.
Основные пепсины желудочного сока. Пепсин А гидролизует белки при рН 1,5-2. Часть пепсина переходит в кровеносное русло и выделяется с мочой (уропепсин). Гастриксин - оптимум рН 3,2 -3,5. Пепсин В (желатиназа) расщепляет белки соединительной ткани. Реннин (пепсин D, химозин) расщепляет казеин молока в присутствии ионов кальция.
Пепсиноген активируется двумя способами - соляной кислотой – медленно, аутокаталитически –быстро, уже имеющимся пепсином.
50. Процессы переваривания белков в кишечнике. Протеолитические ферменты панкреатического и кишечного соков. Гниение аминокислот в кишечнике. Обезвреживание продуктов гниения.
Переваривание белка начинается с желудочного сока, где пепсин гидролизует пептидные связи с участием NH2 группы ароматичской АМК, а соляная кислота вызывает денатурацию и набухание белка.
Ферменты панкреатического сока: трипсин, химотрипсин, эластаза, карбоксипептидаза.
Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы Лиз и Арг.
Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК.
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Эластаза активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Ферменты кишечного сока: аминопептидазы, дипептидазы, энтерокиназа.
Аминопептидазы, Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Всасывание продуктов распада белков:
• идёт путём активного транспорта (с ионами натрия) АМК в кровь,
• если белок всасывается непереваренным, то появляется аллергия к этому белку.
Специфические транспортные системы существуют для:
• нейтральных АМК с небольшой боковой цепью,
• нейтральных АМК с объёмной боковой цепью,
• основных АМК,
• кислых АМК,
• пролина.
Гниение белков
5% белка не переваривается, а идёт в толстый кишечник, где микрофлорой расщепляется до АМК. Гниение белков – распад АМК, в толстой кишке под действием ферментов бактерий.
Так, в процессе распада серосодержащих аминокислот (цистин, цистеин, метионин) в кишечнике образуются сероводород H2S и метилмеркаптан CH3SH.
Диаминокислоты – орнитин и лизин – подвергаются процессу декарбоксилирования с образованием аминов – путресцина и кадаверина.
Лизин → Кадаверин + СО2
Орнитин → Путресцин + СО2
Обезвреживание диаминов:
Диамины обезвреживаются в организме под действием фермента ДАО (диаминооксидаза), кофермент – ФП.
Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальном декарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тирамин) и индолилэтиламин (триптамин).
Фен → Фенилэтиламин + СО2
Тир → Тирамин + СО2
Три → Индолэтиламин + СО2
Моноамины обезвреживаются ферментом МАО (моноаминооксидаза), кофермент – ФАД.
Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
Фен → Бензойная кислота
Тирозин → Паракрезол + Фенол
Триптофан → Скатол → Индол
Процессы гниения усиливаются при дефиците протеолитических ферментов поджелудочной железы. Возникает аутоинтоксикация.
В печени детоксикация происходит путём:
• окисления,
• восстановления,
• метилирования,
• ацетилирования,
• дезаминирования,
• реакций конъюгации (образование парных соединений с глюкуроновой кислотой, серной кислотой, глицином).
Обезвреживание путем парного синтеза в печени:

Индол получает ОН группу

Бензойная кислота обзвреживается глицином:

По количеству индикана в моче судят о скорости гниения белков в кишечнике и функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гиппуровой кислоты с мочой после приема бензойной кислоты. Проба Квика: после завтрака дают 4 г бензойного кислого натрия, разведенного в 30 мл воды. В течении 4 часов собирают мочу. 80% гиппуровой кислоты является нормой, менее 30% - говорят о нарушении.
51. Заменимые, незаменимые и условно заменимые аминокислоты. Кетопластичные и глюкопластичные аминокислоты. Аминокислотный пул, пути его пополнения и использования. Биосинтез заменимых аминокислот.
Классификация аминокислот по заменимости:
заменимые,
незаменимые (Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен),
частично заменимые (Арг, Гис),
условно заменимые (Цис, Тир),
незаменимые АМК для детей: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен, Гис и Арг.
Скорость синтеза частично заменимых недостаточна для того, чтобы обеспечить рост организма в детстве.
Исключение какой-либо АМК из пищи сопровождается развитием отрицательного азотистого баланса, истощением, остановкой в росте, нарушениями со стороны нервной системы.
При отсутствии Гис, Арг – анемия.
При отсутствии Три – катаракта.
При отсутствии Лиз - кариес, задержка роста.
При отсутствии Мет страдает печень.
Кетогенные АМК дают кетоновые тела
Гликогенные АМК могут превращаться в глюкозу после образования ПВК
Глико-кетогенный в процессе катаболизма образуют 2 продукта — фен, тир.
Метаболический пул — это смесь эндогенного и экзогенного материала, которая может служить источником анаболических и катаболических реакций азотистого обмена и существует в качестве резервного материала.
Аминокислотный пул.
2/3 пула – эндогенные источники,
1/3 пула пополняется за счёт пищи.
Фонд
свободных АМК организма примерно 35 г
Всосавшиеся аминокислоты в первую очередь используются в качестве строительного материала для синтеза специфических тканевых белков, ферментов, гормонов и других биологически активных соединений. Некоторое количество аминокислот подвергается распаду с образованием конечных продуктов белкового обмена (СО2, Н2О и NH3) и освобождением энергии.
АМК крови увеличиваются при:
экссудативном диатезе,
заболеваниях печени, опухолях.
Биосинтез заменимых АМК
Ала, глу, асп – первичные АМК.
Пути синтеза:
восстановительное аминирование (альфа-кетоглутарат (глутаматдегидрогеназа)→ Глутамат),
трансаминирование (искл Лиз и Тре)
Глутамин синтезируется из глу под действием глутаминсинтетазы.
Аспарагин синтезируется из асп и глутамина.
Глицин синтезируется из серина.
Серин образуется из 3-фосфоглицерата.
Пролин образуется из глутамата.
Аргинин синтезируется в орнитиновом цикле.
Гистидин синтезируется из АТФ и рибозы.
Тирозин образуется из фенилаланина.
Цистеин синтезируется из метионина и серина.

52. Основные пути межуточного обмена аминокислот: реакции дезаминирования, трансаминирования, декарбоксилирования (образование, распад биогенных аминов, их биологическая роль). Диагностическое значение определения активности трансаминаз.
Трансаминирование АМК
- реакции межмолекулярного переноса аминогруппы от АМК на α-кетокислоту без промежуточного образования аммиака.
обратимые реакции,
универсальные реакции для всех организмов,
ферменты – трансаминазы,
кофермент – ФП.

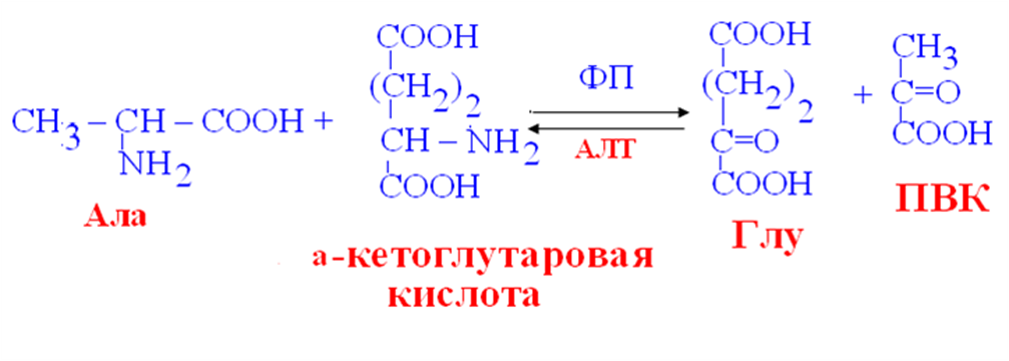
Значение реакций трансаминирования для синтеза и катаболизма АМК:
• образование кетокислот (ПВК, ЩУК, а-кетоглутарат),
• потеря аминогруппы определёнными АМК,
• перераспределение аминного азота,
• диагностическое значение трансаминаз.
Диагностическое значение определения активности трансаминаз
у новорожденных из-за высокой проницаемости АСТ в 1,5 раза выше, чем у взрослых здоровых людей,
при остром гепатите повышается АЛТ, при инфаркте миокарда через 4-6 часов повышается АСТ,
коэффициент де Ритиса АСТ/АЛТ:
в норме = 1,33± 0,42,
при гепатите <1,
при инфаркте миокарда повышается.
53. Обмен и биологическое значение глутаминовой и аспарагиновой аминокислот в организме человека.
Глу и асп – первичные и заменимые АМК
Пути синтеза:
-восстановительное аминирование,
-трансаминирование
Глутамин и аспарагин образуются в местах образования аммиака:
печень,
мозг,
мышцы.
Глутамин синтезируется из глу под действием глутаминсинтетазы.
Аспарагин синтезируется из асп и глутамина.
Судьба Асп:
Асп → Аспарагин
Асп → Синтез пуриновых и пиримидиновых нуклеотидов
Асп → β-аланин → КоАSH
→ Азотистые вещества мышц: анзерин, карнозин
Судьба Глу:
Глутаминовая аминокислота
Глу → Фолиевая кислота
Глу → Глутамин
Глу → ГАМК
Глу → Пролин
Глу → Глутатион
Глу → Синтез пуриновых нуклеотидов
Глутамин:
нетоксичен, свободно проходит через клеточную мембрану,
форма, в которой транспортируется аммиак, временное хранилище аммиака,
используется для синтеза белка, аминосахаров, пуриновых и пиримидиновых нуклеотидов, фолиевой кислоты, глу, три, гис, асн,
донор аммиака.
Образование амидов АМК:

Образование аммонийных солей:
глутамин используется почками в качестве источника аммиака, необходимого для нейтрализации кислых продуктов.

Аспарагиновая кислота
(аминоянтарная кислота, аспартат, аминобутандиовая кислота) — алифатическая аминокислота, одна из 20 протеиногенных аминокислот организма. Встречается во всех организмах в свободном виде и в составе белков. Кроме того, выполняет роль нейромедиатора в ЦНС.
Аспарагиновая кислота:
- присутствует в организме в составе белков и в свободном виде
- играет важную роль в обмене азотистых веществ
- участвует в образовании пиримидиновых оснований и мочевины
- Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видах лимфолейкоза.
- Фермент микробного происхождения L-аспарагиназа, нарушающий превращение аспарагиновой кислоты в аспарагин и наоборот, оказывает сильное специфическое цитостатическое действие при этих видах лейкозов.
- Используется в качестве биологически активной добавки в питании спортсменов.
Cуточная потребность - 6 г.
Значительное количество аспарагиновой кислоты содержат проращенных семенах
54. Обмен и биологическое значение серосодержащих аминокислот (метионин, цистеин). Участие метионина в реакциях трансметилирования. Молекулярная патология обмена серосодержащих аминокислот.
Обмен метионина
Метионин – незаменимая (точнее незаменим гомоцистеин, образующийся только из метионина), гликогенная АМК.
Пищевые источники: яйца, молочные продукты, мясо
Необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
Мет → Холин
Мет → Мелатонин
Мет → Адреналин
Мет → Креатин
Мет → Карнитин
Мет → Тимин
Метионин участвует в реакциях трансметилирования
Трансметилирование – перенос метильной группы.
Донором метильной группы служит S-аденозилметионин SAM.
Метильная группа стаёт подвижной с помощью АТФ.
Кофермент, переносящий метильную группу – ТГФК.
Реакции трансметилирования применяются в
синтезе фосфатидилхолина (лецитина) — образователь мембран,
синтезе карнитина — переносчик ЖК через мембрану,
синтезе креатина — образователь креатинфосфата (для процесса еще нужны аргинин и глицин),
синтезе адреналина из норадреналина,
синтезе ансерина из карнозина,
метилировании азотистых оснований в нуклеотидах,
инактивации метаболитов и обезвреживании чужеродных соединений.

S-Аденозилметионин SAM является активной формой.
Метионин + АТФ + Н2О (Метионин-аденозилтрансфераза)→ S-Аденозилметионин SAM + Ффн + Фн
S-Аденозилметионин + R (Метилтрансфераза)→ S-Аденозилгомоцистеин SАГ + R-СН3
Гомоцистеин + N5CH3-ТГФК (Гомоцистеин-метилтрансфераз)→ Метионин + ТГФК
Переносчиком метильной группы в последней реакции служит производное витамина В12 — метилколабамин (кофермент).
Вторая активная форма метионина витамин U:
предупреждает развитие язвы, используется против атеросклероза, жировой инфильтрации печени, притупляет боль, тормозит выделение гистамина.

Обмен цистеина:
Цистеин - глюкопластичная, условнозаменимая (для синтеза необходим атом серы, источником которого служит метионин) амк.
Цис → KoASH
Цис → Инсулин, вазопрессин, окситоцин
Цис → Таурин
Цис → Активный центр ферментов
Цис → Цистин
Цис → Глутатион
Синтез:


Гомосерин → альфа–Кетомасляная кислота + NН3 → Пропионил → Сукцинил-КоА
Окисление:




Патологии связанные с обменом цистеина:
Гомоцистеинурия
возникает при отсутствии цистотионинсинтетазы,
лечение ФП,
в клетках нервной ткани откладывается гомоцистеин, что ведёт к умственной отсталости,
остеопороз, смещение хрусталика, страдает костный мозг,
тромбоэмболия в почках, с мочой выделяется метионин и гомоцистеин.
Гомоцистеин препятствует образованию нормальных поперечных сшивок в коллагене, повреждает интиму сосудов.
Цистинурия
возникает при аномальной реабсорбции АМК в канальцах почек,
с мочой увеличивается экскреция цистеина, орнитина, аргинина, лизина из-за нарушения обратного всасывания,
цистин слабо растворим, возникают цистиновые камни в почечных канальцах.
Цистиноз (болезнь накопления)
наследственное заболевание,
причина болезни – нарушение функции лизосом,
в основе болезни – дефект окисления цистина в тканях, дефект реабсорбции АМК в почечных канальцах,
кристаллы цистина откладываются во многих тканях и органах,
нарушена функция почечных канальцев.
Цистотионинурия
возникает, если нет цистотионазы,
умственная отсталость,
камни в почках,
психические расстройства.
55. Обмен и биологическое значение фенилаланина и тирозина. Молекулярная патология обмена этих аминокислот.
Обмен фенилаланина и тирозина
на 50% кетогенные, фен – незаменимая АМК, тир – условно заменимая АМК (образуется из фен).

Блок 1.
Фен + О2 (фенилаланингидроксидаза, тетрагидробиопротеин Н4БП)→ Тирозин
Фен → ФенилПВК
Превращение в тирозин необходимо для удаления избытка фенилаланина.
ФенилПВК:
токсичен в первые 2–4 года жизни,
ингибирует ПК, ГК, обмен триптофана,
нарушает обмен серотонина,
приводит к развитию фенилпировиноградной олигофрении.
Фенилпировиноградная олигофрения
встречается с частотой 1 на 20 000,
для постановки диагноза необходимо провести реакцию мочи с FеClз 10% (зелёное окрашивание).
Фенилпировиноградная олигофрения
задержка умственного развития,
меняется нейромедиаторная активность, сокращается образование нейромедиаторных производных тирозина (тирамин, катехоламины),
нарушается баланс АМК, синтез белка, нейромедиаторов в нервной ткани.
Скорость обмена АМК наиболее высока в нервной ткани.
Наследственные аминоацидопатии – одна из основных причин слабоумия.
Нарушение обмена фенилаланина (фенилкетонурия)
При побочном пути метаболизма фенилаланина образуются фенилэтиламин и фенилацетат. Это нейротоксины, они способны нарушать метаболизм липидов в мозге.
Избыток фен и его минорные метаболиты – тератогенны. Приводят к множественным порокам у плода.
При нарушении пути, катализируемого фенилаланингидроксилазой, основным катаболизмом становится превращение фениламина в фениллактат и фенилацетилглутамин. Такое нарушение сопровождается гиперфениланемией и повышением в моче концентрации метаболитов: фенилпирувата, фенилацетата, фениллактата и фенилглутамина. Как следствие — заболевание ФКУ.
Классическая ФКУ — наследственная мутация в гене фермента.
Фенилаланин в крови повышается в 20-30 раз (в норме — 1,0-2,0 мг/дл), в моче в 100-300 раз (в норме 30 мг/дл)
фенилпируват и фениллактат в моче достигает 300-600 мг/дл.
Проявления:
нарушения умственного и физического развития
судорожный синдром
нарушение пигментации
ограничение транспорта тирозина и триптофана через гематоэнцефалический барьер и торможение нейромедиаторов (дофамина, норадреналина, серотонина).
Вариантная ФКУ (коферментзависимая гиперфенилаланемия) — следствие мутаций в генах, контролирующих метаболизмом Н4БП. Нарушается метаболизм всех 3 аминокислот (фен, тир, три) и синтез нейромедиаторов
Проявления:
тяжелые неврологические нарушения
Диагностика
метаболиты в моче
фенилаланин в крови и моче
тест толерантности к фенилаланину
ДНК-диагностика (ПЦР и рестрикционный анализ)
Обмен тирозина
Тирозин выступает предшественником катехоламинов, тироксина, меланина, катализируется до СО2 и Н2О.
Блок 2. В щитовидной железе
Тирозин → Йодитиронины (Тироксин и Трийодтиронин)
При дефекте йодтирозиназы развивается кретинизм.
При этом аутосомно-рецессивном заболевании моно- и дийодтирозин не дейодируются, развивается нехватка тиреоидных гормонов.
Блок 3. В меланоцитах
Тирозин (тирозиназа, Cu+)→ ДОФА(диоксифенилаланин) → ДОФАхром → 5,6-Дигидроксииндол → меланин
При дефекте тирозиназы развивается альбинизм.
В надпочечниках и нервной ткани
Тирозин (тирозингидроксилаза, Fe2+)→ ДОФА (ДОФАдекарбоксилаза, ПФ)→ дофамин + СО2 (Дофамингидроксилаза, витамин С)→ норадреналин (метилтрансфераза)→ Адреналин
Источником метильной группы служит S-аденозилметионин.
При первичной болезни Паркинсона заторможено образование дофамина из ДОФА в ткани мозга.
Симптомы:
акинезия (скованность движений)
ригидность (напряжения мышц)
тремор (непроизвольное дрожание)
Блок 4. В печени
Тирозин + альфа-кетоглутарат (тирозинтрансаминаз, ПФ)→ ГидроксифенилПВК
развивается тирозинемия II типа (синдром Рихнера-Ханхорта).
Симптомы:
умственная отсталость,
нарушение координации,
поражения глаз, кожи.
Блок 5.
ГидроксифенилПВК (гидроксифенилПВКдиоксигеназа, витамин С, Fe2+)→ Гомогентизиновая кислота
развивается тирозинемия новорожденных (кратковременная).
Блок 6.
Гомогентизиновая кислота (оксидаза, Fe2+)→ Фумарилацетатоуксусная кислота
развивается алкаптонурия
Симптомы:
охроноз (пигментация соединительной ткани),
артриты,
чёрная моча (пигменты алкаптоны).
Лабораторная диагностика алкаптонурии: при подщелачивании мочи NаОН гомогентизиновая кислота окисляется с образованием соединения сине-фиолетового цвета.
Гомогентизиновая кислота ингибирует лизингидроксилазу.
Лабораторная диагностика алкаптонурии: при подщелачивании мочи NаОН гомогентизиновая кислота окисляется с образованием соединения сине-фиолетового цвета. Гомогентизиновая кислота ингибирует лизингидроксилазу.
Блок 7.
Фумарилацетатоуксусная кислота (фумарилацетоацетатгидролаза)→ Фумарат + Ацетоуксусная кислота
Ацетоуксусная кислота → Кетоновые тела
Ацетоуксусная кислота → Синтез жирных кислот
Ацетоуксусная кислота → СО2 +Н2О + Е
Фумарат → ЦТК
При отсутствии витамина С оксидазы не работают.
развивается тирозинемия I типа (тирозиноз). Приводит к накоплению метаболитов, снижающих активность некоторых ферментов и транспортных систем АМК.
Симптомы:
в плазме повышено содержание тирозина и метионина,
понос,
рвота,
задержка в развитии,
смерть в 6-8 месяцев при острой форме у новорожденных и в 10 лет у детей с хронической формой.
56. Пути обезвреживания аммиака в организме. Транспорт аммиака. Мочевина, как конечный продукт обмена аминокислот. Синтез мочевины. Гипераммониемия. Остаточный азот, его компоненты, диагностическое значение определения. Гиперазотемия, её виды, причины.
Пути обезвреживания аммиака синтез мочевины, образование амидов АМК, восстановительное аминирование, образование аммонийных солей.
Образование амидов АМК у детей раннего возраста это основной путь обезвреживания аммиака.

Глутаматсинтаза находится в митохондриях, для ее работы необходим кофактор — Mg 2+
Глутамин и аспарагин образуются в местах образования аммиака
печень,
мозг,
мышцы.
У детей раннего возраста это основной путь обезвреживания аммиака.
Глутамин нетоксичен, свободно проходит через клеточную мембрану, форма, в которой транспортируется аммиак, временное хранилище аммиака, используется для синтеза белка, аминосахаров, пуриновых и пиримидиновых нуклеотидов, фолиевой кислоты, аминокислот (глу, три, гис, аспарагин), донор аммиака.

Образование аммонийных солей:
в клетках кишечника под действием фермента происходит гидролитическое освобождение амидного азота в виде аммиака
образовавшийся глутамат подвергается трансаминированию с пируватом
глутамин используется почками в качестве источника аммиака, необходимого для нейтрализации кислых продуктов.
Глутамин + H2O (Глутаминаза)→ Глу + NH3
Удаление аммиака происходит в виде аммонийных солей с мочой (до 1 г в сутки).
NH3 + H+ + Cl- → NH4Cl
Экскреция аммиака с мочой увеличивается при ацидозе
При ацидозе повышается активность глутаминазы и усиливается глюконеогенез.
Глутамат после дезаминирования может превращаться в глюкозу путём глюконеогенеза.
Восстановительное аминирование

Биосинтез мочевины
Орнитиновый цикл (цикл Кребса-Гензелейта) - основной путь обезвреживания аммиака, главный путь экскреции азота у человека в составе мочевины
из кишечника аммиак с воротной веной идёт в печень
протекает в печени
в синтезе мочевины 5 реакций, 2 из них протекают в митохондриях
Орнитиновый цикл основной путь обезвреживания аммиака и главная форма выделения азота из организма взрослых и детей старшего возраста.
Синтез мочевины






В синтезе мочевины участвует 6 АМК
орнитин,
цитруллин,
аргинин,
аспарагиновая кислота,
аргининосукцинат,
N-ацетилглутамат – активатор первой реакции.
Орнитин регенерирует в каждом обороте цикла мочевины.
В мочевине одна аминогруппа поступает в цикл в митохондриях при окислительном дезаминировании глутамата, вторую аминогруппу поставляет аспартат из цитозоля.
Цикл мочевины участвует в регуляции рН крови.
В орнитиновом цикле расходуется 4 макроэргические связи трёх молекул АТФ на каждый оборот цикла.
Процесс сам себя обеспечивает энергией
при регенерации аспартата из фумарата образуется молекула НАДН2, которая даёт 3 АТФ,
при окислительном дезаминировании глутамата образуется 3АТФ.
Экскреция мочевины
в норме выделяется 25 г мочевины в сутки
мочевина – основной конечный продукт азотистого обмена
для транспорта азота из тканей в печень используется 3 соединения: глутамин, аланин, аммиак. В кровотоке аммиак транспортируется глутамином. Аланин переносит аммиак из скелетных мышц в печень.
Функции орнитинового цикла
путь обезвреживания аммиака и путь выделения азота (превращение азота аминокислот в мочевину, которая предотвращает накопление аммиака),
синтез аргинина.
Бицикл Кребса
Связь орнитинового цикла с циклом трикарбоновых кислот через митохондрии, СО2, АТФ, общие фрагменты (фумарат).
Путь, связывающий эти два цикла, называется аспартат-аргининосукцинатным шунтом.
Фумарат, образующийся в орнитиновом цикле, поступает в митохондрии, где реакциями ЦТК превращается в малат и далее в ЩУК, которая посредством трансаминирования преобразуется в аспартат.
Гипераммониемия – повышенное содержание аммиака в крови. рвота, сонливость, раздражительность, нарушение координации, судороги, потеря сознания, отёк мозга.

Метаболические нарушения цикла мочевины
Лимитирующие скорость стадии в синтезе мочевины: 1, 2, 3, 5.
Гипераммониемия типа I
наследственная
при недостатке карбамоилфосфатсинтетазы1
Гипераммониемия типа II
наследственная,
при недостатке орнитинкарбамоилтрансферазы.
Цитруллинемия
наследуется по рецессивному типу
при недостатке или отсутствии аргининосукцинатсинтетазы
экскреция с мочой цитруллина
Аргининосукцинатная ацидурия
при отсутствии аргининосукцинатлиазы,
повышено содержание аргининосукцината в крови, спинномозговой жидкости.
Гипераргининемия
при низкой активности в эритроцитах аргиназы,
повышено содержание аргинина в крови, спинномозговой жидкости,
в моче много лизина, цистеина.
Нарушения орнитинового цикла наблюдаются при
при гепатите,
различных вирусных заболеваниях.
Вирус гриппа ингибирует карбамоилфосфатсинтетазу 1.
Содержание мочевины в крови составляет 2,5 – 8,3 мкмоль/л
Соотношение между интенсивностью синтеза и скоростью фильтрации в почечных клубочках определяет концентрацию мочевины в крови.
Для снижения концентрации аммиака в крови рекомендуется
малобелковая диета,
введение метаболитов орнитинового цикла: аргинина, цитруллина, глутамата.
Уменьшение содержания мочевины в крови
при заболеваниях печени
при нарушении всасывания в кишечнике
при парентеральном питании
диета с низким содержанием белка
Повышение мочевины в крови
при нарушении функции почек,
потере жидкости,
усиленном распаде белков (опухоли, лучевые поражения),
потреблении больших количеств белка.
Остаточный азот – это сумма азота всех небелковых азотсодержащих веществ крови.
В норме 14-28 ммоль/л. 1. Метаболиты: 1.1. аминокислоты (25%); 1.2. креатин (5%); 1.3. полипептиды, нуклеотиды (до 3,5%). 2. Конечные азотистые продукты: 2.1. мочевина (50%); 2.2. мочевая кислота (4%); 2.3. креатинин (2,5%); 2.4. индикан, аммиак.
Продукционная гиперазотемия при
усиленном распаде тканевых белков
опухолях
туберкулёзе
диабете
циррозе
увеличится азот в моче и крови
Ретенционная гиперазотемия
связана с нарушением выделительной функции почек,
повышается концентрация мочевины, креатинина, мочевой кислоты, индикана.
Уменьшится азот в моче, увеличится в крови
Индикан (1, 4-3,7 мкмоль/л)
секретируется в кровь и удаляется с мочой,
концентрация в крови зависит от:
- состояния ЖКТ (от интенсивности продукции индола),
- экскреторной функции почек.
Индикан повышается при
болезнях почек,
кишечной непроходимости,
брюшном тифе,
раке желудка.
Продукционная индиканемия
обусловлена ускорением образования индикана при заболеваниях ЖКТ,
сопровождается индиканурией,
диспепсии,
дефицит витамина В6 (нарушен распад триптофана).
Ретенционная индиканемия при
снижении выделительной функции почек,
поражении почек,
токсикозах беременных.
Гиперазотемия (азотемия). Причины: 1) Продукционный фактор – вследствие распада белков и увеличенного содержания АК в составе остаточного азота. Повышение аминокислот – гипераминоацидемия – при голодании, истощающих заболеваниях, гиперфункции щитовидной железы. 2) Ретенционный фактор – задержка азотистых шлаков в организме за счет нарушения функции почек. Напр., повышение мочевины, повышение креатинина (креатинин только фильтруется, но не реабсорбируется). При интенсивном распаде нуклеиновых кислот, подагре повышается мочевая кислота. При патологии мышц увеличивается креатин.
57. Нуклеопротеины и нуклеиновые кислоты. Структурная организация молекул ДНК и РНК. Распад нуклеопротеинов в пищеварительном тракте. Нуклеотидный пул клеток, его пути пополнения и расходования.
Перевариивание нуклеопротеинов:
В желудке под влиянием соляной кислоты и пепсина происходит разрыв связей между белком и нуклеиновыми кислотами.
В кишечнике под действием ДНК-азы и РНК-азы происходит гидролиз до олиго- и мононуклеотидов.
Фосфодиэстеразы кишечника расщепляют олигонуклеотиды.
Фосфатазы и нуклеотидазы гидролизуют мононуклеотиды до нуклеозидов и фосфорной кислоты.
Нуклеотиды и нуклеозиды всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозо- или дезоксирибозо-1-фосфата, пуриновых и пиримидиновых оснований.
Расщепление НК

Существуют тканевые и пищеварительные ферменты (нуклеазы): нуклеотидаза, нуклеозидаза, пирофосфатаза, нуклеотиддифосфатаза, нуклеозидфосфорилаза, АТФ-аза.
Обновление ДНК.
В покоящихся клетках ДНК находится в стабильном состоянии с минимальной скоростью обновления. Скорость обновления ДНК увеличивается в растущих и пролиферирующих тканях. Обновление ДНК необходимо, так как молекулы подвергаются воздействию различных метаболитов, радиации. Удаление повреждённых участков ДНК и распад молекул РНК осуществляется нуклеазами, которые содержатся в лизосомах. Наиболее интенсивно протекает обновление мРНК.
Источники нуклеопротеинов в питании – продукты животного происхождения: печень, почки, лёгкие, икра.
Нуклеотидный пул клеток, пути его пополнения и использования:

58. Распад пуриновых и пиримидиновых нуклеотидов в тканях. Конечные продукты обмена пуринов и пиримидинов. Гиперурикемия. Подагра.
Распад пуриновых азотистых оснований
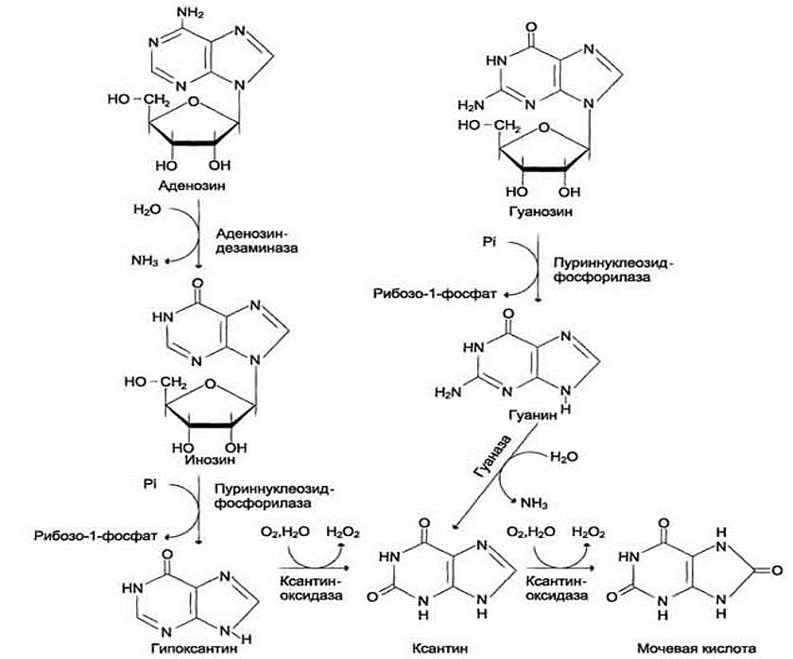
Мочевая кислота + Н2О (уриказа)→ Аллонтоин
Аммиак и мочевая кислота – конечные продукты распада пуриновых азотистых оснований.
В сутки с мочой выводится до 1г мочевой кислоты.
0,21-0,42 ммоль/л – норма содержания мочевой кислоты в крови мужчин.
Мочевая кислота – плохо растворимое соединение. 40-50 мг/л мочевой кислоты выпадает в осадок.
При снижении рН появляются очаги кристаллизации мочевой кислоты (суставы и подкожно-жировая клетчатка - тофусы. Ураты откладываются в тканях.
Мочекислый инфаркт новорожденных
Может быть, так как у ребёнка в первые месяцы жизни преобладает выделение мочевой кислоты над выделением мочевины.

Гиперурикемия наблюдается при: подагре, болезни Леша-Нихана, усиленном обмене нуклеиновых кислот (опухоли, перницитозная анемия), почечной недостаточности, остром алкоголизме, врождённом дефиците Г-6-ФДГ, избыточной продукции лактата, диабете.
Следствием гиперурикемииявляется кристаллизация уратовв различных тканях и связках, вызывающая воспалительный процесс, который называется ПОДАГРА.
Подагра связана с: увеличением синтеза мочевой кислоты, снижением в плазме уратсвязывающего белка (α-гликопротеин), замедлением выведения уратов с мочой.
В 20 раз чаще подагра встречается у мужчин, чем у женщин, так как у них меньше экскреция уратов с мочой. В Армении в почве и воде содержится много молибдена, поэтому в этой стране выше поражённость подагрой.
Признаки подагры: подагрические кризы (ураты натрия откладываются в суставах), тофусы (подагрические узелки) в суставах, сухожилиях, хрящах, коже, почках, почечные камни.
Тест на подагру
Употребление пищи, богатой нуклеопротеинами, ведёт к увеличению мочевой кислоты и появлению боли в суставах.
Лечение подагры снижение содержания пуринов в пище, повышение экскреции уратовс мочой (салицилаты), уменьшение образования уратов.
Аллопуринол–конкурентный ингибитор сантиноксидазы.
Болезнь Леша-Нихана – ювенильная гиперурикемия: возникает при отсутствии фермента гипоксантин-гуанинфосфорибозилтрансферазы, врождённое заболевание мальчиков.
При этом для синтеза пуриновых нуклеотидов не могут быть повторно использованы гипоксантин и гуанин, в результате чего происходит стимуляция образования из них уратов.
Симптомы: умственная отсталость, агрессия, самоистязания, церебральные параличи.
Лечение гиперурекемии
снижение содержания пуринов в пище,
повышение экскреции уратов с мочой (салицилаты),
уменьшение образования уратов.
Аллопуринол – структурный аналог гипоксина – конкурентный ингибитор ксантиноксидазы. Останавливает распад пуринов на стадии образования гипоксантина, растворимость которого в 10 раз выше мочевой кислоты. С другой стороны, будучи псевдосубстратом, может превращаться в нуклеотид по запасному пути и ингибировать ФРДФ-синтазу и амидофосфорибозилтрансферазу, вызывая торможение синтеза пуринов de novo.
Распад пиримидиновых азотистых оснований

59. Биосинтез пуриновых и пиримидиновых нуклеотидов. Оротовая ацидурия.
Пути синтеза пуринов:
синтез de novo,
синтез из готовых продуктов (реутилизация пуриновых оснований).
При синтезе де ново конечный продукт ИМФ (затрачивается 6 АТФ)
Синтез de novo
Образование 5-фосфорибозил-1-пирофосфата – центральное место в синтезе как пуриновых, так и пиримидиновых нуклеотидов.
Рибозо-5-фосфат + АТФ (ФРПФ-синтетаза)→ Фосфорибозилпирофосфат (ФРПФ) + АМФ
ФРПФ + глутамин → глу + фосфорибозиламин
При синтезе de novo конечный продукт - ИМФ. Пуриновый скелет образуется из разных соединений, аминогруппу получает от аспарагиновой кислоты. окисление, аминирование за счёт глутамина.
Пуриновый скелет образуется из разных соединений
Сборка пуринового ядра идет на ФРПФ с участием доноров С и N

На синтез ИМФ затрачивается 6 АТФ.
Включение простых предшественников в пуриновое кольцо с образованием ИМФ
ФРДФ + Глн (амидофосфорибозилтрансфераза) → 5-Фосфорибозиламин + Ффн
5-Фосфорибозиламин + глицин + N5,N10-метенил-Н4-фолат + глутаминдиоксид углерода + аспарат + N10-формил Н4-фолат → инозин-5-монофосфат (10 стадий, на которые требуется не менее 6АТФ)
Превращение ИМФ
И МФ
→ АТФ (требуется 7АТФ)
МФ
→ АТФ (требуется 7АТФ)
ИМФ → ГТФ (требуется 8АТФ)
Перекрестное использование пуриновых нуклеозидтрифосфатов на образование конечных продуктов синтеза помогает поддерживать в клетках баланс адениловых и гуаниловых нуклеотидов.
Синтезируется ИМФ (инозиновая кислота) с азотистым основанием – гипоксантин.
Аминогруппу получает от аспарагиновой кислоты.
Окисление
Аминирование за счёт глутамина
Реутилизация пуриновых оснований – «запасной путь» (использование вновь для синтеза пуриновых оснований)
Протекает проще и требует меньше АТФ, чем синтез de novo. Необходим в период гаструляции и раннего роста ребенка.
Аденин + ФРПФ (аденинфосфорибозилтрансфераза)→ АМФ + ПФн
Гуанин + ФРПФ (гипоксантин-гуанинфосфорибозилтрансфераза)→ ГМФ + ПФн
Гипоксантин + ФРПФ (гипоксантин-гуанинфосфорибозилтрансфераза)→ ИМФ + ПФн.
Синтез пиримидиновых.
Синтез пиримидиновых нуклеотидов
Первая реакция сходна с первой реакцией синтеза мочевины, отличия в таблице
Синтез пиримидиновых нуклеотидов |
Синтез мочевины |
Реакцию катализирует карбамоилфосфатсинтетаза-2 |
Реакцию катализирует карбамоилфосфатсинтетаза-1 |
Тканевая локализация – все ткани |
Тканевая локализация – печень |
Клеточная локализация - цитоплазма |
Клеточная локализация - митохондрии |
Источник азота – NH2-группа глутамина |
Источник азота – ионы аммония |
Карбамоилфосфат не используется для биосинтеза мочевины |
|
Биосинтез УДФ, УТФ, цитидиловых нуклеотидов
 УМФ
+ АТФ (нуклеозидмонофосфат-киназа
НМФ-киназа)→ УДФ + АДФ
УМФ
+ АТФ (нуклеозидмонофосфат-киназа
НМФ-киназа)→ УДФ + АДФ
УДФ + АТФ (нуклеозиддифосфат-киназа НДФ-киназа)→ УТФ + АДФ
УТФ + Глн + АТФ (ЦТФ-синтаза)→ цитидин-5-трифосфат ЦТФ + Глу + АДФ + Pi
«Запасные пути» синтеза пиримидиновых нуклеотидов
В ресинтезе участвуют некоторые ферменты:
Урацил + Рибозо-1-фосфат (уридинфосфорилаза)→ Уридин + Н3ЗО4
Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа.
Часть ЦМФ может превращаться в УМФ:
ЦМФ + Н2О (цитидиндезаминаза)→ УМФ + NH3
Оротовая ацидурия I типа
связана с утратой функции двух ферментов: оротатфосфорибозилтрансферазы, ОМФ-декарбоксилазы.
С мочой выделяется много оротовой кислоты. Недостаток пиримидиновых нуклеотидов. Лечат уридином, который в «запасном пути» превращается в УМФ. Наследуется.
В детстве приводит к:
отставанию в развитии,
мегалобластической анемии,
«оранжевой» кристаллоурии,
подверженности инфекциям
Оротовая ацидурия II типа
связана с недостатком ОМФ-декарбоксилазы.
С мочой выделяются оротидин и оротовая кислота.
60. -61 Биосинтез ДНК (репликация). Основные фазы процесса. Биосинтез РНК (транскрипция). Посттранскрипционное созревание РНК. Основные положения аминокислотного кода. Обратная транскрипция.
Репликация
воспроизведение (удвоение) молекул ДНК в процессе деления клетки.
процесс синтеза дочерней ДНК на матрице ДНК.
Этапы репликации
Инициация репликации происходит в нескольких точках хромосомы.
Точки инициации репликации- ориджины репликации.
Во время миграции репликативной вилки происходит разделение цепей родительской ДНК с участием ДНК-хеликазы. Далее действует раскручивающий белок.
ДНК-полимераза α катализирует синтез короткого (до 10 нуклеотидов) олигонуклеотида, то есть праймера, с которого начинается синтез ДНК. Затем на конец одной цепи присоединяется ДНК-полимераза δ (дельта). Расположение оснований в двух нитях не только комплементарно, но и антипараллельно.
Элонгация репликации – репликация обеих материнских цепей ДНК и связывание друг с другом фрагментов новообразованных цепей ДНК.
Обе дочерние молекулы сохраняют связь с родительской.
Хромосома имеет форму вилки.
Обе цепи реплицируются одновременно, хотя имеют разное направление.
Рост дочерних цепей должен происходить в противоположных направлениях.
Синтез новых цепей идёт в направлении от 5`- к 3`- концу.
На одной репликативной вилке синтезируются непрерывная нуклеотидная цепь, на другой – фрагменты Оказаки, которые потом соединяются ДНК-лигазой.
Элонгация завершается отделением праймеров, формированием дочерней цепи ДНК.
Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации.
Элонгация завершается отделением праймеров, формированием дочерней цепи ДНК. После завершения репликации происходит метилирование нуклеотидных остатков вновь образованных цепей ДНК. На каждом конце хромосомы присутствует специфическая нуклеотидная последовательность (GGG ТТА-теломерная ДНК). Это нужно для сохранения генетической информации. С каждым клеточным циклом ДНК хромосом будет последовательно укорачиваться. Ферменты репликации ДНК-топоизомераза (нуклеаза) разрывает цепь ДНК (3`-5`-фосфодиэфирную связь), а в конце репликации зашивает надрезы. ДНК-хеликаза расплетает двойную спираль ДНК. Белки, дестабилизирующие спираль, связываются с одноцепочечной ДНК и предотвращают комплементарное скручивание матричных цепей. Синтез ДНК на матрице РНК (обратная транскрипция) Фермент обратная транскриптаза (ревертаза, РНК-зависимая ДНК-полимераза) был обнаружен в 1970 году Балтимором и Теминым.
Обратная транскриптаза. Сначала синтезирует РНК-ДНК-гибрид. Затем фермент РНКаза Н удаляет РНК-цепь, оставшаяся ДНК- цепь служит матрицей длясинтеза второй цепи ДНК. Возникает двухцепочечная ДНК-копия, содержащая информацию, первично представленную в виде РНК-генома ретровируса.
Транскрипция
Транскри́пция (Т.) в биологии, осуществляющийся в живых клетках биосинтез рибонуклеиновой кислоты (РНК) на матрице — дезоксирибонуклеиновой кислоте (ДНК). Т. — один из фундаментальных биологических процессов, первый этап реализации генетической информации, записанной в ДНК в виде линейной последовательности 4 типов мономерных звеньев — нуклеотидов. Т. осуществляется специальными ферментами — ДНК зависимыми РНК-полимерами. В результате Т. образуется полимерная цепь РНК (также состоящая из нуклеотидов), последовательность мономерных звеньев которой повторяет последовательность мономерных звеньев одной из двух комплементарных цепей копируемого участка ДНК.
Продуктом Т. являются 4 типа РНК, выполняющих различные функции:
1) информационные, или матричные, РНК, выполняющие роль матриц при синтезе белка рибосомами;
2) рибосомальные РНК, являющиеся структурными компонентами рибосом;
3) транспортные РНК, являющиеся основными элементами, осуществляющими при синтезе белка перекодирование информации, заключённой в информационной РНК, с языка нуклеотидов на язык аминокислот;
4) РНК, играющие роль затравки репликации ДНК. Т. ДНК происходит отдельными участками, в которые входит один или несколько генов. Фермент РНК-полимераза «узнаёт» начало такого участка (промотор), присоединяется к нему, расплетает двойную спираль ДНК и копирует, начиная с этого места, одну из её цепей, перемещаясь вдоль ДНК и последовательно присоединяя мономерные звенья — нуклеотиды — к образующейся РНК в соответствии с принципом комплементарности. По мере движения РНК-полимеразы растущая цепь РНК отходит от матрицы, и двойная спираль ДНК позади фермента восстанавливается. Когда РНК-полимераза достигает конца копируемого участка (терминатора), РНК отделяется от матрицы. Число копий разных участков ДНК зависит от потребности клеток в соответственных белках и может меняться в зависимости от условий среды или в ходе развития организма. Механизм регуляции Т. хорошо изучен у бактерий; изучение регуляции Т. у высших организмов — одна из важнейших задач молекулярной биологии
Отличия транскрипции от репликации: не требует синтеза праймера, использует не всю молекулу ДНК, а отдельные её сегменты, требует наличия одной из цепей ДНК в качестве матрицы, которая полностью сохраняется, при транскрипции транскрибируются отдельные гены или группы генов, а при репликации кодируется вся родительская ДНК. м-РНК переносит информацию от ДНК в ядре до цитоплазмы, где она соединяется с рибосомами и служит матрицей, на которой происходит синтез белка, короткоживущая, локализована в ядре и цитоплазме, одноцепочечная, комплементарна одной из цепей ДНК.В транскрипции различают три фазы инициация, элонгация, терминация.
Посттранскрипционный процессинг- ферментативные превращения транскриптов, после чего они стают активными.
Процессинг включает:
кэпирование, присоединение остатка 7-метилгуанозина к 5`- концу молекулы и-РНК, что защищает РНК от ферментативного распада.
сплайсинг, ферментативное присоединение одного гена или части гена к другому, а также процесс удаления интронов и соединения экзонов при синтезе м-РНК.
полиаденилирование, присоединение фрагментов АА УАА к 3`- концу и-РНК в ядре или цитоплазме. Это облегчает выход и-РНК из ядра и замедляет гидролиз в цитоплазме.
метилирование.
Свойства аминокислотного кода:
1)Триплетность. Одна АМК кодируется тремя нуклеотидами.
2)Вырожденность.
3)Несколько кодонов кодируют одну и ту же АМК.
4)Однозначность и специфичность. Каждому кодону соответствует одна АМК.
5)Неперекрываемость. Отсутствие знаков препинания. 6)Считывание триплетов идёт без пропусков.
7)Универсальность.
8)Среди 64 кодонов – 3 кодона нонсенс (УАГ, УАА, УГА) бессмысленные.
9)Неоднозначность соответствия в считывании кодонов. Строгая комплементарность в двух первых буквах кодона, в случае же третьей буквы это необязательно.
Обратная транскрипция — это процесс образования двуцепочечной ДНК на матрице одноцепочечной РНК. Данный процесс называется обратной транскрипцией, так как передача генетической информации при этом происходит в «обратном», относительно транскрипции, направлении.
Идея обратной транскрипции вначале была очень непопулярна, так как противоречила центральной догме молекулярной биологии, которая предполагала, что ДНК транскрибируется в РНК и далее транслируется в белки.
Однако в 1970 году Темин и Балтимор независимо друг от друга открыли фермент, названный обратной транскриптазой (ревертазой), и возможность обратной транскрипции была окончательно подтверждена. В 1975 году Темину и Балтимору была присуждена Нобелевская премия в области физиологии и медицины.
62. Биосинтез белка (трансляция). Активация аминокислот. Основные фазы трансляции. Работа рибосомы. Ингибиторы синтеза белка. Влияние облучения на синтез белка.
Активация аминокислоты
Требуется:•аминокислота,•т-РНК,АТФ,•ионы магния,•кодазы.Трансляция – синтез белка на матрице РНК.
•ДНК –код АТГ,•и-РНК –кодон УАУ,•т –РНК –антикодон АУГ.
Этапы трансляции
•инициация,•элонгация,•терминация.
Инициация
Инициирующий кодон –АУГ.
•Рост цепей идёт с N-конца.
•Синтез начинается с N-формилметионина.
Необходимые компоненты: •рибосомы,•инициирующий кодон,•инициаторная аминоацил-тРНК,•факторы инициации (IF1, IF2, IF3),•ГТФ, •ионы магния.
•Процесс формилирования предотвращает участие аминогруппы АМК в образовании пептидной связи и обеспечивает синтез белка в направлении от аминогруппы к карбоксильной.
•IF3первым связывается с малой субъединицей рибосомы.
•IF3обеспечивает узнавание участка на м-РНК, куда присоединяется формилметионин-тРНК.
•IF1 способствует связыванию формилметионин-тРНК с малой субъединицей рибосомы и присоединению к ней м-РНК.
•IF2 способствует объединению большой и малой субчастиц.
Элонгация трансляции
Необходимо:
•т-РНК,•АМК,•ГТФ,•ионы магния,•рибосомы,•факторы элонгации,•м-РНК
•Формилметионин-тРНК поступает сначала на А-центр, а потом на Р-центр.
•Участок А получает другую АМК. Для этого необходим ГТФ.
•Рибосома делает «шаг» по м-РНК на один кодон.
•Формилметионин переходит на А-участок с Р-участка. На А-участке происходит синтез пептидной связи под влиянием пептидилтрансферазы.
•Рибосома перемещается на один кодон. Дипептид вновь переносится на Р-участок под влиянием пептидилтрансферазы.
•На А-участок поступает третья АМК.
•При перебросе в участок А дипептида образуется трипептид.
Терминация
Необходимы:
•рибосомы,
•факторы терминации (3),
•м-РНК,
•терминирующие кодоны УАГ, УАА, УГА.
От рибосомы отделяется белок, т-РНК, м-РНК.
м-РНК распадается до рибонуклеотидов.
Терминация трансляции
Синтез митохондриальных белков
•2% клеточной ДНК находится в митохондриях.
•Белки, синтезируемые в митохондриях, нерастворимы и участвуют в организации структуры митохондрий.
Влияние облучения на синтез белков
•Наиболее чувствительны ткани в состоянии митоза (костный мозг, эпителий кишечника).
•Наиболее устойчивы -клетки ЦНС.
•Если повреждаются соматические клетки, то они гибнут или укорачивается срок их жизни.
•В половых клетках изменения передаются по наследству.
При облучении активируется СРО. В итоге:
•гибель клетки, •мутации,•торможение деления.
Действие на репликацию
•мутации типа делеции,
•нарушается связь ДНК с гистоновыми и негистоновыми белками,
•хромосомные абберации,
•тормозится репарация ДНК.
Влияние облучения на транскрипцию.
•подавление активности ферментов транскрипции,
•нарушение процессинга РНК.
Влияние облучения на трансляцию.
•тормозится сборка инициаторного комплекса,
•происходит сборка белка с изменённой первичной структурой,
•появляются функционально неполноценные белки.
63. Регуляция биосинтеза белка на генетическом уровне (теория Жакоба и Мано).
Жакоб и Моно разработали теорию регуляции синтеза белка и описали модель оперона.
Сущность теории – «выключение» или «включение» генов.
У бактерий доказана индукция и репрессия ферментов.
По теории Жакоба-Моно в биосинтезе белка у бактерий
участвует 3 типа генов:
структурные гены,
ген-регулятор,
ген-оператор.
Структурные гены определяют первичную структуру синтезируемого белка.
Ген-оператор – пусковой механизм для функционирования структурных генов.
Оперон - группа структурных генов, координируемая одним оператором.
Операторный локус (ген-оператор) – участок последовательности ДНК длиной 27 пар оснований. Он находится между промотором, к которому перед началом транскрипции присоединяется ДНК-зависимая РНК-полимераза, и началом структурного гена.
Ген-регулятор контролирует деятельность оперона через белок-репрессор.
Гормональная регуляция белкового обмена:
СТГ:
способствует росту мышц, костей,
повышает проницаемость клеточных мембран для АМК,
усиливает все этапы синтеза белка,
задерживает азот в организм,
обеспечивает энергетическую сторону синтеза белка,
переводит жиры в углеводы,
приводит к положительному азотистому балансу
Инсулин:
оказывает белоксберегающий эффект, так как тормозит глюконеогенез,
усиливает все этапы синтеза белка,
повышает сродство клеточных мембран к АМК.
Эстрогены:
в матке и молочных железах усиливают все этапы синтеза белка.
Андрогены:
способствуют синтезу белка в мышечной и костной тканях,
усиливают все этапы синтеза белка,
активируют РНК-полимеразы, ускоряют транспорт нуклеотидов
Тироксин в малых дозах в детстве:
приводит к положительному азотистому балансу,
способствует ускорению роста,
влияет на дифференцировку клеток,
повышает активность ферментов,
усиливает трансляцию, транскрипцию,
усиливает синтез белка за счёт обеспечения процесса энергией.
Тироксин в больших дозах у взрослых:
усиливает распад белка,
усиливает действие протеиназ, АМК стают энергетическим материалом
Глюкокортикоиды:
катаболики во всех тканях кроме печени,
активируют глюконеогенез,
препятствуют синтезу заменимых АМК,
тормозят транспорт АМК в ткани,
усиливают распад АМК,
активируют синтез мочевины,
оказывают иммунодепрессорное действие.
Эукариоты.
Основные уровни регуляции биосинтеза:
1. на уровне транскрипции. Варианты:
- групповая репрессия генов белками – гистонами;
- амплификация генов - увеличение числа копий заданного участка ДНК или гена. Достигается в результате многократного синтеза ДНК в одном и том же репликативном пузыре. В этом случае транскрипция будет возможна сразу с нескольких копий гена, что увеличивается скорость транскрипции. Эта регуляция изучается у опухолевых клеток, которые способны к амлификации;
- регуляция сигналами-усилителями. Сигналы-усилители - энхансеры - выступающий участок ДНК, который может быть значительно удален от промотора. Под действием энхансера наблюдается более чем 200-кратное увеличение скорости транскрипции. Действует неспецифично, усиливая транскрипцию многих генов.
Пр.: действие гормонов коры надпочечников: глюкокортикоиды проникают внутрь клетки, где взаимодействуют с рецептором, посредством чего проникают в ядро, где присоединяются к ДНК и превращают участок ДНК в энхансер. При этом запускается синтез ферментов, характерных для действия глюкокортикоидов. Данный механизм работает только у эукариот.
2. регуляция на уровне процессинга иРНК:
- разрешение или запрещение процессинга. Так, не все пре-иРНК превращаются в зрелые иРНК: пре-иРНК иРНК;
- дифференциальный (альтернативный) процессинг. В клетках эукариот возможен многовариантный процессинг, поэтому утверждение 1 ген1 белок для них не всегда справедливо. Это происходит в результате потери некоторых экзонов.
Пр.: С-клетки щитовидной железы и нейроны имеют одинаковый ген, который в С-клетках кодирует выработку кальцитонина (регулирует уровень Са2+), а в нейронах дифференцирует процессинг белка CGRP-пептид (регулирует АД).
3. на уровне стабильности и активности иРНК. Чем больше иРНК находится в стабильном состоянии в цитоплазме, тем большее количество молекул белка на ней может быть синтезировано. Поэтому в цитоплазме иРНК консервируются путем взаимодействия с белками-информатионами, образуя комплексы - информосомы.
4. регуляция на уровне трансляции:
- тотальная репрессия или активация трансляции при изменении активности и количества белковых факторов (ФИ и ФЭ);
- избирательная дискриминация иРНК, например, при инфицировании клетки вирусом транслируется вирусная РНК, а РНК хозяина дискриминируется.
- механизм повышения эффективности трансляции включает образование полисом - это комплекс нескольких рибосом с одной иРНК. Расстояние между соседними рибосомами составляет 80 нуклеотидов.
64. Гормональная регуляция белкового обмена. Патология обмена белков.
Все гормоны регулирующие, белковый обмен, делятся на две группы:
Анаболические гормоны. Они активируют синтез белка и тормозят его распад.
К их числу относятся:
а) гормон роста – соматотропный гормон вырабатывается в передней доле
гипофиза, активирует все стадии синтеза нуклеиновых кислот и белка, активирует транспорт аминокислот в клетку, обеспечивает синтез белка энергией, переключая биоэнергетику клетки с углеводов на липиды, в результате усиливается рост костного скелета, мышечной ткани, устанавливается положительный азотистый баланс.
б) инсулин – гормон поджелудочной железы, активирует синтез белка, распад глюкозы и образование энергии, которая необходима для синтеза белка., тормозит распад белка и глюконеогенез, т.е. образование глюкозы из аминокислот.
в) тироксин – гормон щитовидной железы, в детском организме и в малых дозах стимулирует синтез белка практически во всех тканях, способствует задержке азота, активирует транспорт аминокислот через мембраны, активирует синтез около 100 ферментов.
г) андрогены – активируют синтез белка в мышечной, соединительной и костной ткани, а также в тканях-мишенях мужского организма, активирует все этапы синтеза белка и нуклеиновых кислот, транспорт аминокислот в клетку.
д) эстрогены – активируют синтез белка в тканях-мишенях женского организма.
Катаболические гормоны: активируют распад белка и аминокислот, тормозят синтез белка:
а) тироксин в больших дозах во взрослом возрасте усиливает окислительные процессы в том числе аминокислот, активирует распад белка, повышает основной обмен, способствует усилению выведению азота из организма. Активирует синтез глюкозы из аминокислот.
б) гормоны коры надпочечников: глюкокортикоиды усиливают распад белка, трансаминирование, тормозят синтез белка, активируют глюконеогенез.
Патология белкового обмена.
Затрагивает все виды метаболизма. Делится на наследственную и приобретенную. Наследственная патология может быть обусловлена отсутствием какого либо фермента или низкой его активностью. Причиной этого являются различные генетические дефекты. Например, отсутствие одного или нескольких ферментов процесса мочевинообразования приводит к развитию гипераммониемии. Анальбуминемия развивается как следствие нарушения синтеза этого белка в печени из-за остутствия соответствующего гена.
Приобретенная патология белкового обмена возникает как осложнение основного патологического процесса при заболеваниях печени, почек. Состояние сопровождается гипо- и диспротеинемией. Например, при циррозе печени возникает гипоальбуминемия, причиной которой является утрата способности гепатоцита синтезировать белки. При острых и хронических заболеваниях почек наблюдается избыточное выведение альбуминов с мочой.
Приобретенная патология может развиваться на фоне дефицита поступления аминокислот, в организме развивается белковое голодание, которое приводит к снижению иммунной защиты, склонности к инфекционным заболеваниям.
Наследственный дефект нуклеозидфосфорилазы уменьшает количество и изменяет функции Т-лимфоцитов, что приводит к нарушению Т-опосредованного (клеточного) иммунитета.
Аминоацидурии -один из первых симптомов нарушения метаболизма АМК. Преренальные аминоацидурии обусловлены высокой концентрацией АМК в плазме. АМК поступают в проксимальные канальцы в количествах, превосходящих реабсорбционную способность канальцевого эпителия. Ренальные аминоацидурии связаны с повреждением почечных канальцев. Содержание АМК в плазме крови снижено в результате потери их с мочой.
Болезни, обусловленные синтезом молекул белка с неправильной структурой: гемоглобинозы, гликогенозы, липоидозы, болезнь Вильсона-Коновалова (аномальный церулоплазмин), при синтезе Г-6-ФДГ с неправильной структурой, если сохраняется менее 10% активности фермента, то наблюдается гемолиз.
Ферментопатии как следствие незрелости клеточных систем (болезни новорожденных). Гемолитическая анемия новорожденных, синдром мальабсорбции, гипераммониемия. У новорожденных функциональная незрелость фенилаланин-, тирозин-, серосодержащих АМК.
Патология усвоения пищевых белков. Причины: нарушение секреторной и моторной функции желудка и кишечника, дефицит ферментов, недостаток соляной кислоты, патология ЖКТ, нарушение всасывания.
Последствия недостаточного усвоения пищевых белков алиментарная белковая недостаточность, отрицательный азотистый баланс, снижение иммунореактивности, усиление бактериального расщепления белка. Нарушение тканевого метаболизма белков
Нарушение синтеза белков при: заболеваниях печени, гипоксии, ацидозе, инфекциях. Нарушить соотношение между синтезом и распадом белка могут: алиментарная недостаточность, расстройства нейроэндокринной регуляции, нарушение энергетических процессов, изменение активности протеаз.
Отсутствие лизина в организме характеризуется появлением тошноты, головной боли, головокружением, повышенной чувствительностью к шуму. При отсутствии в пище аргинина снижается сперматогенез.
Патология белкового состава плазмы крови. диспротеинемии – нарушения нормального соотношения между фракциями белков крови, гиперпротеинемии, гипопротеинемии. Нарушение межуточного обмена аминокислот.
Нарушение трансаминирования АМК при недостатке витамина В6, при угнетении активности трансаминаз, при нарушениях соотношений субстратов.
Нарушение дезаминирования АМК при белковом голодании, при гипоксии, при гиповитаминозах.
Нарушение декарбоксилирования АМК. Усилено образование биогенных аминов при гипоксии, ишемии, деструкции тканей.
Нарушение конечного этапа белкового обмена. Конечные продукты белкового обмена – аммиак и мочевина. NHз + Глу = глутамин. При патологии содержание аммиака повышается в головном мозге и вызывает нейротоксикоз. Нарушение синтеза мочевины. Продукционная и ретенционная гиперазотемии. Приобретённая патология белкового обмена на фоне дефицита поступления АМК, белков. отрицательный азотистый баланс, отёки, гипопротеинемия, медленный рост, истощение, анемии, дерматозы, желудочно-кишечные расстройства. Квашиоркор – недостаток белка в питании детей.
При патологии печени страдает синтез белка, снижается синтез мочевины. При патологии почек белок выводится с мочой. При заболеваниях кишечника и желудка наблюдается недостаточное поступление белков в организм. Симптоматический дефицит антител возникает при СПИДе, инфекциях.
VII. ВЗАИМОСВЯЗЬ ОБМЕНОВ ВЕЩЕСТВ
65-66-67. Сопряжение обменов углеводов и липидов, углеводов и аминокислот, липидов и аминокислот. Пути образования и превращения ПВК, ацетил-КоА. Сопряжение обменов углеводов, липидов, белков на уровне центральных метаболитов. Сопряжение обмена углеводов, липидов и аминокислот на уровне цикла Кребса.
Сопряжение липидов и АМК:
Взаимосвязь обменов осуществляется благодаря интегрирующим системам:
• нервной,
• эндокринной,
• сосудистой.
Взаимосвязь обеспечивается различными уровнями:
• информационный уровень,
• структурный уровень,
• общее энергетическое обеспечение,
• на уровне общих метаболитов,
• на уровне Ц.Т.К.
Ацетил-КоА образуется
• при окислительном декарбоксилировании ПВК,
• при β-окислении жирных кислот,
• из аминокислот.
взаимосвязь углеводного и липидного обменов осуществляется через
• ацетил-КоА,
• ФГА,
• НАДФН2 из пентозного цикла идёт на синтез жирных кислот,
• ЩУК нужен для работы Ц.Т.К.
Жиры сгорают в пламени углеводов.
При избытке в пище углеводов возникает ожирение.
ФГА и ацетил-КоА–источники глицерина и жирных кислот.
При спячке у животных происходит образование
углеводов из жиров.
Взаимосвязь белкового и жирового обменов на уровне
• ПВК,
• ацетил-КоА,
• кетоновых тел.
Из белков осуществляется синтез жира.
Взаимосвязь углеводного и белкового обменов на уровне
• ПВК,
• ЩУК,
• ацетил-КоА,
• пентоз,
• глюкопластичных и кетопластичных АМК.
Углеродные скелеты АМК вступают в Ц.Т.К.
Возможно образование углеводов из белков (ГНГ) и белков из углеводов (из ПВК образуется аланин).
Сопряжение на уровне Ц.Т.К.
• углеродные скелеты АМК включаются в ЦТК,
• все кислоты ЦТК превращаются в ЩУК (ГНГ),
• взаимосвязь Ц.Т.К. с синтезом мочевины через фумарат, асп, СО2, ЩУК, жирные кислоты,
мочевина, азотистые основания.
• Ц.Т.К обеспечивает энергией все обмены.
Взаимосвязь обменов нуклеиновых кислот и белков
1. Новообразование нуклеозидтрифосфатов и нуклеиновых кислот зависит от наличия в клетке соответствующего набора белковферментов.
2. Аминокислоты (асп, гли, глн) – основные исходные соединения для синтеза азотистых оснований.
3. В синтезе белка – ДНК и все виды РНК.
Взаимосвязь обменов нуклеиновых кислот и углеводов
1. Р-5 -Ф, возникающий при апотомическом пути распада Г-6 -Ф, – биосинтез нуклеотидов
2. Рибоза Р-5 -Ф Г-6 -Ф и другие фосфорные эфиры углеводов:
3. Распад углеводов обеспечивает синтез АТФ, участвующей в образовании нуклеозидтрифосфатов, необходимых для синтеза РНК и ДНК
4. Биосинтез углеводов зависит от обмена нуклеиновых кислот (Пример: УТФ в синтезе УДФ-глюкозы, участвующей в синтезе олиго- и полисахаридов)
Взаимосвязь обменов нуклеиновых кислот и липидов
1. При распаде пиримидиновых оснований образуется -аланин, участвующий в синтезе коэнзима А, необходимого для новообразования и окисления жирных кислот:
2. В-Окисление жирных кислот – источник АТФ, 3. Нуклеозидтрифосфаты через образование нуклеозиддифосфатов участвуют в биосинтезе липидов (образование ЦДФ-холина, ЦДФколамина, ЦДФ-диглицеридов)


VIII. ВОДНО-МИНЕРАЛЬНЫЙ ОБМЕН
68-69. Роль воды в организме. Водный баланс, его регуляция и патология. Макроэлементы: натрий, калий, хлор, магний.
Содержание воды в организме человека зависит от возраста, особенностей питания, пола и других факторов. Эмбрион человека 1,5 месяцев содержит 97.5% воды, 4-х месяцев - 91-92%, плод 7-8 месяцев - 83-85% воды, новорожденные дети 74-77%, взрослые мужчины - 60-65%, лица старше 81 года содержат около 50% воды.
Вода в составе тканей
Чем интенсивнее обмен веществ в ткани, тем выше в ней содержание воды.
•кровь содержит 81% воды,
•мышцы - 75%,
•костная ткань – 20%,
•серое вещество мозга - 84%,
•белое вещество мозга – 70%
Функции воды:
вода является растворителем,
регулятор теплового баланса в организме,
транспортная функция,
обеспечивает тургор тканей,
среда для химических реакций,
участник химических реакций,
в жидкой среде осуществляется переваривание и всасывание,
структурная функция воды.
Водный баланс
У взрослого здорового человека водный баланс равен нулю. В норме количество потребляемой и образующейся в процессе метаболизма воды равно количеству выделяемой из организма воды.
Приём воды |
мл/сутки |
Потеря воды |
мл/сутки |
питьё |
1200 |
моча |
1400 |
пища |
900 |
легкие |
400 |
Обменные процессы |
300 |
кожа |
500 |
|
|
кал |
100 |
всего |
2400 |
|
2400 |
Положительный водный баланс наблюдается при избыточном питье, массивных внутривенных введениях, почечной недостаточности, усилении выработки альдостерона, вазопрессина. Избыток воды приводит к перегрузке сердечно-сосудистой системы, вызывает изнуряющее потоотделение, сопровождающееся потерей солей и витаминов, ослаблением организма.
Отрицательный водный баланс наблюдается при резком ограничении поступления воды в организм, при рвоте, диарее, при несахарном диабете. у ожоговых больных: при потере 10% воды развивается интоксикация, при потере 20% воды наступает гибель организма.
Нарушение водно-электролитного баланса
Дегидратация, недостаток воды в организме возникает, если не восполняются потребности в ней. При избытке воды возникает гипергидратация, может развиться водная интоксикация. При белковой диете увеличивается потребность в воде.
Регуляция выделения воды осуществляется ЦНС, получающей информацию от натрио-, волюмо-, осморецепторов.
Антидиуретический гормон (вазопрессин) синтезируется в гипоталамусе, затем транспортируется в заднюю долю гипофиза, способствует увеличению реабсорбции воды в почечных канальцах, снижает диурез
Биологическое действие АДГ в клетках почечных канальцев
АДГ связывается с V2 –рецептором, вызывая активацию аденилатциклазы и образование цАМФ,
цАМФ активирует протеинкиназу, фосфорилирующую белки,
фосфорилированные белки индуцируют транскрипцию гена белка аквапорина,
аквапорин встраивается в мембрану клетки почечного канальца, образуя водные каналы.
Для АДГ существует 2 типа рецепторов: V1 и V2
Результатом действия АДГ через рецепторы V1 является сокращение гладкомышечного слоя сосудов (сосудосуживающий эффект)
Рецептор V2 находится на поверхности эпителиальных клеток почек. Результат действия на данный рецептор – реабсорбция воды из почечных канальцев (антидиуретическое действие).
При дефиците АДГ развивается несахарный диабет (гипотоническая полиурия). Происходит выделение большого количества мочи низкой плотности.
Альдостерон синтезируется в коре надпочечников, минералокортикоид, увеличивает реабсорбцию воды и натрия.
Стимулируют синтез альдостерона: ангиотензин II, АКТГ, простагландин Е, низкая концентрация ионов натрия, высокая концентрация ионов калия.
Ренин-ангиотензиновая система
Ренин - протеолитический фермент, клетках почечного клубочка.
Эффекты ангиотензина II
•стимулирует освобождение альдостерона, вазопрессина, вызывает жажду,
•сосудосуживающий эффект,
•сокращение гладких мышц,
•регуляция сократительной функции миокарда,
•участие в синтезе норадреналина и других БАВ,
•фактор роста (вызывает сосудистую и сердечную гипертрофию).
Ангиотензин-превращающий фермент
• фермент класса гидролаз,
• выделен из сыворотки крови,
Механизм действия:
• ангиотензин I- конвентирующая активность: ангиотензин I переводит в ангиотензин II,
• кинин-деградирующая активность: стимулирует распад брадикинина,
• неспецифическая гидролитическая активность: действует как эндопептидаза, катализирует гидролиз БАВ (в-энкефалина, в-цепи инсулина).
Натрий
В организме взрослого человека содержится 105 г натрия, из них во внеклеточном пространстве - 50%, в костной ткани - 40%, внутри клеток – 10%. В плазме крови взрослого человека содержание натрия 135 - 147 ммоль/л, у грудных детей – в 2 раза ниже. В сутки потребляется 3-6 г натрия, что превышает физиологическую потребность.
Потребность зависит от климата, национальных традиций, привычки человека.
Биологическая роль натрия
1. Участник буферных систем. Поддерживает кислотно-щелочное равновесие
2. Обеспечивает постоянство осмотического давления во внеклеточной жидкости.
3. Участвует в возникновении нервного импульса вместе с калием.
4. Обмен натрия – важное звено водно-солевого обмена. Одна молекула связывает 400 молекул воды.
5. Влияет на состояние мышечной и сердечно-сосудистой системы.
6. Активатор ферментов.
7. Способен повышать основной обмен.
8. Сопрягающий ион в наружной мембране животной клетки
9. Опосредует развитие гипертонической болезни за счёт увеличения объема внеклеточной жидкости и повышения тонуса капилляров и артериол.
Всасывание натрия происходит в тонком кишечнике.
Выводится натрий: с мочой, с потом, с калом, с пищеварительными соками.
Повышено выделение натрия при: потоотделении, ожогах, рвоте, асците.
Гипонатриемия
Причины гипонатриемии: недостаток натрия в пище, избыточное выведение натрия через почки (лечение диуретиками), кожу (ожоги, потоотделение), желудочно-кишечный тракт (рвота, понос), избыточное поступление воды, патологическая задержка воды в организме.
Клинические проявления: слабость, головокружение, потеря веса, апатия, обмороки, тахикардия, гипотония, олигурия, снижение тургора и сухость кожи, снижение внутриглазного давления, дегидратация.
Гипернатриемия
Причины гипернатриемии: избыточное потребление натрия, осмотические перегрузки (при переедании с мочой выводится много азота и воды), несахарный диабет (при недостатке вазопресссина), гиперальдостеронизм.
Клинические проявления: артериальная гипертония, гипергидратация.
Калий
– внутриклеточный катион: 98% калия находится в клетках, 2% - во внеклеточной жидкости. В плазме крови - 3,5 – 5,6 ммоль/л. В сутки в организм человека должно поступать с пищей 2- 4 г калия.
Калий является незаменимым элементом питания
Пищевые источники калия курага, картофель, бананы, морковь, цитрусовые, клюква, виноград, яблоки, калина, мёд, перец красный.
Биологическая роль калия
участвует в процессах нервно-мышечной возбудимости (недостаточность калия ведёт к мышечной слабости),
вместе с натрием создаёт потенциал покоя и действия клетки,
дефицит калия приводит к нарушению синтеза макроэргов,
принимает участие в синтезе гликогена, белков,
влияет на ритм сердечных сокращений (при дефиците калия снижается возбудимость миокарда),
из-за низкого содержания калия в плазме роль в поддержании осмотического давления невелика.
Гипокалиемия
Причины гипокалиемии недостаток калия в пище, рвота, поносы, сахарный диабет, использование диуретиков, при усиленной продукции альдостерона калий теряется с мочой.
Клинические проявления: нарушение нервно-мышечной передачи, слабость, гипотония, запоры, аритмии, нарушение функции почек, алкалоз, депрессия, обмороки.
Признаки недостатка калия в организме снижение умственной деятельности, памяти, кожный зуд, понижение физической выносливости, повышение чувствительности к холоду, мозоли на подошвах ног, запоры, подверженность простудам, пропадает аппетит, тошнота, рвота, медленно заживают порезы и ушибы, кариес, угревая сыпь, судороги мышц, боли в суставах, плохой сон.
Гиперкалиемия
Причины гиперкалиемии избыточное потребление калия: алиментарное, при парентеральном питании, при переливании длительно хранившейся крови, выход калия из клеток при: массивном повреждении ткани, активном катаболическом процессе, системном ацидозе, недостаточности инсулина, уменьшение выделения калия при: острой почечной недостаточности, приёме калий-сохраняющих диуретиков, недостатке минералокортикоидов, болезни Аддисона, адреналэктомии.
Клиника гиперкалиемии сонливость, брадикардия, гипотония, нарушения ритма сердечных сокращений, параличи, парезы.
Хлор
основной внеклеточный анион: 90% хлора находится во внеклеточной жидкости, содержание в сыворотке: 97-108 ммоль/л, Пищевые источники хлора: молоко, мясо, яйца.
Хлор легко всасывается. Выделяется с мочой, потом, калом.
Биологическая роль хлора
поддерживает осмотическое давление внеклеточной жидкости,
входит в состав соляной кислоты желудочного сока,
активатор ферментов (амилаза),
поддерживает кислотно-щелочное равновесие.
Депо хлора кожа, соединительная ткань, подкожная клетчатка.
Недостаток хлора возникает при рвоте, гиперацидных состояниях, повышенной потливости.
Магний
В организме взрослого человека содержится 140 г магния.
Пищевые источники магния: зелёные овощи, соль, вода.
Биологическая роль магния
участие в обмене белков, жиров и углеводов,
участие в синтезе белков и нуклеиновых кислот,
участие в переносе, хранении, утилизации энергии,
снижение возбудимости нейронов,
замедление нейромышечной передачи,
расслабление гладкой мускулатуры,
снижение артериального давления,
магний – кофактор ферментов.
1) необходим для активности ряда ключевых ферментов, обеспечивающих метаболизм;
2) участвует в поддержании нормальной функции нервной системы и мышцы сердца;
3) оказывает сосудорасширяющее действие;
4) стимулирует желчеотделение;
5) повышает двигательную активность кишечника;
6) способствует выведению шлаков из организма;
7) способствует выведению холестерина.
Усвоению магния мешают наличие фитина и избыток жиров и кальция в пище.
Суточная потребность 400 мг в сутки.
У беременных и кормящих повышается потребность на 50 мг в сутки.
При недостатке магния в питании нарушается усвоение пищи, задерживается рост, в стенках сосудов обнаруживается кальций.
Магнием богаты в основном растительные продукты.
Большое количество содержат пшеничные отруби, крупы (овсяная и др.), бобовые, урюк, курага, чернослив. Мало магния в молочных продуктах, мясе, рыбе, макаронных изделиях.
Гипермагнезиемия
седативный эффект, снижение артериального давления, вялость, сонливость.
Гипомагнезиемия
дрожь, спазмы мышц, судороги, рвота, диарея, раздражительность, аритмии, иммунодефициты, ранняя седина, кожные язвы.
70. Обмен кальция и фосфора в организме человека, его регуляция.
Кальций
В организме взрослого человека содержится 1,2 кг кальция.
В костях находится 99% от общего количества кальция:
85%- фосфат кальция,
10%- карбонат кальция,
5%- цитрат кальция и лактат кальция.
В плазме крови содержится 2,25-2,75 ммоль/л кальция:
50%- ионизированный кальций,
40%- кальций, связанный с белком,
10%- соли кальция.
Суточная потребность- 1,3-1,4 г кальция. При беременности и лактации - 2 г/сутки.
Пищевые источники:
молоко, сыр, рыба, орехи, бобы, овощи.
Всасывание кальция происходит в тонком кишечнике при участии кальцитриола.
зависит от соотношения фосфора и кальция в пище. Оптимальное соотношение для совместного усвоения 1:1-1,5 находится в молоке.
Способствуют всасыванию кальция:
витамин D, цинк, желчные кислоты, цитрат.
Жирные кислоты тормозят всасывание кальция.
Биологическая роль кальция
в костной и зубной ткани кальций находится в виде гидроксиапатита Са10(РО4)6(ОН)2,
вторичный посредник в передаче регуляторных сигналов,
влияет на сердечную деятельность,
фактор системы свёртывания крови,
участвует в процессах нервно-мышечной возбудимости,
активатор ферментов (липазы, протеинкиназы),
влияет на проницаемость клеточных мембран.
Гипокальциемия наблюдается при: рахите, гипопаратиреозе, механической желтухе, болезнях почек, остеомаляции, туберкулёзе, при этом повышается нервно-мышечная возбудимость, появляются судороги.
Гиперкальциемия наблюдается при: передозировке витамина D, злокачественных опухолях с метастазами в кость, заболеваниях крови (лейкоз, лимфома, миелома), саркоидозе, туберкулёзе, тиреотоксикозе, хроническом энтерите, первичной гиперфункции паращитовидных желёз.
Фосфор
В организме взрослого человека содержится 1 кг фосфора.
90% фосфора содержится в костной ткани:
в виде фосфата кальция (2/3)
растворимые соединения (1/3).
8-9% - внутри клеток,
1% — во внеклеточной жидкости.
В плазме крови содержится 0,6- 1,2 ммоль/л фосфора
(у детей больше в 3-4 раза) в виде:
ионов, в составе фосфолипидов, нуклеиновых кислот, эфиров.
Суточная потребность -2 г фосфора.
Пищевые источники:
морская рыба, молоко, яйца, орехи, злаки.
Биологическая роль фосфора
Входит в состав:
костной ткани, фосфолипидов, фосфопротеинов, коферментов, нуклеиновых кислот, эфиров, буферных систем плазмы и тканевой жидкости.
Гиперфосфатемия
установлена при гипопаратиреозе, лейкозах, гипервитаминозе D, УФ – облучении
Гипофосфатемия
возникает при рахите, остеомаляции, гиперпаратиреозе
Регуляция фосфорно-кальциевого обмена
Регулируют обмен кальция и фосфора:
Паратгормон, кальцитриол, кальцитонин, СТГ, паротины.
Органы-мишени:
костная ткань, почки, кишечник.
Cоматотропный гормон
способствует росту скелета,
повышает синтез коллагена,
стимулирует синтез ДНК и РНК.
Паротины – гормоны слюнных желёз.
способствуют минерализации зуба,
индуцируют отложение фосфорно-кальциевых соединений.
Кальцитонин
- пептид из 32 аминокислот
Секретируется клетками щитовидной железы.
Мишень кальцитонина – костная ткань
Кальцитонин способствует:
отложению кальция и фосфора в кости в результате деятельности остеобластов,
подавлению резорбции кости (ингибитор остеокластов).
При действии кальцитонина концентрация кальция в крови уменьшается и возрастает в костях
71. Микроэлементы: железо, медь, цинк, марганец, молибден, стронций, кобальт, селен, фтор, йод. Микроэлементозы, виды, причины развития. биохимия гормонов
Железо:
Общее количество железа в организме: у женщин: 3-4 г, у мужчин: 3-5 г,
65 % - железо гемоглобина,
10 % - железо миоглобина,
5 % - железо в составе ферментов,
20 % железа депонировано в печени, костном мозге, селезёнке (связано с ферритином, гемосидерином),
0,1-0,2 % - транспортное железо.
На 1 г гемоглобина приходится 3,4 мг железа.
В сутки требуется 3-5г железа
Источники: мясо, печень, яблоки, гранаты, земляника, фасоль, чернослив, бобы, петрушка.
Биороль:
транспорт электронов (цитохромы, железосеропротеины),
транспорт и депонирование кислорода (миоглобин, гемоглобин, гемэритрин),
участие в формировании активных центров ферментов (оксидазы, гидроксилазы, СОД, каталаза, пероксидаза),
транспорт и депонирование железа (трансферрин, ферритин, гемосидерин).
Понижена концентрация железа при:
железодефицитных анемиях, раке печени, обтурационной желтухе, гемосидерозе внутренних органов, дефиците витамина С, миоме матки, болезнях почек.
Повышена при:
чрезмерной резорбции железа (частые переливания крови), гемолитической анемии, болезнях печени, хроническом холецистите, свинцовой интоксикации, талассемии, гипопластической и апластической анемиях
Гиперсидероз - избыточное содержание железа в организме.
Причины повышения концентрации железа в сыворотке:
-усиление деградации эритроцитов при гемолитической анемии,
-нарушение синтеза гемоглобина (В12-дефицитная анемия),
-острый гепатит,
-гемосидероз,
-гемохроматоз.
Понижение при:
-недостаточном поступлении железа в организм,
-нарушении депонирования железа при беременности,
-гастроэктомии,
-снижении кислотности и ахлоргидрии,
-хронической диарее, стеаторее,
-неспецифическом колите,
-потерях крови,
-язвенной болезни.
Всасывание железа происходит в двенадцатиперстной кишке
Улучшают всасывание железа: соляная кислота, аскорбиновая кислота, животный белок, простые углеводы (лактоза, фруктоза, сорбит), лизин, гистидин, цистеин, медь, кобальт.
Подавляют всасывание железа: жир, фосфаты, фитин.
Транспортные формы железа:
1)Трансферрин
гликопротеин, молекулярная масса 77 кД, синтезируется в печени, транспортирует железо, одна молекула трансферрина связывает 2 атома железа.
Атомы железа транспортируются в клетку путём взаимодействия комплекса Fe-трансферрин со специфическими рецепторами мембраны
2)Лактоферрин
Находится лактоферрин в: женском молоке, бронхиальном секрете, цитоплазме нейтрофилов, слюне, слезе.
3) Ферритин – основная форма депонированного железа.
Накапливается в: печени, селезёнке, костном мозге.
Избыток железа в тканях содержится в виде гемосидерина.
Медь:
В организме взрослого человека содержится 100-150 мг меди.
50% меди находится в мышцах и костях,
10% - в печени.
Пищевые источники: грибы, печень, орехи, соя, кофе, овощи, морепродукты.
Суточная потребность 2-5 мг меди.
Биороль:
составная часть электронпереносящих белков, цитохромоксидазы,
стимулятор эритропоэза и образования гема (при дефиците меди нарушается всасывание и мобилизация железа),
входит в состав 30 ферментов: СОД, уратоксидазы, тирозиназы, аминооксидазы, оксигеназы,
необходима для нормального развития соединительной ткани и кровеносных сосудов (коллаген, эластин),
необходима для формирования костной ткани.
Гиперкупремия наблюдается при:
стрессе, беременности, острых и хронических воспалениях, лейкозах, апластических анемиях, мегабластических анемиях, талассемиях, гипер- и гипофункции щитовидной железы, билиарном циррозе, инфаркте миокарда, заболеваниях почек.
«Медная лихорадка» возникает при работе с медной пылью, медьсодержащими фунгицидами.
Гипокупремия при:
-нехватки меди в рационе,
- недостаточном белковом питании,
- у новорожденных на искусственном вскармливании,
- в результате потери или распада церулоплазмина (нефротический синдром, диспротеинемия),
- болезни Вильсона-Коновалова (гепатоцеребральная дистрофия),
- синдроме Менкеса,
- синдроме Марфана.
Болезнь Вильсона Коноваловалова:
эндогенный дискупреоз,
сочетание цирроза печени с дистрофическим процессом в головном мозге,
причиной является аномальный церулоплазмин,
медь выводится с мочой и откладывается в тканях (роговице, мозге, печени).
Синдром Менкеса
умственная отсталость, отставание в росте, снижение температуры до 35 градусов,
аномалии в стенке артерий,
нарушение в структуре метафизов длинных костей,
снижение концентрации меди в крови, печени, мозге,
смерть до 3 лет.
В основе заболевания лежит нарушение всасывания меди в кишечнике.
Синдром Морфана
недостаточность лизилоксидазы,
медьдефицитное заболевание,
«птичье» лицо,
аневризма аорты,
страдает эластин, узкий череп,
врождённая гипопластическая мезодермальная дистрофия.
Кобальт:
поступает в организм с печенью, почками, растительной пищей, витамином В12.
Биороль:
активатор ферментов (фосфатазы, дыхательных ферментов),
стимулятор кроветворения,
активатор окислительного фосфорилирования,
влияет на синтез компонентов адениловой системы,
повышает неспецифическую резистентность организма,
избирательно накапливается в железистых органах, лимфоузлах.
У новорожденных снижено содержание кобальта.
В больших дозах: поражает: органы дыхания, систему кроветворения, вызывает сердечную недостаточность.
Дефицит кобальта наблюдается при дефиците витамина В12.
Марганец
В организме взрослого человека содержится 10–20 мг.
Много марганца в костях, сетчатке, печени, почках, лейкоцитах, митохондриях клеток.
Пищевые источники: бобы, злаки.
Биологическая роль марганца
• входит в состав ферментов (пируваткарбоксилаза, аргиназа, СОД), в качестве кофактора активирует киназы, фосфатазы, трансферазы,
• необходим для эритропоэза, ускоряет созревание ретикулоцитов,
• нужен для синтеза ГАГ хрящевой ткани,
• влияет на центральную нервную систему, (судороги при дефиците марганца),
• необходим для нормального роста ребенка,
• ускоряет образование антител,
• стимулирует синтез холестерина,
• необходим для нормальной секреции инсулина,
• необходим для костеобразования
Избыточное поступление марганца
• ведет к повышению его концентрации в костях и появлению в них изменений, идентичных изменениям при рахите (марганциевый рахит).
• Марганец – это агрессивный нейротропный яд. Ему присущи кумулятивные свойства. Возможны производственные отравления при добыче руды.
Дефицит Mn приводит к нарушению синтеза гликозаминогликанов хрящевой ткани и задержке роста.
Цинк
В организме взрослого человека 1,5-2 г цинка:
из них 98% содержится внутри клеток,
2% в сыворотке.
В плазме крови содержится 17,1 мкмоль/л цинка.
Много цинка в ткани глаза, слезе, слюне, печени, костной ткани, простате, железах внутренней секреции.
Пищевые источники яйца, мясо, молоко, печень, морские продукты, грибы, укроп, чеснок, зерно.
Суточная потребность 15 мг цинка.
Всасывание цинка в тонком кишечнике
Усиливают: высокий уровень белка в рационе, лизин, цистеин, глицин, глутаминовая кислота, низкий уровень железа в рационе, простагландин Е2.
Уменьшают: фитин, медь, высокий уровень железа в рационе, клетчатка, высокий уровень кальция в рационе, низкое содержание белка.
Выводится цинк на 90% с калом, на 10% с мочой, потом, желчью.
В сыворотке крови цинк связан с альбумином, α2- макроглобулином, трансферрином, цистеином, гистидином.
Биологическая роль цинка
более 200 ферментов имеют в своем составе цинк (СОД, карбоангидраза, ЛДГ, МДГ, аминопептидазы, фосфолипаза С, ДНК-полимераза, альдолаза, пируваткарбоксилаза),
участввует в синтезе белка и нуклеиновых кислот (в кодазах, обратных транскриптазах есть цинк, нужен для образования пептидной связи),
антиоксидант (стабилизирует сульфгидрильные группы, клеточные мембраны),
обладает липотропными свойствами,
усиливает заживление ран,
стимулирует синтез гормонов,
участвует в кальцификации
влияет на развитие мозга, вкус, обоняние,
влияет на иммунный ответ, необходим для действия Т-лимфоцитов,
подавляет размножение вирусов,
принимает участие в метаболизме витамина А (синтез ретинол-связывающего белка).
При недостатке цинка угнетается образование антител, снижается число лимфоцитов, падает масса тимуса, снижение иммунитета, дерматит, гиперкератоз кожи, изменения слизистых и кожи, диарея,тяжелые вирусные, грибковые, бактериальные поражения, нарушение вкуса, обоняния, адаптации в темноте, нейропсихические нарушения, остеомаляция, задержка роста, полового развития.
Падает содержание цинка в плазме при стрессе, инфаркте миокарда, анемиях, гломерулонефрите.
Этот процесс регулируется лейкоцитарным эндогенным медиатором.
Он вырабатывается фагоцитами.
Причины недостатка цинка в организме человека
недостаточное поступление с пищей,
нарушение всасывания из-за воспалительных заболеваний кишечника,
недостаточность поджелудочной железы,
повышенное выделение при приёме мочегонных препаратов,
нехватка белков (при циррозе печени),
действие алкоголя,
стрессы, инфекции, анемии.
Селен
всасывается черех кожу, легкие, пищеварительный тракт.
транспортируется белками: селенопротеин Р из плазмы, селенопротеин Р из почек и печени.
выделяется через почки, кишечник, с выдыхаемым воздухом.
В организме человека селен находится в: эритроцитах, печени, почках,
поджелудочной железе
Биологическая роль:
входит в активный центр глутатионпероксидазы, является антиоксидантом,
селен входит в селеноаминокислоты (селенометионин, селеноцистеин),
участвует в окислительно-восстановительных процессах, дыхании клетки,
антиканцерогенный, антимутагенный эффект.
При недостатке селена:
у животных развивается алиментарная мышечная дистрофия, у людей – эндемическая миокардиопатия, алиментарная дистрофия поджелудочной железы, кистозный фиброз поджелудочной железы, нарушается воспроизводительная функция, эозинофильный энтерит.
При избытке селена: развивается селеновый токсикоз: поражение ногтей, волос, шелушение кожи, желтушность, поражение эмали зубов, артриты, анемия, расстройства нервной системы.
Молибден
содержится в зелёных растениях, всасывается в тонком кишечнике, выделяется с мочой, молибден и медь – антагонистты.
Биологическая роль:
1. В животных организмах присутствуют 3 молибденсодержащих фермента: ксантиноксидаза, альдегидоксидаза, сульфитоксидаза.
2. Молибден – ростовой фактор бактерий.
Может привести к избыточному размножению
их в кишечнике.
Сульфитоксидаза превращает сульфит в сульфат.
При генетическом дефекте этого фермента: аномалии мозга, умственная отсталость, эктопия хрусталика, повышенное выделение с мочой сульфатов.
Молибденовая подагра
возникает при повышенном синтезе ксантиноксидазы,
образуется много мочевой кислоты,
почки не справляются с выделением мочевой кислоты.
Йод
В организме взрослого человека 20-30 мг йода.
10 мг содержится в щитовидной железе.
Суточная доза -150 мкг йода.
Йод всасывается через кожу, слизистые, лёгкие.
Выделяется через почки,
экскреторными железами
Пищевые источники: морские продукты (рыба, водоросли), редька, морковь, помидоры, ревень. горох, грибы, клубника, капуста, лук, желток.
Биологическая роль:
нужен для функционирования щитовидной железы,
связан с сопротивляемостью организма,
оказывает седативное влияние на ЦНС,
повышает умственную работоспособность,
один из лучших катализаторов окислений в организме.
Восполнен недостаток йода может быть: пищей, богатой йодом, смазыванием йодом, применением йодистых препаратов: рыбий жир, таблетки из водорослей, раствор Люголя, раствор йода.
Дефицит йода
Увеличение щитовидной железы и формирование эндемического зоба;
Нарушение выработки гормонов щитовидной железы;
Снижение основного обмена, температуры тела;
У детей – развитие кретинизма, отсталость в физическом и умственном развитии.
Избыток йода
развитие тиреотоксикоза (увеличение уровня гормонов щитовидной железы);
снижение массы тела; диспептические расстройства ломкость и выпадение волос;
мышечная слабость, паралич;
снижение прочности скелета, разрушение зубов;
развитие токсикодермии (йододерма)
формирование диффузного токсического зоба; тахикардия;
развитие йодизма (асептического воспаления) слизистых оболочек в местах интенсивного выделения йода (дыхательные пути, слюнные железы и пр.).
Микроэлементозы – патологические процессы, вызванные дефицитом, избытком или дисбалансом микроэлементов в организме
Различают микроэлементозы: природные, техногенные, Ятрогенные
Природные микроэлементозы
не связаны с деятельностью человека,
могут быть экзогенными и эндогенными,
приурочены к определённым географическим областям,
к ним относятся эндемические заболевания (флюороз, недостаточность йода).
Техногенные микроэлементозы связаны с производственной деятельностью человека.
Различают:
промышленные микроэлементозы – развиваются в зоне производства
соседские микроэлементозы – развиваются вблизи заводов, промышленных предприятий,
трансгрессивные микроэлементозы – развиваются в отдалении от производства за счёт водного или воздушного переноса микроэлементов.
Ятрогенные микроэлементозы
связаны с интенсивным лечением, диализом. Диализ не обеспечивает организм необходимым уровнем жизненно важных микроэлементов.
Вторичные микроэлементозы возникают
как следствие хирургических операций на ЖКТ с повреждением основных зон всасывания микроэлементов,
при гельминтозах (описторхоз, дифиллоботриоз).
72. Эндокринная система организма. Классификация гормонов по химической структуре. Роль гормонов в регуляции обменных Процессов. Причины развития эндокринных заболеваний. Механизм действия гормонов.
Амины
Дофамин - ЦНС
Норадреналин - ЦНС, мозговой слой надпочечников
Адреналин - Мозговой слой надпочечников
Мелатонин - Эпифиз
Иодтиронины
Тироксин (Т4) - Щитовидная железа
Трииодтиронин (Т3) - Периферические ткани (щитовидная железа)
Небольшие пептиды
Вазопрессин (антидиуретический гормон, АДГ) - Задняя доля гипофиза
Окситоцин - Задняя доля гипофиза
Меланоцитстимулирующий гормон (МСГ) - Промежуточная доля гипофиза
Соматостатин (СРИФ) - Гипоталамус, ЦНС, панкреатические островки
Соматокринин (СТГ-РГ, СТГ-РФ) - Островковые опухоли, гипоталамус, ЦНС
Ангиотензины (А II, А III) - Кровь (из предшественника), ЦНС
Белки
Инсулин - бета-клетки, панкреатические островки
Глюкагон - альфа-клетки, панкреатические островки
Гормон роста, или соматотропин (ГР, СТГ) - Передняя доля гипофиза
Пролактин (ПРЛ) - Передняя доля гипофиза
Паратгормон (ПТГ) - Паращитовидные железы
Энкефалин - Гипофиз, ЦНС
Кальцитонин - К-клетки, щитовидная железа
АКТГ - Передняя доля гипофиза
Секретин - Желудочно-кишечный тракт, ЦНС
Холецистокинин (ХЦК) - Желудочно-кишечный тракт, ЦНС
Гастрин - Желудочно-кишечный тракт, ЦНС
Гликопротеины
Фолликулостимулирующий гормон (ФСГ) - Передняя доля гипофиза
Лютеинизирующий гормон (ЛГ) - Передняя доля гипофиза
Тиреотропный гормон (ТТГ) - Передняя доля гипофиза
Стероиды
Эстрогены - Яичники, плацента
Прогестерон - Желтое тело, плацента
Тестостерон - Семенники
Глюкокортикоиды - Кора надпочечников
Альдостерон - Кора надпочечников
Причины заболеваний эндокринной системы.
В основе любых заболеваний этой системы есть одна или несколько основных причин:
1) недостаточность того или иного гормона; 2) избыток какого-либо гормона; 3) производство железой ненормального (аномального) гормона; 4) устойчивость к действию гормона; 5) нарушение доставки, метаболизма или ритма его секреции; 6) одномоментное нарушение ряда гормональных систем.
А из-за чего это происходит в большей части случаев не всегда известно. В остальных же случаях это может происходить по следующим причинам.
Причины дефицита гормонов (врожденного или приобретенного) в большинстве случаев известны. К ним относятся
- инфекционные поражения желез внутренней секреции (низкий уровень кортизола при туберкулёзе надпочечников),
- врожденное недоразвитие (гипоплазия) этих желёз (врожденный гипотиреоз),
- кровоизлияния в железу или недостаточное кровоснабжение (послеродовой гипопитуитаризм),
- воспалительные процессы (сахарный диабет из-за панкреатита),
- аутоиммунные поражения (аутоиммунный тиреоидит, завершающийся гипотиреозом), опухоли (аденомы гипофиза),
- недостаточное поступление в организм веществ, необходимых для производства гормонов (гипотиреоз из-за дефицита йода),
- влияние различных токсических и веществ и излучения на железы внутренней секреции,
- ятрогенные причины (удаление околощитовидных желез при лечении болезни Грейвса).
Причинами избыточного производства гормонов чаще всего бывают
- избыточная стимуляция эндокринной железы факторами физиологической или патологической природы, в результате чего увеличивается производство гормона (гиперкортицизм при болезни Иценко – Кушинга),
- продукция гормона тканями, которые в норме не вырабатывают их (синдром Иценко – Кушинга),
- усиленное образование гормона в периферических тканях из имеющихся в крови предшественников (при поражении печени, где разрушается андростендион, избыточное его количество поступает в жировую ткань и там превращается в эстроген),
- ятрогенные причины (при лечении каких-либо заболеваний гормонами).
Причинами нарушения транспорта и метаболизма гормонов чаще всего является наличие патологии печени, но также может быть при некоторых физиологических состояниях, например, при беременности.
Продукция аномальных гормонов встречается довольно редко, причинами её может быть мутация одиночного гена (измененная молекула инсулина).
Резистентность к гормонам нередко имеет наследственное происхождение, но наиболее часто возникает из-за патологии гормональных рецепторов, в результате чего гормон не попадает в нужные ткани и клетки и не выполняет соответствующей функции (гипотиреоз вследствие образования аутоантител, блокирующих рецептор тиреотропного гормона)
Механизмы действия гормонов:
Гормон связывается со своими специфическими рецепторами на поверхности клетки; связывание запускает серию реакций, в результате которых образуются т.н. вторые посредники, оказывающие прямое влияние на клеточный метаболизм. Такими посредниками служат обычно циклический аденозиномонофосфат (цАМФ) и/или ионы кальция; последние высвобождаются из внутриклеточных структур или поступают в клетку извне. И цАМФ, и ионы кальция используются для передачи внешнего сигнала внутрь клеток у самых разнообразных организмов на всех ступенях эволюционной лестницы. Однако некоторые мембранные рецепторы, в частности рецепторы инсулина, действуют более коротким путем: они пронизывают мембрану насквозь, и когда часть их молекулы связывает гормон на поверхности клетки, другая часть начинает функционировать как активный фермент на стороне, обращенной внутрь клетки; это и обеспечивает проявление гормонального эффекта.
Второй механизм действия – через цитоплазматические рецепторы – свойствен стероидным гормонам (гормонам коры надпочечников и половым), а также гормонам щитовидной железы (T3 и T4). Проникнув в клетку, содержащую соответствующий рецептор, гормон образует с ним гормон-рецепторный комплекс. Этот комплекс подвергается активации (с помощью АТФ), после чего проникает в клеточное ядро, где гормон оказывает прямое влияние на экспрессию определенных генов, стимулируя синтез специфических РНК и белков. Именно эти новообразованные белки, обычно короткоживущие, ответственны за те изменения, которые составляют физиологический эффект гормона. Связавшись с мембранным рецептором гормон вызывает каскад реакций в самой клетке, но никак не влияет на генетический материал. Комплекс цитоплазматического Р и гормона может воздействовать на ядерные рецепторы и вызывать изменения в генетическом аппарате, что ведет к синтезу новых белков
73. Классификация гормонов по локализации их рецепторов. Вторичные посредники действия гормонов (простагландины, циклические нуклеотиды, инозитол-3-фосфат, диацилглицерол, кальций).
В зависимости от локализации рецепторов в клетках–мишенях гормоны можно разделить на три группы .
Первую группу составляют гормоны липидной природы. Будучи жирорастворимыми, они легко проникают через клеточную мембрану и взаимодействуют с рецепторами, локализованными внутри клетки,–как правило, в цитоплазме.
Вторая группа–белковые и пептидные гормоны. Они состоят из аминокислот и по сравнению с гормонами липидной природы имеют более высокую молекулярную массу и менее липофильны, из–за чего с трудом проходят через плазматическую мембрану. Рецепторы этих гормонов находятся на поверхности клеточной мембраны, так что белковые и пептидные гормоны в клетку не проникают.
Третью химическую группу гормонов составляют низкомолекулярные тиреоидные гормоны, образованные двумя аминокислотными остатками, связанными между собой эфирной связью. Эти гормоны легко проникают во все клетки тела и взаимодействуют с рецепторами, локализованными в ядре. Одна и та же клетка может иметь рецепторы всех трех типов, т.е. локализованные в ядре, цитозоле и на поверхности плазматической мембраны. Кроме того, в одной и той же клетке могут присутствовать разные рецепторы одного типа; например, на поверхности клеточной мембраны могут находиться рецепторы разных пептидных и/или белковых гормонов.
Вторичные посредники: 1)циклические нуклеотиды (цАМФ и цГМФ); 2)ионы Ca и 3)метаболиты фосфатидилинозитола.
Присоединение гормона к рецептору позволяет последнему взаимодействовать с G-белком. Если G-белок активирует систему аденилатциклаза-цАМФ, его называют Gs-белком. Стимуляция аденилатциклазы, связанной с мембраной фермента посредствам Gs-белка, катализирует превращение небольшого количества присутствующего в цитоплазме аденозинтрифосфата в цАМФ внутри клетки.
Следующий этап опосредован активацией цАМФ-зависимой протеинкиназой, которая фосфорилирует специфические белки в клетке, запуская биохимические реакции, что гарантированно обеспечивает ответ клетки на действие гормона.
Как только цАМФ образуется в клетке, это обеспечивает последовательную активацию ряда ферментов, т.е. каскадную реакцию. Таким образом, первый активированный фермент активирует второй, который активирует третий. Задача такого механизма заключается в том, что небольшое количество молекул, активированных аденилатциклазой, может активировать значительно большее количество молекул на следующем этапе каскадной реакции, что является способом усиления ответа.
В итоге благодаря этому механизму ничтожно малое количество гормона, действующее на поверхность мембраны клетки, запускает мощный каскад активирующих реакций.
Если гормон взаимодействует с рецептором, сопряженным с тормозящим G-белком (Gi-белок), это снижает образование цАМФ и, как следствие, снижает активность клетки.
74. Кортикостероидные гормоны. Химическая структура гормонов коры надпочечников, их влияние на обмен веществ. Дисфункция коры надпочечников.
75. Мужские и женские половые гормоны, химическая структура и влияние на обмен веществ. Тироксин, его синтез и влияние на обмен веществ. Гипотиреоз и гипертиреоз.
Кора надпочечников – жизненно важный орган.
В коре синтезируется свыше 50 кортикостероидов,7 – 10 из них - гормоны: глюкокортикоиды, минералокортикоиды, половые гормоны.
Глюкокортикоиды кортикостерон, кортизон, гидрокортизон, 11-дезоксикортизол, 11-дегидрокортикостерон.
Глюкокортикоиды состоят из 21 углеродного атома и имеют боковую цепь у 17 атома углерода.75-80 % глюкокортикоидов связаны с транскортином.10-15 % - с альбумином.
Органы-мишени для глюкокортикоидов соединительная ткань, мышцы, жировая ткань, лимфоидная ткань, печень, почки.
Влияние глюкокортикоидов на белковый обмен Глюкокортикоиды являются катаболиками в мышечной, лимфоидной, соединительной, жировой тканях. Снижают проницаемость клеток этих тканей для аминокислот и глюкозы, способствуют гипераминоацидурии, повышают выделение общего азота с мочой. В печени глюкокортикоиды – анаболики.
Влияние глюкокортикоидов на углеводный обмен: усиливают глюконеогенез из АМК, ингибируют ГК, снижают синтез гликогена в мышцах, активируют гликогенолиз.
на жировой обмен: стимулируют липолиз, активируя липазы, повышают содержание жирных кислот в крови. Из-за того, что жирные кислоты не успевают сгорать, развивается кетонемия и стероидный диабет.
Глюкокортикоиды: влияют на терморегуляционный центр, снижают синтез АТФ и адениловых нуклеотидов, оказывают противоаллергическое действие (угнетение образования иммуноглобулинов), оказывают противовоспалительное действие: уменьшают проницаемость капилляров,
ослабляют фагоцитарную активность лимфоцитов.Применение В клинике глюкокортикоиды применяют как десенсибилизаторы, противовоспалительные, иммунодепресснты. Используют при коллагенозах, бронхиальной астме.
Минералокортикоиды дезоксикортикостерон, альдостерон:
1) Действует на канальцевый аппарат почек: снижает реабсорбцию калия (нарушение сократительной способности мышц), повышает реабсорбцию натрия и хлора из первичной мочи повышается осмотическое давление крови, лимфы, тканевой жидкости повышается обратное всасывание воды в кровь.
2) Усиливает воспаление.Катаболизм гормонов 17-кетостероиды – конечные метаболиты гормонов- выводятся с мочой. у мужчин 10-25 мг в сутки.у женщин 5-15 мг в сутки.
Выделение увеличивается при: опухоли коры надпочечников и семенников, аддисоновой болезни, микседеме.
Гиперкортицизм Возникает при: опухоли коры надпочечников, поражении гипоталамо- гипофизарной системы (избыток либерина).
Проявляется повышенной секрецией всех кортикостероидов, либо одной группы гормонов.
Болезнь Иценко - Кушинга возникает при избытке кортизола При этом заболевании: «буйволовый» тип телосложения, повреждается миокард, снижается иммунитет, стероидный диабет, гипергликемия, гипертония.
Синдром Кона возникает при избыточном выделении альдостерона При этом заболевании: задержка натрия, хлора и воды в организме. теряется калий, отёки, гипертония, слабость, повышается возбудимость миокарда.
Гиперплазия коры надпочечников Гормонально активные опухоли
коры надпочечников:кортикостерома, андростерома, кортикоэстрома, альдостерома, смешаннные опухоли.
При опухоли, продуцирующей мужские половые гормоны в моче много 17-кетостероидов, появляются усы и борода у женщин.
Гипокортицизм Бронзовая болезнь (болезнь Аддисона) Причины: аутоиммунные поражения клеток коры надпочечников, туберкулёз, сифилис.
Клинические проявления: слабость, гипотония, гипогликемия, снижение концентрации натрия и хлора, повышение концентрации калия, пигментация кожи (кортикостерон связан с МСГ), снижается сопротивляемость к стрессам, инфекциям, снижается возбудимость миокарда.
Эстрогены синтезируются в яичниках, жёлтом теле, надпочечниках, семенниках, плаценте.
Женские половые гормоны 1) Эстрогены (эстрадиол, эстрон, эстриол).2) Прогестины (прогестерон).Секреция этих гормонов носит циклический характер:В первой фазе цикла выделяются эстрогены, а во второй – прогестерон (в жёлтом теле).
Женские половые гормоны



Биологическая роль эстрогенов Обеспечение репродуктивной функции организма: стимулируют рост яйцеводов и матки, усиливают размножение клеток эндометрия, усиливают сократительную функцию матки, стимулируют разрастание желёз эндометрия, в миометрии стимулируют синтез белка, увеличивают активность ферментов, анаболики, действуют на ЦНС.
Биологическая роль прогестерона Органы - мишени прогестерона: молочные железы, матка.
Прогестерон: стимулирует процессы, обеспечивающие наступление беременности и её сохранение до родов, готовит эндометрий матки к имплантации оплодотворённой яйцеклетки, стимулирует разрастание эндометрия, усиливает деятельность маточных желёз, стимулирует развитие железистой ткани молочных желёз, расслабляет маточную мускулатуру, влияет на ЦНС.
Релаксин – гормон плаценты, яичников, эндометрия.
Стимулирует размягчение лонного сращения, открытие шейки матки.
Плацентарные гормоны Хорионический гонадотропин – гликопротеин.
Стимулирует рост, развитие и секреторную активность жёлтого тела. эстрогены, прогестерон, релаксин, окситоцин, СТГ, ТТГ, АКТГ, глюкокортикоиды
Андрогены (тестостерон, андростерон, дегидроэпиандростерон) Синтезируются в семенниках, клетках яичников, клетках Лейдига, надпочечниках.Синтез регулирует ГТГ гипофиза.
Биологическая роль тестостерона формирование половых признаков (голос, гортань, скелет, мускулатура, волосы и др.), активирует сперматогенез, стимулирует развитие добавочных половых желёз (простаты), влияет на скорость закрытия эпифизарных зон роста, анаболический эффект – усиливает синтез белка в печени, почках, мышцах, влияет на ЦНС, влияет на фиксацию кальция и фосфора в костях, активация ЦТК и окислительных процессов.
Уровень тестостерона в крови после рождения повышается, достигает максимума к 1-3 месяцу, затем до 1 года снижается, повышается в пубертатном периоде.
Тестостерон применяют при лечении рака молочных желёз.
Эстрогены – при раке простаты.
Тироксин гормон щитовидной железы, производное тирозина, йодсодержащий гормон. На долю тироксина приходится ¾ всего йода, содержащегося в крови

Этапы синтеза тироксина Окисление йода катализирует фермент – тиреопероксидаза. Щитовидная железа – единственная ткань, способная окислять йод до состояния с более высокой валентностью, что необходимо для синтеза тиреоидных гормонов. Окисленный йод внедряется в тиреоглобулин. Происходит йодирование тирозина в составе тиреоглобулина. Образуются МИТ и ДИТ.
