
- •I. Химия белка
- •Функции белков:
- •5. Классификация и характеристика простых белков (альбумины, глобулины, гистоны, протамины, протеиноиды).
- •1. Альбумины
- •2. Глобулины
- •3.Гистоны
- •4.Протамины
- •5.Протеноиды
- •6. Классификация и характеристика сложных белков (липопротсины, хром-мопротеины, нуклеопротеины, гликопротеины, фосфопротеины).
- •II. Ферменты. Витамины.
- •7. Химическая природа ферментов, Активный и аллостерический центры фермента, их роль.
- •8. Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности.
- •9. Мультиферментные комплексы и изоферменты. Клиническое значение определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •11. Классификация ферментов. Общая характеристика класса оксидоредуктаз. Основные подклассы. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •12. Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •13. Классификация ферментов. Общая характеристика гидролаз. Основные подклассы гидролаз.
- •14. Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных реакций.
- •15. Классификация ферментов. Общая характеристика изомераз и лигаз. Коферменты изомеразных или глазных реакций.
- •16. Классификация витаминов. Причины развития витаминной недостаточности в организме человека. Авитаминозы, гиповитаминозы, гипервитаминозы, Антивитамины.
- •17. Витамин в1, его химическая структура, признаки витаминной недостаточности. Нарушение углеводного обмена при - витаминной недостаточности.
- •18. Витамины pp и в2, их структура, участие в обмене веществ, признаки витаминной недостаточности.
- •19. Витамины с и р, их структура, признаки витаминной недостаточности и влияние на обмен веществ.
- •20. Витамин биотин, их структура, признаки витаминной недостаточности и участие в обмене веществ.
- •21. Витамин b12, и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •22. Витамины а, е, к. Признаки витаминной недостаточности, участие в обмене веществ.
- •23. Витамин d, химическая природа витамина, гормонально-активные формы, участие витамина в обмене веществ. Рахит. Основные пути метаболизма. БиоэнергетическиЙ обмен.
- •24. Понятие об обмене веществ. Катаболизм и анаболизм, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •26. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс - потенциалы ферментных систем. Ингибиторы переноса электронов.
- •27. Окислительное фосфорилирование. Значение и механизм процесса. Расообщение дыхания и фосфорилирования. Свободное окисление. Субстратное фосфорилирование.
- •28. Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
- •29. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •IV. Обмен углеводов.
- •30. Классификация и химическая структура углеводов, их роль в обеспечении жизнедеятельности организма. Переваривание и всасывание углеводов в пищеварительном тракте. Мальабсорбция.
- •32. Структура гликогена и его синтез в клетках печени и мышц. Функциональные отличия гликогена этих тканей. Распад гликогена. Гликогенозы.
- •33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
- •II этап - окислительное декарбоксилирование пвк
- •III этап - Цикл Кребса
- •35. Апотомический путь обмена глюкозы (пентозный цикл). Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
- •36. Глюконеогенез. Основные субстраты и ключевые ферменты процесса. Цикл Кори.
- •38. Патология углеводного обмена. Сахарный диабет. Нарушения углеводного и липидного обменов при этом заболевании.
- •V. Обмен липидов
- •39. Классификация и химическая структура липидов. Роль липидов в обеспечении жизнедеятельности организма.
- •40. Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •41. Холестерин, его биосинтез и биологическая роль. Гиперхолестеринемия. Атеросклероз. Роль липопротеинов в обмене холестерина.
- •1)Наследственная.
- •42. Классификация и химическая структура фосфолипидов. Биологическая роль, переваривание, биосинтез и распад фосфолипидов. Липотропные вещества.
- •43. Переваривание и всасывание липидов, роль желчи в этом процессе. Желчные кислоты. Ресинтез липидов в клетке эпителия кишечника. Транспортные формы липидов. Биологическая роль жировых депо.
- •44. Липолиз триглицеридов в тканях. Окисление глицерина. Биоэнергетика процесса.
- •45. Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жирных кислот с нечетным количеством углеродных атомов и ненасыщенных жирных кислот.
- •46. Синтез жирных кислот. Внутриклеточная локализация, ферменты и коферменты процесса. Биосинтез триглицеридов.
- •47. Образование и распад кетоновых тел. Кетогенез в норме и при патологии.
- •48. Гормональная регуляция липидного обмена. Патология липидного обмена: гиперлипидемии, липоидозы, жировое перерождение печени, ожирение, атеросклероз.
- •3. Конденсация йодтирозинов
- •1. Аминокислоты и их производные:
- •2. Пептиды
28. Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
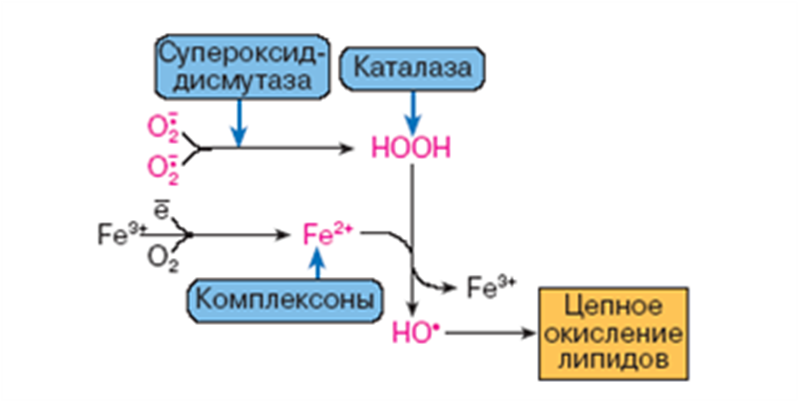
Свободнорадикальное окисление – важный и многогранный биохимический процесс превращений кислорода, липидов, нуклеиновых кислот, белков и других соединений под действием свободных радикалов, а перекисное окисление липидов (ПОЛ) – одно из его последствий. Свободные радикалами (СР) представляют собой соединения, имеющие неспаренный электрон на наружной орбите и обладающие высокой реакционной способностью. К числу первичных СР относятся супероксидный анион-радикал, окись азота, а вторичными СР являются гидроксильный радикал, синклетный кислород, перекись водорода, пероксинитрит. Образование СР тесно связано, с одной стороны, с появлением свободных электронов при нарушениях процессов окисления в дыхательной цепи, превращении ксантина, синтезе лейкотриенов и простогландинов. Эти реакции зависят от активности ксантиноксидазы, дегидроротатдегидрогеназы, льдегидоксидазы, холестериноксидазы, ферментов цитохрома Р-450.
Перекиси - вещества нестойкие и быстро разрушаются. В липиде появляются "ОН"-группы или кетогруппы. В тканях человека и животных имеются два фермента перекисного окисления: ЦИКЛООКСИГЕНАЗА и ЛИПООКСИГЕНАЗА. При окислении с участием циклооксигеназы одновременно с окислением происходит циклизация, при действии липооксигеназы окисление идет без циклизации.
29. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
Антиоксидантная система (АОС) - система защиты биополимеров от деструкции.
Различают:
ферментативное звено АОС,
неферментативное звено АОС.
Ферменты АО:
супероксиддисмутаза,
каталаза,
пероксидаза,
глутатионпероксидаза,
глутатионредуктаза,
церулоплазмин.
Супероксиддисмутаза СОД
О2 + О2 + 2Н+ (СОД)→ Н2О2 + О2
Ионы меди и цинка – кофакторы СОД,
СОД осуществляет удаление образовавшегося в клетке супероксидрадикала,
применяется для лечения пневмонии, инфаркта миокарда, ожогов глаз.
Супероксиддисмутаза человека: Cu, Zn – содержащие СОД
Cu – в активном центре, Zn – как кофактор, стабилизирующий конформацию.
СОД1 (цитозольная)
СОД2 (митохондриальная) – относится к Mn-содержащей
СОД3 (внеклеточная)_
СОД (в активном цетре)
Каталаза
2Н2О2 → 2Н2О + О2
Пероксидаза
Н2О2 + АН2 (пероксидаза)→ 2Н2О + А
АН2 - донор протонов (аскорбиновая кислота, фенолы).
Глутатионпероксидаза ГПО:
селеносодержащий фермент,
состоит из четырёх субъединиц, в активном центре каждой содержится селен,
катализирует восстановление гидропероксида или перекиси водорода с помощью глутатиона.
ROOH +2GSH → ROH + Н2О+ GSSG
Н2О2 +2GSH → 2Н2О+ GSSG
В отличие от каталазы более активна при малых концентрациях перекиси водорода
Церулоплазмин
основной антиоксидант плазмы крови,
«перехватчик» супероксидрадикалов,
обладает ферментативными свойствами,
осуществляет окисление Fe2+ в Fe3+.
Неферментативные антиоксиданты:
Антирадикальные ингибиторы отдают подвижный водород свободному радикалу.
InH +ROO· → In + ROOH
витамины: С, α-токоферол, β-каротин, К, Р,
белки: церулоплазмин, лактоферрин, трансферин, альбумин,
минеральные вещества: Se, Zn, Co, Fe, Cu,
гормоны: эстрогены, тироксин,
биогенные амины: серотонин, гистамин,
аминокислоты: фен, тир, три, мет, цис,
пигмент меланин,
мочевая кислота,
карнозин, ансерин,
глутатион,
таурин.
Белковые АО плазмы крови:
церулоплазмин,
Бито (α +β – глобулины плазмы крови) -неспецифические адаптогены,
Это имеет прямое отношение к их терапевтическому действию.
Применяются при ожогах и радиационных поражениях.
Слабыми антиоксидантными свойствами обладают:
альбумины,
трансферин,
лактоферрин.
Они связывают ионы железа или меди и тем самым предотвращают образование свободных радикалов из перекиси водорода.
Антиоксиданты по локализации делятся на:
внутриклеточные: ГПО, СОД, каталаза, не расходуются в процессе разрушения свободных радикалов,
встроены в мембраны: α-токоферол, β-каротин, убихинон, расходуются в процессе разрушения свободных радикалов,
во внеклеточных жидкостях: флавоноиды, полифенолы.
Идентифицируют 3 класса АО:
Первичные АО: ГПО, СОД, церулоплазмин, ферритин, трансферин,
предупреждают образование новых свободных радикалов.
Вторичные АО: витамин Е, С, β-каротин, МК, билирубин, альбумин,
удаляют образованные радикалы.
Третичные АО: ДНК-репарирующие ферменты, метионинсульфоксидредуктаза,
восстанавливают клеточные структуры, повреждённые свободными радикалами.
АО могут действовать как прооксиданты:
Это зависит от их редокс-потенциала и дозы потребления.
Приём β-каротина в дозе 20 мг в день повышает частоту возникновения рака лёгкого у курильщиков.
Синтетические АО:
Синтетические аналоги витаминов: водорастворимое производное витамина Е – динатриевая соль токоферолфосфата.
Ароматические фенолы и полифенолы: дибунол, порбукол.
Гетероароматические фенолы.
Азотистые гетероциклы.
Органическиие кислоты и их производные: мочевая кислота,
цистеин, глутатион, фитиновая кислота
способны угнетать формирование гидроксилрадикалов.
Фитиновая кислота способна угнетать формирование гидроксилрадикалов:
в сое, в рисе, в просе

