- •I. Химия белка
- •Функции белков:
- •5. Классификация и характеристика простых белков (альбумины, глобулины, гистоны, протамины, протеиноиды).
- •1. Альбумины
- •2. Глобулины
- •3.Гистоны
- •4.Протамины
- •5.Протеноиды
- •6. Классификация и характеристика сложных белков (липопротсины, хром-мопротеины, нуклеопротеины, гликопротеины, фосфопротеины).
- •II. Ферменты. Витамины.
- •7. Химическая природа ферментов, Активный и аллостерический центры фермента, их роль.
- •8. Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности.
- •9. Мультиферментные комплексы и изоферменты. Клиническое значение определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •11. Классификация ферментов. Общая характеристика класса оксидоредуктаз. Основные подклассы. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •12. Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •13. Классификация ферментов. Общая характеристика гидролаз. Основные подклассы гидролаз.
- •14. Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных реакций.
- •15. Классификация ферментов. Общая характеристика изомераз и лигаз. Коферменты изомеразных или глазных реакций.
- •16. Классификация витаминов. Причины развития витаминной недостаточности в организме человека. Авитаминозы, гиповитаминозы, гипервитаминозы, Антивитамины.
- •17. Витамин в1, его химическая структура, признаки витаминной недостаточности. Нарушение углеводного обмена при - витаминной недостаточности.
- •18. Витамины pp и в2, их структура, участие в обмене веществ, признаки витаминной недостаточности.
- •19. Витамины с и р, их структура, признаки витаминной недостаточности и влияние на обмен веществ.
- •20. Витамин биотин, их структура, признаки витаминной недостаточности и участие в обмене веществ.
- •21. Витамин b12, и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •22. Витамины а, е, к. Признаки витаминной недостаточности, участие в обмене веществ.
- •23. Витамин d, химическая природа витамина, гормонально-активные формы, участие витамина в обмене веществ. Рахит. Основные пути метаболизма. БиоэнергетическиЙ обмен.
- •24. Понятие об обмене веществ. Катаболизм и анаболизм, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •26. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс - потенциалы ферментных систем. Ингибиторы переноса электронов.
- •27. Окислительное фосфорилирование. Значение и механизм процесса. Расообщение дыхания и фосфорилирования. Свободное окисление. Субстратное фосфорилирование.
- •28. Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
- •29. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •IV. Обмен углеводов.
- •30. Классификация и химическая структура углеводов, их роль в обеспечении жизнедеятельности организма. Переваривание и всасывание углеводов в пищеварительном тракте. Мальабсорбция.
- •32. Структура гликогена и его синтез в клетках печени и мышц. Функциональные отличия гликогена этих тканей. Распад гликогена. Гликогенозы.
- •33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
- •II этап - окислительное декарбоксилирование пвк
- •III этап - Цикл Кребса
- •35. Апотомический путь обмена глюкозы (пентозный цикл). Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
- •36. Глюконеогенез. Основные субстраты и ключевые ферменты процесса. Цикл Кори.
- •38. Патология углеводного обмена. Сахарный диабет. Нарушения углеводного и липидного обменов при этом заболевании.
- •V. Обмен липидов
- •39. Классификация и химическая структура липидов. Роль липидов в обеспечении жизнедеятельности организма.
- •40. Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •41. Холестерин, его биосинтез и биологическая роль. Гиперхолестеринемия. Атеросклероз. Роль липопротеинов в обмене холестерина.
- •1)Наследственная.
- •42. Классификация и химическая структура фосфолипидов. Биологическая роль, переваривание, биосинтез и распад фосфолипидов. Липотропные вещества.
- •43. Переваривание и всасывание липидов, роль желчи в этом процессе. Желчные кислоты. Ресинтез липидов в клетке эпителия кишечника. Транспортные формы липидов. Биологическая роль жировых депо.
- •44. Липолиз триглицеридов в тканях. Окисление глицерина. Биоэнергетика процесса.
- •45. Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жирных кислот с нечетным количеством углеродных атомов и ненасыщенных жирных кислот.
- •46. Синтез жирных кислот. Внутриклеточная локализация, ферменты и коферменты процесса. Биосинтез триглицеридов.
- •47. Образование и распад кетоновых тел. Кетогенез в норме и при патологии.
- •48. Гормональная регуляция липидного обмена. Патология липидного обмена: гиперлипидемии, липоидозы, жировое перерождение печени, ожирение, атеросклероз.
- •3. Конденсация йодтирозинов
- •1. Аминокислоты и их производные:
- •2. Пептиды
26. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс - потенциалы ферментных систем. Ингибиторы переноса электронов.
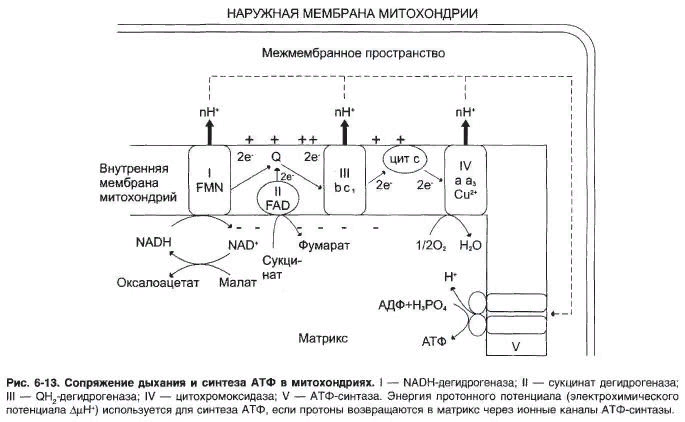
Дыхательная цепь – основной поставщик энергии для синтеза макроэргических связей молекул АТФ в процессе окислительного фосфорилирования. Последовательность оксидоредуктаз во внутренней мембране митохондрий, осуществляющая перенос электронов и протонов от субстрата на молекулярный кислород. 57% энергии выделяется в виде тепла.
Дыхательная цепь включает 4 ферментных комплекса, катализирующих окисление НАДН+Н кислородом.
НАДН-KoQ-редуктаза катализирует перенос электронов от НАДН к KoQ.
Этот комплекс включает в себя:
•НАДН-дегидрогеназу,
•негемовые FeS–кластеры,
•липиды,
•белки.
НАДН-дегидрогеназа
§ флавопротеин,
§ находится во внутренней мембране митохондрий.
§ Коферментом является ФМН, который принимает электроны от НАДН+Н.
ФМН + НАДН+Н ¨ФМНН2+НАД
В FeS–белках железо связано с остатком серы.
Сукцинат-KoQ-редуктаза катализирует перенос электронов от сукцината к KoQ
Этот комплекс включает в себя:
•СДГ,
•негемовое Fe,
•липиды,
•белки.
СДГ-флавопротеин, прочно связан с внутренней мембраной митохондрий.
Коферментом является ФАД.
KoQ(убихинон)
•Источники убихинона –витамины К и Е.
•KoQрасположен в дыхательной цепи между флавиновыми ферментами и цитохромами.
KoQ+ ФМНН2 ¨ KoQН2 + ФМН
Убихинон –коллектор, так как собирает восстановленные эквиваленты не только от НАДН-ДГ, но и от СДГ и других компонентов.
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
Функция:
Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
Функция
Восстановление ФАД в окислительно-восстановительных реакциях.
Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
3 комплекс. КоQ-цитохром с-оксидоредуктаза
Данный комплекс включает цитохромы b и c1. Кроме цитохромов в нем имеются 2 железо-серных белка. Всего насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кDа.
Функция
Принимает электроны от коэнзима Q и передает их на цитохром с.
Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди.
Функция
Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
-одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
-другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Редокс потенциал:
Указывает направление переноса электрона.
При сравнении редокс-потенциала системы с нормальным водородным электродом, потенциал которого равен нулю, получают величины, отражающие окислительно-восстановительные способности вещества.
Редокс-потенциал изменяется в цепи, т.к. электроны теряют свободную энергию, проходя по цепи, переходя на более низкий энергетический уровень.
Субстрат должен иметь более отрицательный потенциал, чем переносчик – фермент:
Глюкоза (-0,5 В) включается в самом начале цепи
Аскорбиновая кислота (+0,2 В) включается с цитохрома С1
Электроны могут пройти через все переносчики от субстрата к кислороду
Ингибиторы дыхания:
Инсектицид ротенон блокирует НАДН-ДГ.
Барбитураты блокируют переход от ФП к убихинону.
Антимицин А блокирует стадию: цитохром В цитохром С.
Цианиды, угарный газ – ингибиторы цитохромоксидазы.
Синильная кислота реагирует с Fe, угарный газ с Fe.