
- •I. Химия белка
- •Функции белков:
- •5. Классификация и характеристика простых белков (альбумины, глобулины, гистоны, протамины, протеиноиды).
- •1. Альбумины
- •2. Глобулины
- •3.Гистоны
- •4.Протамины
- •5.Протеноиды
- •6. Классификация и характеристика сложных белков (липопротсины, хром-мопротеины, нуклеопротеины, гликопротеины, фосфопротеины).
- •II. Ферменты. Витамины.
- •7. Химическая природа ферментов, Активный и аллостерический центры фермента, их роль.
- •8. Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности.
- •9. Мультиферментные комплексы и изоферменты. Клиническое значение определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •11. Классификация ферментов. Общая характеристика класса оксидоредуктаз. Основные подклассы. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •12. Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •13. Классификация ферментов. Общая характеристика гидролаз. Основные подклассы гидролаз.
- •14. Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных реакций.
- •15. Классификация ферментов. Общая характеристика изомераз и лигаз. Коферменты изомеразных или глазных реакций.
- •16. Классификация витаминов. Причины развития витаминной недостаточности в организме человека. Авитаминозы, гиповитаминозы, гипервитаминозы, Антивитамины.
- •17. Витамин в1, его химическая структура, признаки витаминной недостаточности. Нарушение углеводного обмена при - витаминной недостаточности.
- •18. Витамины pp и в2, их структура, участие в обмене веществ, признаки витаминной недостаточности.
- •19. Витамины с и р, их структура, признаки витаминной недостаточности и влияние на обмен веществ.
- •20. Витамин биотин, их структура, признаки витаминной недостаточности и участие в обмене веществ.
- •21. Витамин b12, и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •22. Витамины а, е, к. Признаки витаминной недостаточности, участие в обмене веществ.
- •23. Витамин d, химическая природа витамина, гормонально-активные формы, участие витамина в обмене веществ. Рахит. Основные пути метаболизма. БиоэнергетическиЙ обмен.
- •24. Понятие об обмене веществ. Катаболизм и анаболизм, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •26. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс - потенциалы ферментных систем. Ингибиторы переноса электронов.
- •27. Окислительное фосфорилирование. Значение и механизм процесса. Расообщение дыхания и фосфорилирования. Свободное окисление. Субстратное фосфорилирование.
- •28. Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
- •29. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •IV. Обмен углеводов.
- •30. Классификация и химическая структура углеводов, их роль в обеспечении жизнедеятельности организма. Переваривание и всасывание углеводов в пищеварительном тракте. Мальабсорбция.
- •32. Структура гликогена и его синтез в клетках печени и мышц. Функциональные отличия гликогена этих тканей. Распад гликогена. Гликогенозы.
- •33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
- •II этап - окислительное декарбоксилирование пвк
- •III этап - Цикл Кребса
- •35. Апотомический путь обмена глюкозы (пентозный цикл). Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
- •36. Глюконеогенез. Основные субстраты и ключевые ферменты процесса. Цикл Кори.
- •38. Патология углеводного обмена. Сахарный диабет. Нарушения углеводного и липидного обменов при этом заболевании.
- •V. Обмен липидов
- •39. Классификация и химическая структура липидов. Роль липидов в обеспечении жизнедеятельности организма.
- •40. Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •41. Холестерин, его биосинтез и биологическая роль. Гиперхолестеринемия. Атеросклероз. Роль липопротеинов в обмене холестерина.
- •1)Наследственная.
- •42. Классификация и химическая структура фосфолипидов. Биологическая роль, переваривание, биосинтез и распад фосфолипидов. Липотропные вещества.
- •43. Переваривание и всасывание липидов, роль желчи в этом процессе. Желчные кислоты. Ресинтез липидов в клетке эпителия кишечника. Транспортные формы липидов. Биологическая роль жировых депо.
- •44. Липолиз триглицеридов в тканях. Окисление глицерина. Биоэнергетика процесса.
- •45. Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жирных кислот с нечетным количеством углеродных атомов и ненасыщенных жирных кислот.
- •46. Синтез жирных кислот. Внутриклеточная локализация, ферменты и коферменты процесса. Биосинтез триглицеридов.
- •47. Образование и распад кетоновых тел. Кетогенез в норме и при патологии.
- •48. Гормональная регуляция липидного обмена. Патология липидного обмена: гиперлипидемии, липоидозы, жировое перерождение печени, ожирение, атеросклероз.
- •3. Конденсация йодтирозинов
- •1. Аминокислоты и их производные:
- •2. Пептиды
I. Химия белка
1. Функции белков в организме. Классификация белков.
По составу белки делят на две группы:
Простые белки (протеины) состоят только из аминокислот: протамины и гистоны обладают основными свойствами и входят в состав нуклеопротеидов. Гистоны участвуют в регуляции активности генома. Проламины и глютелины – белки растительного происхождения, составляют основную массу клейковины. Альбумины и глобулины – белки животного происхождения. Богаты ими сыворотка крови, молоко, яичный белок, мышцы.
Сложные белки (протеиды = протеины) содержат небелковую часть – простетическую группу. Если простетической группой является пигмент (гемоглобин, цитохромы), то это хромопротеиды. Белки, связанные с нуклеиновыми кислотами – нуклеопротеиды. Липопротеины – связаны с каким – либо липидом. Фосфопротеиды – состоят из белка и лабильного фосфата. Их много в молоке, в ЦНС, икре рыб. Гликопротеиды связаны с углеводами и их производными. Металлопротеины – белки, содержащие негеминовое железо, а также образующие координационные решетки с атомами металлов в составе белков – ферментов.
По форме различают
- глобулярные белки – это плотно свернутые полипептидные цепи сферической формы, для них важна третичная структура. Хорошо растворимы в воде, в разбавленных растворах кислот, оснований, солей. Глобулярные белки выполняют динамические функции. Например, инсулин, белки крови, ферменты.
- фибриллярные белки – молекулы вторичной структуры. Они построены из параллельных, сравнительно сильно растянутых пептидных цепей, вытянутой формы, собранные в пучки, образуют волокна (кератин ногтей, волос, паутины, шелка, коллаген сухожилий). Выполняют преимущественно структурную функцию.
Функции белков:
Строительная – белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран, шерсти, волос, сухожилий, стенок сосудов и т.д.
Транспортная – некоторые белки способны присоединять к себе различные вещества и переносить (доставлять) их из одного места клетки в другое, и к различным тканям и органам тела. Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ. В состав клеточных мембран входят особые белки, обеспечивающие активный и строго избирательный перенос некоторых веществ и ионов из клетки и в клетку – осуществляется обмен с внешней средой.
Регуляторная функция – принимают участие в регуляции обмена веществ. Гормоны влияют на активность ферментов, замедляя или ускоряя обменные процессы, изменяют проницаемость клеточных мембран, поддерживают постоянство концентрации веществ в крови и клетках, участвуют в процессе роста. Гормон инсулин регулирует уровень сахара в крови путем повышения проницаемости клеточных мембран для глюкозы, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Защитная функция = Иммунологическая. В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки - антитела, способные связывать и обезвреживать их. Синтез иммуноглобулинов происходит в лимфоцитах. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Двигательная функция. Сократительные белки обеспечивают движение клеток и внутриклеточных структур: образовании псевдоподий, мерцании ресничек, биении жгутиков, сокращении мышц, движении листьев у растений.
Сигнальная функция. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
Запасающая функция. В организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина железо не выводится из организма, а сохраняется в селезенке, образуя комплекс с белком ферритином. К запасным относятся белки яйца, молока.
Энергетическая функция. При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Распад идет сначала до аминокислот, а потом – до воды, аммиака и углекислого газа. Однако в качестве источника энергии белки используются тогда, когда израсходованы жиры и углеводы.
Каталитическая функция. Ускорение биохимических реакций под действием белков - ферментов.
Трофическая. Питают зародыш на ранних стадиях развития и запасают биологически ценные вещества и ионы.
Гомеостатическая – поддержани гомеостаза организма.
Создание биопотенциалов мембран
Индивидуальное строение органа
Обеспечение хорошего зрения
2. Аминокислоты - структурные единицы белка. Классификация аминокислот по структуре радикала. Заменимые и незаменимые аминокислоты. Значение для организма незаменимых аминокислот.
Классификация АМК основана на способности их к взаимодействию с водой при физиологических значениях Ph. Различают 4 классов АМК:
1.Неполярные R-группы
Глицин
Аланин
Валин
Лейцин
Изолейцин
Пролин
Метионин
Фенилаланил
Триптофан
2.Полярные, незаряженные R-группы
Серин
Треонин
Тирозин
Цистеин
Аспарагин
Глутамин
3.Отрицательно заряженные R-группы
Аспарагиновая кислота
Глутаминовая кислота
4. Положительно заряженные R-группы
Лизин
Аргинин
Гистидин
Классификация аминокислот по заменимости:
• заменимые,
• незаменимые (Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен) ,
• частично заменимые (Арг, Гис),
• условно заменимые (Цис, Тир),
• незаменимые АМК для детей: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен, Гис и Арг.
10 Амк не синтезируется в организме, поэтому они были названы – незаменимыми.
Незаменимость АМК для роста и развития организма животных и человека объясняются отсутствием способностей клеток синтезировать углеродные скелеты незаменимых АМК, поскольку процесс аминирования соотвестствующих кетопроизводных осуществляется сравнительно легко посредством реакции трансаминирования. Следовательно, для обеспечения нормальной жизнидеятельности человека все эти 10 АМК должны поступать с пищей.
Исключение какой-либо незаменимой АМК из пищевой смеси сопровождается развитием отрицательного азотистого баланса, истощением, остановка роста, нарушениями функций нервной системы и др.
Величины незаменимых АМК необходимых для оптимального роста, относительно триптофана, принятого за еденицу: Лизина 5, Лейцина 4, Валина 3,5, Фенилаланина 3,5, Метионина 3, Изолейцина 2.5, Треонина 2.5, Гистидина 2, Аргинин 1.
Отсутствие или недостаток Валина и Лизина – остановка роста.
Недостаток в пищи одной незаменимой АМК ведет к неполному усвоению других АМК.
При отсутствии Гис, Арг – анемия.
При отсутствии Три – катаракта.
При отсутствии Лиз — кариес, задержка роста.
При отсутствии Мет страдает печень.
3. Структура белковой молекулы, уровни организации. Особенности их формирования.
Первичная структура белка (1°)
Последовательность аминокислот в полипептидной цепи белка, связанных между собой ковалентными дисульфидными пептидными связями
1° придает специфичность белкам
генетически детерминирована и определяет 2°, 3° и 4° структуры белка
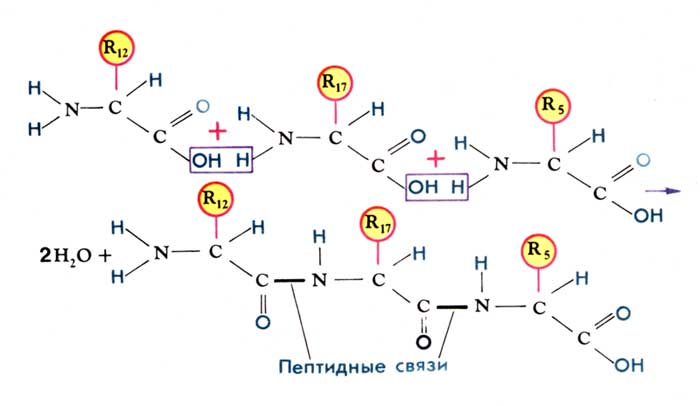
Особенности пептидной связи
Связь ковалентная, устойчивая
Копланарная (все 4 атома лежат в одной плоскости)
Жесткая
Расстояние между атомами N- и C- = 1,32 нм (расстояние является промежуточным между одинарной и двойной связью, что позволяет перегруппировать аминокислоты и повышает их реакционные свойства)
Особенности 1°
Не во всех белках есть все 20 аминокислот
Ни в одном белке аминокислоты не содержатся в равных соотношениях
Некоторые аминокислоты встречаются редко (гли встречается в 10 раз чаще, чем три)
Некоторые аминокислоты могут заменить друг друга в полипептидной цепи, не нарушая функцию белка
Принцип структурного подобия: в белках есть одинаковые пептидные последовательности (в трипсине – ала – сер – вал)
Количество аминокислот в полипептидной цепи должно быть не менее 50 - 100
Вторичная структура белка
Это пространственное расположение полипептидной цепи, поддерживаемое водородными связями между фрагментами цепи
Типы 2°: α – спираль и β – структура
α – спираль: Формируется между С=О и NH-группами сближенных полипептидных цепей
На 1 виток спирали приходится 3,6 амк остатков
Размер шага спирали 5,4 А (0,54 нм)
Угол наклона спирали относительно оси - 26°
Через каждые 5 витков (2,7 нм) конфигурация полипептидной цепи повторяется
Спираль может быть право- (в основном) и левозакрученная
% спирализации не является постоянным: на 100% спирализован парамиозин, на 50% - альбумин, на 28% - пепсин
Спирализация 2° определяется способностью формировать водородные связи и характером взаимодействия радикалов аминокислот
Способствуют спирализации – фен, лей, тир, трп, мет, вал
Дестабилизируют α-спираль – сер, иле, тре, глу, асп, лиз, арг
Нарушают α-спираль – пролин, оксипролин (образуются петли и изгибы)
β – структура (β – складчатость):
Параллельное или антипараллельное расположение полипептидных цепей, связанных водородными связями
На каждой плоскости находятся пептидные цепи, а радикалы выходят из структур
Характерна для β-кератина, белков волос, ногтей, шелка
Супервторичная структура (надвторичная структура) — Это организация полипептидной цепи, в которой последовательно чередуются α-спираль и β-структура, связанные сегментарными структурами
Третичная структура
Пространственная конфигурация α-спирали или линейных участков в трехмерном пространстве – фолдинг.
Пространственное расположение пептидной цепи, поддерживаемое межрадикальными связями.
Типы 3°: глобулярные белки, фибриллярные белки
Типы связей 3°:
Ковалентная дисульфидная связь: дисульфидные мостики между двумя молекулами цистеина
Нековалентная ионная связь – между заряженными полярными радикалами
Водородная связь – между полярными радикалами ОН-, SH-, NH2-, COOH
Нековалентные гидрофобные связи – между аминокислотами с неполярными радикалами – вал, ала, мет, фен
Пептидные
Гидрофобные
Межрадикальные
Слабые силы электростатического притяжения – ван-дер-ваальсовы силы
Значение 3°: определяет биологическую активность белка, определяет форму белковой молекулы
Фибриллярные
В пространстве расположены в виде фибрилл
Большинство белков не растворяются в воде
2° структура – β-складчатость, но есть и α-спираль
Основные белки – коллаген, эластин, кератин (белки костей, кожи, волос, ногтей, стромы роговицы, соединительной ткани)
Функция – структурная, защитная
Глобулярные
В пространстве расположены в виде глобулы
Многие белки растворимы в воде
2° структура – в основном α - спираль, но может быть и β - складчатость
Основные белки – альбумины, ферменты, иммуноглобулины, компоненты мембран и рибосом
Функция – каталитическая (ферменты), регуляторная (гормоны), транспортная (белки крови)
Белки с известной третичной структурой гемоглобин, трипсин, лизоцим, инсулин, цитохром.
Методы изучения третичной структуры рентгеноструктурный анализ, электронное микроскопирование.
Четвертичная структура
Это способ укладки в пространстве полипептидных цепей, которые обладают 1°, 2°, 3° структурой
Определяется числов и взаимным положением пептидных цепей в пространстве.
Типы связей:
гидрофобные
ионные
водородные
ван-дер-ваальсовы силы
Протомер – отдельно взятая белковая полипептидная цепь в 4°, которая не обладает активностью
Мультимерный белок – объединение протомеров
Например, гексокиназа содержит 2 протомера, гем - 4 протомера, изоцитратдегидрогеназа – 8 протомеров
Значение 4°:
4° определяет биологическую активность белка
Формирует регуляторный аллостерический центр ферментов
Формирует изомолекулярные белки
Все биологические свойства белка определяются 3°. Если разрушить 3°, то белок теряет свои свойства
Каждый белок характеризуется уникальной структурой, которая обеспечивает уникальность его функций
Белки с известной четвертичной структурой гемоглобин, ГЛДГ, миоглобин, ГК.
4. Физико-химические свойства простых белков (растворимость, высаливание, электрические свойства, денатурация).
Форма млдекул (глобулярные и фибриллярные)
Молекулярнаяя масса (колеблется от 6000 до 1 000000 Дл и выше. Зависит от количества АМК-остатков в полипептидной цепи, а для олигомерных – и от количества входящих в него протомеров)
Суммарный заряд молекул
Соотношение полярных и неполярных групп на поверхности нативной молекулы
Растворимость
Степень устойчивости к воздействию денатурации антигенов
Набухание
Высокая вязкость
Желатинирование
Оптическая активность
Подвижность в электрическом поле
Низкое осмотическое давление
Высокое онкотическое давление
Способность к поглощению УФ-лучей
Растворимость белков
Белки – гидрофильные соединения, растворимы в воде и водно-солевых растворах
Из-за больших размеров белки образуют коллоидные растворы
Растворимость белка минимальна в ИЭТ
Гидрофильность белкам придают
Полярные гидрофильные радикалы аминокислот ориентируют вокруг себя диполи воды
Полярные связи: – СО – NH –
– С = О
Высаливание
Это обратимое осаждение белков солями щелочных и щелочноземельных металлов (сульфат натрия и аммония)
Соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд
Чем меньше гидратная оболочка, тем меньше требуется солей
Глобулины выпадают в осадок при неполном насыщении раствора солями, а альбумины, окруженные большой водной оболочкой, - при полном насыщении
Денатурация белка
Это лишение белка его природных нативных свойств, сопровождающееся разрушением 4°, 3°, 2° структур, которое возникает при разрушении дисульфидных связей и связей слабого типа
1° структура при этом сохраняется, т.к. она сформирована прочными ковалентными связями
Факторы, вызывающие денатурацию белка
Физические – температура, УФО, рентгеновское и радиоактивное облучение, ультразвук, механическое воздействие
Химические – концентрированные кислоты и щелочи, соли тяжелых металлов, органические растворители (этиловый спирт, ацетон)
Ренатурация белка
Чаще всего денатурация – процесс необратимый
Денатурированный белок в нативных условиях может медленно ренатурировать, что связано со специфическими белками, которые помогают правильной сборке трехмерной белковой конформации
Такие белки называются «белки теплового шока» или «белки стресса» или шапероны.
М.М. от 10 до 90 кД
Функции:
Защита расплавленных глобул от агрегации
Перенос новосинтезированных белков в различные локусы клетки
Правильная сборка молекулы после синтеза полипептидной цепи
Факторы устойчивости белка
Гидратная оболочка
Белок, заряженный «–», притягивает «+» заряженный полюс Н2О и наоборот, образуя водную оболочку.
Гидратная оболочка не дает белкам соединиться и выпасть в осадок
Величина гидратной оболочки зависит от структуры белка:
Альбумины легко связываются с молекулами воды и имеют относительно большую водную оболочку
Глобулины, фибриноген присоединяют воду хуже и гидратная оболочка у них меньше.
Заряд белковой молекулы
Поверхность белков заряжена, т.к. в белке есть свободные заряженные СОО– и NH3 группы
ИЭТ большинства белков организма человека находится в слабокислой среде
В водных растворах аминокислоты существуют в форме биполярных ионов (амфотерных электролитов):
Свойство амфотерности лежит в основе буферных свойств белков и их участии в регуляции рН крови (7,36 ± 0,04)
Наличие заряда белковой молекулы определяется соотношением кислых и основных групп в структуре
В кислой среде подавляется диссоциация кислотных групп и белок становится катионом
В щелочной среде белок отдает протон и заряжается отрицательно
Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией Н+ (рН)
Изоэлектрическая точка (ИЭТ)
Это значение рН раствора, при котором заряд белка равен нулю (белок электронейтрален), так как все молекулы АМК представляют собой биполярный ион.
ИЭТ кислых белков находится в кислой среде, щелочных белков – в щелочной среде
Для большинства природных белков ИЭТ находится в слабокислой среде (рН 4,8 - 5,4), что свидетельствует о преобладании в их составе дикарбоновых аминокислот
Свойства белков в изоэлектрической точке
Не растворяются в воде
Высокая степень коагуляции и седиментации
Не набухают
Нет подвижности в электрическом поле
Высокая степень желатинирования
