
Биоэнергетика_Ч1
.docxБиоэнергетика
Повышенный интерес к технологической биоэнергетике – науке о путях и механизмах трансформации энергии в биологических системах, обусловлен рядом причин. Энерговооруженность является фактором, определяющим уровень развития общества. В последнее время для сравнения эффективности тех или иных процессов и технологий все чаще прибегают к энергетическому анализу, который намного раньше используется в экологии. Основной задачей энергетического анализа является планирование таких методов производства, которые обеспечивают наиболее эффективное потребление ископаемых и возобновляемых энергоресурсов, а также охрану окружающей среды.
За историю развития человеческого общества потребление энергии в расчете на одного человека возросло более чем в 100 раз. Через каждые 10–15 лет мировой уровень потребления энергии практически удваивается. В то же время запасы традиционных источников энергии – нефти, угля, газа истощаются. Кроме того, сжигание ископаемых видов топлив приводит к нарастающему загрязнению окружающей среды. Поэтому становится очень важным получать энергию в экологически чистых технологиях. Неиссякаемым источником энергии на Земле является Солнце. Каждый год на поверхность Земли с солнечной энергией поступает 3·2024 Дж энергии. В то же время разведанные запасы нефти, угля, природного газа и урана по оценкам эквиваленты 2,5·1022 Дж, то есть менее чем за одну неделю Земля получает от Солнца такое же количество энергии, какое содержится во всех запасах. Ежегодно в процессах фотосинтеза образуется свыше 170 млрд. т сухого вещества, а количество энергии, связанной в нем, более чем в 20 раз превышает сегодняшнее годовое энергопотребление. Однако возникает вопрос, способна ли энергетика, основанная на использовании солнечного излучения, обеспечить все возрастающие энергетические потребности общества. В глобальном масштабе солнечная энергетика способна обеспечить современный и будущий уровень энергозатрат человечества. Так, величина солнечной энергии, падающей на неосвоенные территории, например пустыни (около 2·107 км2), составляет около 5·1018 кВт·ч.

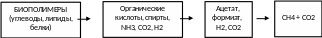
Рис. 29. Взаимосвязи между биомассой и биотехнологией (по Д. Холлу и др., 1988).
При освоении этой энергии хотя бы с 5 % к.п.д. уровень мирового производства энергии можно увеличить более чем в 200 раз. Таким образом, при возможном народонаселении в 10 млрд. человек получение энергии только с поверхности зоны пустынь будет в 10–12 раз превышать энергетические потребности человечества. При этом предвидится рост энергопотребления в расчете на душу населения в 5 раз по сравнению с настоящим уровнем.
Принципиально возможно также освоение солнечной энергии, падающей на поверхности морей и океанов. При этом в первичном процессе преобразование солнечной энергии происходит за счет синтеза биомассы фитопланктона; вторичный процесс представляет собой конверсию биомассы в метан и метанол. Плантации микроводорослей по оценкам специалистов представляют собой наиболее продуктивные системы: 50–100 т/га в год. Растительный покров Земли составляет свыше 1800 млрд. т сухого вещества, образованного в процессах фотосинтеза лесными, травяными и сельскохозяйственными экосистемами. Существенная часть энергетического потенциала биомассы потребляется человеком. Для сухого вещества простейшим способом превращения биомассы в энергию является сгорание, в процессе которого выделяется тепло, преобразуемое далее в механическую или электрическую энергию. Сырая биомасса также может быть преобразована в энергию в процессах биометаногенеза и получения спирта.
Как видно из рис. 29, получение топлива по схеме «биомасса - биотехнология» основывается на сочетании фотосинтеза, животноводства, кормопроизводства и ферментации с использованием тех или иных биологических агентов.
Научные и аналитические исследования последнего десятилетия приводят к выводу, что наиболее эффективными и обнадеживающими для крупномасштабного преобразования солнечной энергии являются методы, основанные на использовании биосистем. Среди этих методов – достаточно хорошо освоенные биологические технологии превращения биомассы в энергоносители в процессах биометаногенеза и производства спирта, а также принципиально новые разработки, ориентированные на модификацию и повышение эффективности самого процесса фотосинтеза, создание биотопливных элементов, получение фотоводорода, биоэлектрокатализ.
Биометаногенез или метановое «брожение» - давно известный процесс превращения биомассы в энергию. Открыт данный процесс в 1776 г. Вольтой, который установил наличие метана в болотном газе. Биогаз, получаемый из органического сырья в ходе биометаногенеза в результате разложения сложных органических субстратов различной природы при участии смешанной из разных видов микробной ассоциации, представляет собой смесь из 65-75 % метана и 20–35 % углекислоты, а также незначительных количеств сероводорода, азота, водорода. Теплотворная способность биогаза зависит от соотношения метана и углекислоты и составляет 5–7 ккал/м3; 1 м3 биогаза эквивалентен 4 квт/ч электроэнергии, 0.6 л керосина, 1.5 кг угля и 3.5 кг дров. Неочищенный биогаз используют в быту для обогрева жилищ и приготовления пищи, а также применяют в качестве топлива в стационарных установках, вырабатывающих электроэнергию. Компремированный газ можно транспортировать и использовать (после предварительной очистки) в качестве горючего для двигателей внутреннего сгорания. Очищенный биогаз аналогичен природному газу. В процессах биометаногенеза решается не только проблема воспроизводства энергии, - эти процессы чрезвычайно важны в экологическом плане, так как позволяют решать проблему утилизации и переработки отходов различных производств и технологий, сельскохозяйственных и промышленных, а также бытовых, включая сточные воды и твердый мусор городских свалок.
В сложных процессах деструкции органических субстратов и образования метана участвует микробная ассоциация различных микроорганизмов. В ассоциации присутствуют микроорганизмы-деструкторы, вызывающие гидролиз сложной органической массы с образованием органических кислот (масляной, пропионовой, молочной), а также низших спиртов, аммиака, водорода; ацетогены, превращающие эти кислоты в уксусную кислоту, водород и окислы углерода и, наконец, собственно – метаногены – микроорганизмы, восстанавливающие водородом кислоты, спирты и окислы углерода в метан:
С биохимической точки зрения метановое «брожение» - это процесс анаэробного дыхания, в ходе которого электроны с органического вещества переносятся на углекислоту; последняя затем восстанавливается до метана (при истинном брожении конечным акцептором электронов служит молекула органического вещества, являющегося конечным продуктом брожения). Донором электронов для метано генов является водород, а также уксусная кислота. Деструкцию органической массы и образование кислот вызывает ассоциация облигатных и факультативных анаэробных организмов, среди которых гидролитики, кислотогены, ацетогены и др.; это представители родов: Enterobacteriaceae, Lactobacilaceae, Sterptococcaceae, Clostridium. Butyrivibrio. Активную роль в деструкции органической массы играют целлюлозоразрушающие микроорганизмы, так как растительные биомассы, вовлекаемые в процессы биометаногенеза, характеризуются высоким содержанием целлюлозы (лигнинцеллюлозы). В превращении органических кислот в уксусную существенную роль играют ацетогены – специализированная группа анаэробных бактерий. «Венцом» метанового сообщества являются собственно метаногенные или метанообразующие бактерии (архебактерии), катализирующие восстановительные реакции, приводящие к синтезу метана. Субстратами для реализации этих реакций являются водород и углекислота, а также окись углерода и вода, муравьиная кислота, метанол и др.:
4 Н2 + СO2 → СН4 + 2 Н2O,
4 СО + 2 Н2O → СН4 + 3 СO2,
4 НСООН → СН4 + 3 СO2 + 2 Н2O),
4 СН3ОН → 3 СН4 + СO2 + 2 Н2O.
Несмотря на то, что метанообразующие бактерии выделены и описаны совсем недавно, в середине 80-х гг., их возникновение относят к Архею и возраст оценивают в 3.0–3.5 млрд. лет. Эти микроорганизмы достаточно широко распространены в природе в анаэробных зонах, и вместе с другими микроорганизмами активно участвуют в деструкции органических веществ с образованием биогаза, в морских осадках, болотах, речных и озерных илах. Архебактерии отличаются от прокариотических микроорганизмов отсутствием муреина в клеточной стенке; специфическим, не содержащим жирных кислот, составом липидов; наличием специфических компонентов метаболизма в виде кофермента М (2-меркаптоэтансульфоновая кислота) и фактора F420 (особый флавин); специфической нуклеотидной последовательностью 16S рРНК.
Внутри данной группы отдельные представители метанообразующих бактерий могут существенно отличаться друг от друга по ряду показателей, включая содержание ГЦ в ДНК, на этом основании их подразделяют на три порядка, которые включают несколько семейств и родов. К настоящему времени выделены в чистой культуре и описаны около 30 метанообразующих бактерий; список этот непрерывно пополняется. Наиболее изученными являются следующие: Methanobacterium thermoautotrophicum, Methanosarcina barkerii, Methanobrevibacter ruminantium. Все метаногены – строгие анаэробы; среди них встречаются как мезофильные, так и термофильные формы; гетеротрофы и автотрофы. Особенностью метанообразующих бактерий является также способность активно развиваться в тесном симбиозе с другими группами микроорганизмов, обеспечивающими метаногенов условиями и субстратами для образования метана.
В процессах метаногенеза можно переработать самое разнообразное сырье – различную растительную биомассу, включая отходы древесины, несъедобные части сельскохозяйственных растений, отходы перерабатывающей промышленности, специально выращенные культуры (водяной гиацинт, гигантские бурые водоросли), жидкие отходы сельскохозяйственных ферм, промышленные и бытовые стоки, ил очистных сооружений, а также мусор городских свалок. Важно, что сырье с высоким содержанием целлюлозы, трудно поддающееся методам переработки, также эффективно сбраживается и трансформируется в биогаз.
Установки для биометаногенеза с учетом их объемов и производительности можно подразделить на несколько категорий: реакторы для небольших ферм сельской местности (1–20 м3); реакторы для ферм развитых стран (50–500 м3); реакторы для переработки промышленных стоков (спиртовой, сахарной промышленности) (500–10 000 м3) и реакторы для переработки твердого мусора городских свалок (1 – 20·106 м3). Метанотенки, изготовленные из металла или железобетона, могут иметь разнообразную форму, включая кубическую и цилиндрическую. Конструкции и детали этих установок несколько варьируют, главным образом, это связано с типом перерабатываемого сырья. Существует огромное разнообразие установок для реализации процесса метаногенеза, конструкционные детали и компоновка которых определяется приоритетностью задачи, решаемой в конкретном процессе: либо это утилизация отходов и очистка стоков, либо получение биогаза требуемого качества. Так, среди действующих в развитых странах установок есть как средние, так и большие по объемам аппараты (дайджестеры), снабженные устройствами для очистки и компремирования биогаза, электрогенераторами и очистителями воды. Такие установки могут входить в состав комплексов с промышленными предприятиями (сахароперерабатывающими, спиртовыми, молокозаводами), канализационными станциями или крупными специализированными фермами. Когда главной целью процесса является утилизация отходов, в составе установок должен присутствовать блок для фракционирования и отделения крупных твердых частиц.
Метанотенки могут работать в режиме полного перемешивания, полного вытеснения, как анаэробные биофильтры или реакторы с псевдоожиженным слоем, а также в режиме контактных процессов. Простейшей конструкцией метанотенка является обычная бродильная яма в грунте с фиксированным объемом газа. Метанотенк представляет собой герметичную емкость, частично погруженную в землю для теплоизоляции и снабженную устройствами для дозированной подачи и подогрева сырья, а также газгольдером - емкостью переменного объема для сбора газа. Очень важным в конструкции метанотенков является обеспечение требуемого уровня перемешивания весьма гетерогенного содержимого аппарата. Вместе с тем известно, что максимальное выделение метана наблюдается в системах со слабым перемешиванием. Поэтому в отличие от аэробных процессов, требующих интенсивной аэрации и перемешивания, перемешивание при метаногенезе, главным образом, должно обеспечивать гомогенизацию бродящей массы, препятствовать оседанию твердых частиц и образованию твердой плавающей корки.
В зависимости от типа исходного материала, сбраживаемого в метанотенке, интенсивность процесса, включая скорость подачи и полноту переработки, а также состав образуемого биогаза существенно варьируют. При переработке жидких отходов животноводческих ферм соотношение между твердыми компонентами и водой в загружаемой массе должно составлять примерно как 1:1, что соответствует концентрации твердых веществ от 8 до 11 % по весу. Смесь материала обычно засевают ацето генными и метанообразующими микроорганизмами из отстоя сброженной массы от предыдущего цикла или другого метанотенка. Температура и, следовательно, скорость протекания процесса зависят от вида используемого метанового сообщества. Для термофильных организмов процесс реализуется при 50–60 °С, для мезофильных – при 30–40 °С и около 20 °С – для психрофильных организмов. При повышенных температурах скорость процесса в 2-3 раза выше по сравнению с мезофильными условиями.
В ходе сбраживания органической массы на первой, так называемой «кислотной», фазе в результате образования органических кислот pH среды снижается. При резком сдвиге pH среды в кислую сторону возможно ингибирование метаногенов. Поэтому процесс ведут при pH 7.0–8.5. Против закисления используют известь. Снижение pH среды является своеобразным сигналом, свидетельствующим о том, что процесс деструкции органики с образованием кислот закончен, то есть в аппарат можно подавать новую партию сырья для переработки. Оптимальное соотношение C:N в перерабатываемой органической массе находится в диапазоне 11–16:1. При изменении соотношения C:N в исходном материале в сторону увеличения содержания азота приводит к выделению аммиака в среду и защелачиванию. Поэтому жидкие навозные отходы, богатые азотсодержащими компонентами, разбавляют резаной соломой или различными жомами.
Процессы, протекающие при метановом брожении, эндотермичны и требуют подвода энергии в виде тепла извне. Для подогрева загружаемого сырья и стабилизации температуры процесса на требуемом уровне обычно сжигают часть образуемого биогаза. В зависимости от температуры процесса количество биогаза, идущего на обогрев процесса, может достигать 30 % от объема получаемого.
Скорость поступления сырья на переработку или время удержания сырья в аппарате являются важными и контролируемыми параметрами. Чем интенсивнее процесс брожения, тем выше скорость загрузки и меньше время удержания. Однако важным условием стабильности процесса биометаногенеза, как и любой проточной культивационной системы, является сбалансированность потоков субстрата со скоростью размножения продуцента. Скорость подачи субстрата в метанотенк должна быть равной скорости роста бактерий метанового сообщества, при этом концентрация субстрата (по органическому веществу) должна быть стабилизирована на уровне не ниже 2 %. При уменьшении концентрации субстрата плотность бактериального сообщества снижается, и процесс метаногенеза замедляется. Наибольший выход продукции обеспечивается более высокой скоростью подачи субстрата, что в свою очередь требует стабилизации в аппарате достаточно высокой концентрации микроорганизмов. При этом возможны осложнения процесса, которые зависят от характера перерабатываемой органики. Если в перерабатываемом материале содержится много труднорастворимых веществ, в реакторе возможно накопление неразрушенных твердых веществ (до 80 % осадка). При больших количествах растворимой и легкодоступной органики образуется большое количество микробной биомассы в виде активного ила (до 90 % осадка), который трудно удержать в реакторе. Для снятия этих вопросов существует несколько решений. Возможно применение химического или ферментативного гидролиза исходного сырья, помимо его механического измельчения; организация в метанотенке оптимального перемешивания подаваемого сырья с активным илом; перемешивание осадка и т.д.
Нормы загрузки сырья в существующих процессах метаногенеза колеблются в пределах 7–20 % объема субстрата от объема биореактора в сутки. Цикличность процесса – 5–14 суток. Обычно время сбраживания животноводческих отходов составляет около 2-х недель. Растительные отходы перерабатываются дольше (20 суток и более). Наиболее трудны для переработки твердые отходы, поэтому их переработка более длительна.
В результате модификации и усовершенствования процесса можно существенно изменить скорость протока сырья через метанотенк. процесса может быть сокращена до 5–15 часов при увеличении скорости загрузки до 150–400 % от общего суточного объема. Интенсифицировать процесс можно в результате использования термофильного сообщества и повышения температуры процесса, но это требует соответствующих дополнительных энергозатрат. Повысить эффективность метанового сообщества в метанотенке можно при использовании так называемых анаэробных биофильтров, или метанотенков второго поколения. В анаэробном биофильтре микроорганизмы находятся в иммобилизованном состоянии. В качестве носителя можно использовать галечник, керамзит, стекловолокно и др. В таких конструкциях становится возможным сбраживание материала при существенно меньшей величине текущей концентрации субстрата (0.5 % сухих веществ) с большими скоростями. Это позволяет повысить интенсивность деструкции отходов при уменьшении объемов реакторов.
Эффективно также пространственное разделение процесса в соответствии с характерной для него, с точки зрения химизма процесса, двухфазностью. Процесс реализуется в двух, соединенных последовательно реакторах. В первом аппарате происходит процесс анаэробного разложения органики с образованием кислот, окислов углерода и водорода (кислотная стадия). Параметры процесса брожения в аппарате задаются на уровне, обеспечивающем требуемый выход кислот и pH культуры не выше 6.5. Полученная бражка поступает во второй аппарат, в котором происходит процесс образования метана. В такой системе можно независимо варьировать условия ферментации (скорость протока, pH, температуру) в каждом аппарате с учетом создания оптимальных условий для развития микроорганизмов деструкторов в первом и метаногенов – во втором. В целом, применение такой биосистемы позволяет интенсифицировать процесс в 2–3 раза.
Интенсифицировать процесс оказалось возможным также в результате применения более активных метаногенных микроорганизмов. Например, исследователями японской фирмы «Мацусита электрик индастриал К°» получена массовая культура обнаруженной ими бактерии Methanobacterium kadomensis St.23, которая завершает процесс сбраживания и метаногенеза не за 15–20, а за 8 суток.
Теоретически метанообразующие бактерии в процессах синтеза метана до 90–95 % используемого углерода превращают в метан и только около 5–10 % - включают в образование биомассы. Благодаря такой высокой степени конверсии углерода в метан у метаногенов, до 80–90 % исходной органической массы, перерабатываемой в процессах сбраживания и метаногенеза, превращается в биогаз. Энергетика процесса существенным образом зависит от типа сбраживаемой органики. Если субстратом является легко утилизируемая глюкоза, теоретический выход по энергии составляет свыше 90 %, а весовой выход газа – только 27 %. Практические энергетические выходы в зависимости от типа и сложности органического сырья составляют от 20 до 50 %, соответственно, выход газа – от 80 до 50 %. Состав газа существенно меняется в зависимости от состава и природы исходного сырья, скорости и условий протекания процесса в биореакторе. Теоретически соотношение углекислоты и метана в биогазе должно быть примерно равным. Однако далеко не вся выделяемая в процессах брожения углекислота содержится в газовой фазе, часть растворяется в жидкой фазе с образованием бикарбонатов. Концентрация бикарбоната, в свою очередь, как и объема образуемой углекислоты в целом, сильно зависит от содержания более или менее окисленных веществ в перерабатываемом сырье: более окисленные субстраты обеспечивают большее образование кислых продуктов и, следовательно, больший выход СO2 в биогазе; более– Н2 и, следовательно, больший выход СН4. Реально достигаемые в производственных процессах соотношения СO2 и СН4 в биогазе существенно варьируют. Это определяет калорийность получаемого биогаза, которая также варьирует от 5 до 7 ккал/м3. В зависимости от типа сырья и интенсивности процесса биометаногенеза выход биогаза колеблется от 300 до 600 м3·т органической массы при выходе метана от 170 до 400 м3/т. Глубина переработки субстрата при этом может составлять от 20 до 70 %.
Образующийся в процессах метаногенеза жидкий или твердый шлам вывозится на поля и используется в качестве удобрений. Данное применение обусловлено условиями метаногенерации, при которой патогенные энтеробактерии, энтеровирусы, а также паразитарные популяции (Ascaris lumbricoides, Ancylostoma) практически полностью погибают. Твердый остаток процесса (или активный ил) может быть использован также в качестве исходного сырья для получения ряда биологически активных соединений в процессах химического гидролиза или микробиологического синтеза.
Получение спирта
Получение этилового спирта на основе дрожжей известно с древних времен. И хотя производство спирта намного моложе, чем неперегнанных спиртных напитков, но и его корни теряются в веках. В последние годы все большие масштабы приобретает химический синтез этанола из этилена, который конвертируется в спирт при высокой температуре в присутствии катализатора и воды. Однако микробиологический синтез не теряет актуальности.
Перспективы использования низших спиртов (метанола, этанола), а также ацетона и других растворителей в качестве горючего для двигателей внутреннего сгорания вызвали в последние годы большой интерес к возможности их крупномасштабного получения в микробиологических процессах с использованием различного растительного сырья. Этиловый спирт является прекрасным экологическим чистым горючим для двигателей внутреннего сгорания. Замена дефицитного бензина иными видами топлива является актуальной проблемой современности. Особенно остро вопрос стоит в странах Америки и Западной Европы. Использование чистого этанола или в смеси с бензином (газохол) существенно снижает загрязнение окружающей среды выхлопными газами, так как при сгорании этанола образуются только углекислота и вода. Поэтому в странах с большими запасами природного растительного материала и соответствующими почвенно-климатическими условиями, обеспечивающими большие ежегодные урожаи, становится целесообразным ориентировать производство моторных топлив на процессы микробиологического брожения.
В качестве горючего спирт стали применять в США и Германии в 30 – 40 гг. Интерес к спиртам в качестве топлива резко возрос в 70-е годы. Например, в Бразилии этанол используют в качестве топлива в двигателях внутреннего сгорания уже несколько десятилетий. В 1982 г. началось интенсивное строительство спиртовых заводов по технологии шведской фирмы «Альфа Ляваль» производительностью до 150 тыс. л 95 % спирта в сутки на основе сахаросодержащего сырья. В России действуют установки по производству гидролизного спирта технологии Вниигидролиз (Ленинград). В Японии к концу 90-х гг. экспорт нефти сокращен с 72 до 49 % за счет получения спирта на основе иммобилизованных микробных клеток.
Сырьем для процессов спиртового брожения могут быть разнообразные биомассы, включая крахмалсодержащие (зерно, картофель), сахаросодержащие материалы (меласса, отходы деревоперерабатывающей промышленности), а также биомасса специально выращенных пресноводных и морских растений и водорослей. Процесс складывается из нескольких стадий, включающих подготовку сырья, процесс брожения, отгонку и очистку спирта, денатурацию, переработку кубовых остатков.
Этиловый спирт обьино получают из гексоз в процессах брожения, вызываемых бактериями (Zymomonas mobilis, Z. anaerobica, Sarcina ventriculi), клостридиями (Clostridium thermocellum) и дрожжами (Saccharomyces cerevisiae):
C6H12O6 → 2 CH3CH2OH + 2 CO2.
Главная задача, которую приходится решать при получении спиртов технического назначения, это замена дорогостоящих крахмалсодержащих субстратов дешевым сырьем непищевого назначения.
Образование этанола дрожжами – это анаэробный процесс, однако для размножения дрожжей в незначительных количествах нужен и кислород. Процессы, происходящие при конверсии сахаросодержащего субстрата в спирт, включают также процессы метаболизма и роста клеток-продуцента, поэтому в целом биологический процесс получения спиртов зависит от ряда параметров (концентрации субстрата, кислорода, а также конечного продукта). При накоплении спирта в культуре до определенных концентраций начинается процесс ингибирования клеток. Поэтому большое значение приобретает получение особых штаммов, резистентных к спирту.
Промышленный процесс брожения может осуществляться по разным схемам: непрерывно, периодически и периодически с возвратом биомассы. При периодическом процессе субстрат сбраживается после внесения свежевыращенного инокулята, который обычно получают в аэробных условиях. После завершения сбраживания субстрата клетки продуцента отделяют, и для нового цикла получают свежую порцию посевного материала. Это достаточно дорогостоящий процесс, так как в аэробном процессе размножения дрожжей расходуется много субстрата. Экономический выход в процессе составляет около 48 % от субстрата по массе (часть субстрата тратится на процессы роста и метаболизма клеток, а также образование других продуктов - уксусной кислоты, глицерола, высших спиртов). Если в качестве продуцента в процессах брожения используют дрожжи, продуктивность составляет 1–2 г этанола/г клеток ч. На лабораторном уровне при использовании в качестве продуцента бактериальной культуры Zymomonas mobilis эта величина выше практически в 2 раза. В промышленных процессах продуктивность аппаратов сильно зависит от физиологических особенностей продуцента, плотности биомассы, типа аппарата и режима ферментации; варьирует очень широко, от 1 до 10 г/л ч. Длительность цикла составляет около 36 ч, конечная концентрация спирта – 5 % (вес/объем).
