Дросселирование. Эффект Джоуля-Томсона
Эффект падения давления потока рабочего тела в процессе преодоления им (потоком) местного сопротивления называется дросселированием.
Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т.д.
Рассмотрим процесс дросселирования, протекающий без внешней работы ( W1,2* = 0), в котором отсутствует теплообмен рабочего тела с внешней средой ( Q1,2* = 0).
Падение давления за местным сопротивлением обусловлено диссипацией (потерей) энергии потока, расходуемой на преодоление этого сопротивления, то есть на работу необратимых потерь ( W1,2** ).
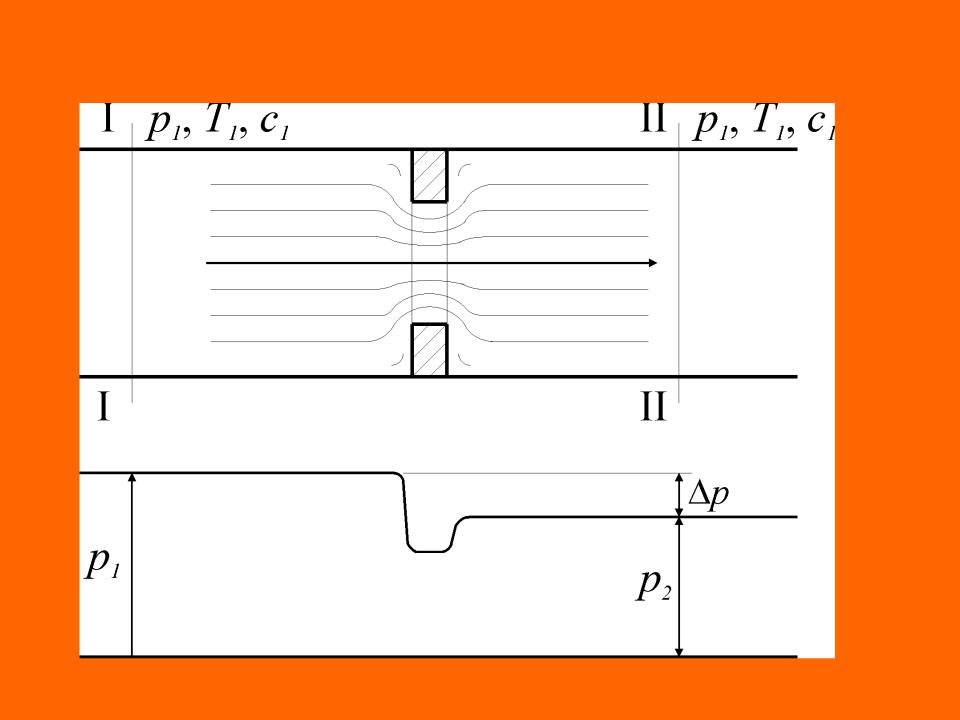

С учетом перечисленных условий рассматриваемого процесса дросселирования, уравнение первого начала термодинамики для потока по балансу рабочего тела
dQ* + dQ** = dH + dW * + dW **
примет вид
H2 - H1 = 0 или H = idem
Это значит, что рассматриваемый процесс дросселирования
является процессом изоэнтальпийным: энтальпия рабочего
.
тела до дросселя численно равна энтальпии рабочего тела после дросселя. При течении внутри дросселя энтальпия газа или пара меняется.
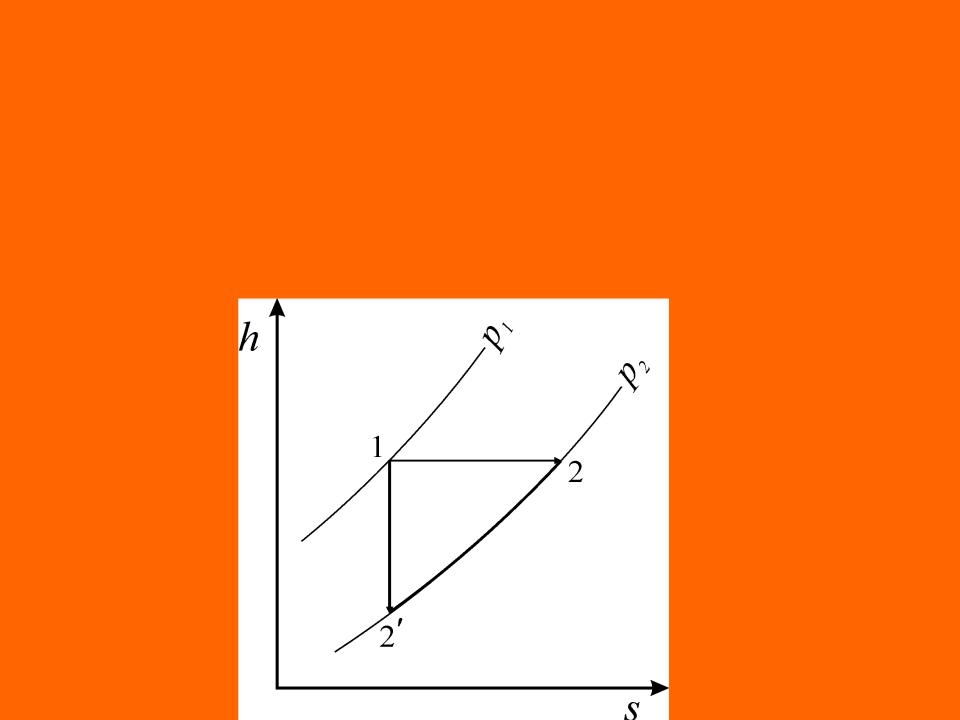
Если рассматривать в качестве местного сопротивления
сужение канала, в суженном сечении поток ускоряется, кинетическая энергия увеличивается и энтальпия рабочего тела уменьшается (процесс 1 - 2'). После дросселя сечение потока вновь возрастает, поток тормозится, кинетическая энергия уменьшается, а энтальпия увеличивается до прежнего значения (процесс 2' - 2).

Процесс дросселирования является процессом необратимым; он всегда сопровождается ростом энтропии рабочего тела.
Явление изменения температуры газа или жидкости при адиабатном дросселировании называется эффектом Джоуля –
Томсона.
Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта
определяется из соотношения
|
æ |
¶T |
ö |
D = ç |
÷ |
||
h |
ç |
|
÷ |
|
è |
¶p øh |
|
где Dh – коэффициент дросселирования или коэффициент
Джоуля – Томсона, .
Интегральный дроссель-эффект определяется по соотношению
2
T2 -T1 = ò Dh × dp
1

Коэффициент Джоуля – Томсона определяется из следующего уравнения, выведенного из математических выражений первого начала термодинамики и второго начала
термостатики |
æ |
¶v ö |
|
|
|
|
|
|
|||
|
T ç |
|
÷ |
- v |
|
|
|
||||
Dh = |
è |
¶T ø p |
|
. |
|
|
c p |
|
|||
|
|
|
|
||
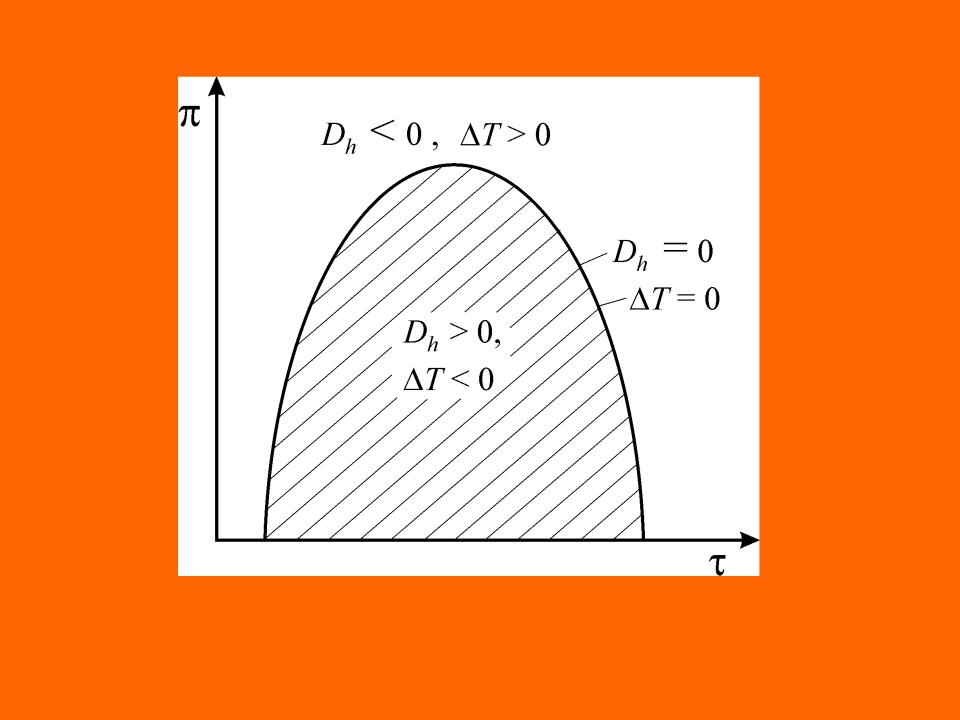
Знак дифференциального дроссель–эффекта (коэффициента Джоуля – Томсона) определяется из анализа уравнения. В зависимости от характера изменения температуры T, имеют место три вида дроссель–эффекта (процесс дросселирования всегда происходит с падением давления dp<0):
1.Дроссель–эффект положительный (Dh > 0), в этом случае процесс дросселирования сопровождается снижением температуры рабочего тела (dT<0);

2.Дроссель–эффект отрицательный (Dh < 0), в этом случае процесс дросселирования сопровождается повышением температуры рабочего тела (dT>0);
3.Дроссель–эффект равен нулю (Dh = 0), если в процессе дросселирования температура рабочего тела не изменяется. Нулевой дроссель-эффект наблюдается при дросселировании идеального газа.
Как показывает опыт, для одного и того же вещества в зависимости от значений параметров состояния коэффициент Джоуля – Томсона Dh может иметь положительные, отрицательные значения, а также быть равным нулю.
Состояние газа или жидкости, которому соответствует условие Dh = 0, называется точкой инверсий. Геометрическое место точек инверсии на диаграмме состояния данного вещества называется кривой инверсии.

Кривая инверсии описывается уравнением
. |
æ |
¶v ö |
= |
|
v |
|
|
ç |
|
÷ |
|
|
|
|
|
T |
||||
|
è |
¶T øp |
|
|||
Для каждого вещества в диаграмме р - v имеется своя кривая инверсии. Закон соответственных состояний позволяет построить обобщенные кривые инверсии для групп термодинамически подобных веществ. Для природных газов инверсионная диаграмма приведена на графике в виде π = f(τ)