
Лабораторный практикум
.pdf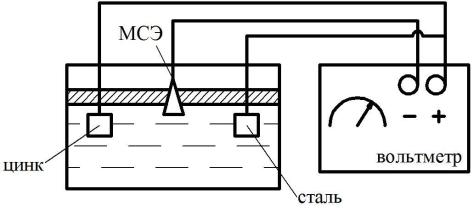
1 – измерительный модуль (медная пластина), 2 – внешний корпус, 3 – влагоудерживающая засыпка (насыщенный раствор медного купороса); 4 – измерительный
кабель, 5 – термоусаживаемая муфта, 6 – вспомогательный электрод, 7 – измерительный провод вспомогательного электрода
чивается через ионообменную мембрану, смачивает ее и создает через раствор сульфата меди гальванический контакт между медным стержнем и грунтом. Возникающая постоянная разница потенциала на границе «медь – насыщенный раствор сульфата меди» сравнивается с разницей потенциала на границе «защищаемый объект — окружающий грунт» с помощью приборов
(рисунок 3.2).
Практическая часть
1.Очистите стальной и цинковый электроды от грязи и продуктов коррозии.
2.Соберите лабораторную установку как показано на рисунке 3.3.
Установите электроды, а также МСЭ в емкость с водой. Для измерения потенциалов металлов необходимо составить гальваническую пару, в которой одним электродом будет один из металлов, вторым – МСЭ.
Рисунок 3.3 – Схема лабораторной установки
21
1 – емкость с водой, 2 - милливольметр
3. Для измерения потенциала каждой пары подключите клемму МСЭ к отрицательной клемме милливольтметра, а металлического электрода – к
положительной клемме. Измерьте электродные потенциалы пластинок и запишите полученные данные в таблицу 3.1.
Таблица 3.1 – Форма записи результатов проведения испытания
Материал |
Значение потенциала, В |
|
|
|
|
|
|
4. Сделать вывод о том, какой металл является более электрически отрицательным, а также какой их двух металлов начнет разрушаться при соединении их в гальваническую пару.
22
Лабораторная работа №4
Пассивность стали
Цель работы: ознакомиться с явлением пассивируемости стали;
экспериментальным путем исследовать пассивируемость стали в
окислителях.
Оборудование и материалы: 4 образца пластинок из углеродистой стали, растворы азотной кислоты HNO3 с различной концентрацией (20, 30, 40, 50 и 60%), медно-сульфатный электрод сравнения, милливольтметр.
Теоретическая часть
Пассивность – состояние относительно высокой коррозионной стойкости металла, вызванное торможением анодного процесса электрохимической коррозии.
Повышенная коррозионная стойкость металлов может быть обусловлена различными причинами, в частности термодинамической устойчивостью, т.е.
инертностью металла, отсутствием в электролите деполяризатора и т.д.
Однако под пассивностью принято подразумевать только состояние повышенной коррозионной устойчивости, связанное с торможением анодного процесса коррозии, наблюдаемого при определенных условиях.
Наступление пассивного состояния металлов характеризуется следующими явлениями:
1)резкое уменьшение скорости коррозии металла в пассивном состоянии;
2)значительное смещение потенциала металла в положительную сторону (у железа может происходить смещение потенциала до +1 В).
23
Пассивное состояние металлов вызывают обычно окислительные процессы, протекающие вследствие наличия в растворе окислителей –
пассиваторов (например, O2, HNO3, K2Cr2O7 и др.) или вследствие анодной поляризации металла – пассивирующих факторов и образующие на поверхности металлов адсорбционный слой кислорода или защитную окисную пленку. Пассивность металлов зависит как от внутренних факторов,
связанных со свойствами металлов (состав и структура, состояние поверхности и др.), так и от внешних условий, при которых металл взаимодействует с электролитом (температура, движение раствора,
наложение постоянного тока и т.д.).
О большей или меньшей склонности металла к пассивированию можно судить по пассивирующей концентрации окислителя или пассивирующей анодной плотности тока. Пассивное состояние металла может в большей или меньшей степени сохраниться и после изменения внешних пассивирующих условий. Нарушают пассивное состояние или затрудняют его наступление восстановители, катодная поляризация, некоторые («активные») ионы
(например, Cl-, SO42- и др.), повышение температуры, механическое нарушение пассивной поверхности и т.д.
Явление пассивности металлов имеет большое практическое значение,
так как коррозионная стойкость многих технических металлов и сплавов определяется их пассивируемостью в определенных условиях. В частности,
правильный выбор стали трубопровода, склонной к пассивированию в данных условиях пролегания трассы, позволит в значительной мере сократить потери металла от коррозии и скорость самой коррозии, тем самым повысить эксплуатационную надежность и долговечность трубопровода.
Практическая часть
24
1.Зачистите наждачной бумагой и обезжирьте органическим растворителем образцы металлических пластинок.
2.Один из стальных образцов поочередно погружайте в стаканы с растворами HNO3, начиная с концентрации 20% и кончая 60% с выдержкой при каждой концентрации по 10 секунд. При каждом погружении образца наблюдайте за скоростью растворения стали в растворе HNO3 и отметьте концентрацию кислоты, при которой наступает пассивность стали –
прекращается выделение пузырьков газа. Результаты наблюдений запишите в таблицу 4.1 (опыты 1-5).
Таблица 4.1 – Форма записи результатов проведения экспериментов
Номер |
Концентрация |
Наблюдения |
Потенциал |
|
опыта |
HNO3, % |
образцов U, В |
||
|
||||
|
|
|
|
|
1 |
20 |
|
|
|
|
|
|
|
|
2 |
30 |
|
|
|
|
|
|
|
|
3 |
40 |
|
|
|
|
|
|
|
|
4 |
50 |
|
|
|
|
|
|
|
|
5 |
60 |
|
|
|
|
|
|
|
|
6 |
50 |
|
|
|
|
|
|
|
|
7 |
40 |
|
|
|
|
|
|
|
|
8 |
30 |
|
|
|
|
|
|
|
|
9 |
20 |
|
|
|
|
|
|
|
|
10 |
20 |
|
|
|
|
|
|
|
3. Извлеките образец стали из 60%-ого раствора кислоты и поочередно погружайте на 10 секунд в растворы начиная с концентрации 50% и кончая
20%. Наблюдайте за поведением образца стали. Результаты наблюдений
(происходит растворение стали или нет) запишите в таблицу 4.1 (опыты 6-9).
4. Погрузите вторую стальную пластинку в 20%-ый раствор кислоты и приведите ее в контакт с находящейся там пассивированной первой
25
пластинкой. Извлеките вторую пластинку и наблюдайте за поведением первой пластинки (растворяется или нет). Результаты наблюдений запишите в таблицу 4.1 (опыт 10).
5. Поместите третью пластинку в 20%-ый непассивирующий раствор кислоты и измерьте ее потенциал относительно медно-сульфатного электрода сравнения. Аналогичным образом измерьте потенциал четвертой пластинки,
погруженной в раствор кислоты, имеющей пассивирующую концентрацию
(данная концентрация определяется на основании проделанных выше опытов).
6. Определите электродный потенциал активного и пассивного образцов стали относительно нормального водородного электрода сравнения по формуле:
н = м.с.э + изм, |
(4.1) |
где н – потенциал стали относительно нормального водородного электрода сравнения, В;
м.с.э – потенциал медно-сульфатного электрода сравнения относительно нормального водородного электрода сравнения, В;
изм – измеренный потенциал стали, В.
Результаты запишите в таблицу 4.1.
7. Сделайте вывод о концентрации раствора азотной кислоты, при которой наступает явление пассивности стали; о влиянии второго образца стали на пассивное состояние первого образца стали; о изменении потенциала стали в активном и пассивном состоянии.
26
Лабораторная работа №5
Коррозия сварных соединений
Цель работы: ознакомиться с теоретическими основами явления усиленной коррозии сварного шва металлоконструкций; экспериментальным путем исследовать коррозию сварного соединения.
Оборудование и материалы: 3 образца сваренных пластинок различных марок стали (окрашенные с одной стороны), медно-сульфатный электрод сравнения, милливольтметр, фильтровальная бумага, профилометр.
Теоретическая часть
Сварные соединения металлоконструкций часто подвержены явлению усиленной коррозии сварного шва или прилегающей к нему области основного металла. Это приводит к тому, что конструкция может преждевременно разрушиться в одном из коррозионных очагов сварного шва,
несмотря на хорошее или удовлетворительное состояние основного металла конструкции. Поэтому исследование коррозии сварных соединений имеет первостепенное значение для производственной практики, что является наиболее актуальной задачи для нефтегазового комплекса, где длина сварных соединений достигает сотен тысяч километров.
Сварное соединение, находящееся в контакте с электролитом (в
частности, для трубопроводов – почвенный электролит), представляет собой
многоэлектродную макро- и микрогальваническую гетерогенную систему.
Данное обстоятельство вызвано различными типами неоднородности,
присущими сварному соединению: структурно-химическая макро- и
микронеоднородность различных соединения (основной металл, зона
27
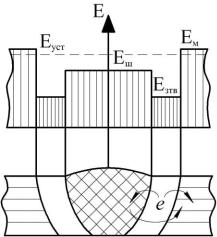
термического влияния, сварной шов); неоднородность напряженного состояния; геометрическая неоднородность и т.д. С точки зрения макросистем в сварном соединении можно выделить следующие
«электроды»: основной металл, шов, зона термического влияния и зона максимальной концентрации напряжений (рисунок 5.1).
Рисунок 5.1 – Схема электрохимической неоднородности сварного соединения
Eш – электродный потенциал шва, Езтв – электродный потенциал зоны термического влияния, Ем – электродный потенциал основного металла, Еуст – установившийся
потенциал заполяризованной системы «шов-зона термического влияния-основной металл»
В результате возможна ситуация, когда шов служит анодом по отношению к основному металлу (шов имеет более отрицательный потенциал, чем основной металл) и происходит увеличение скорости коррозии шва. Даже небольшая разность потенциалов между основным металлом и швом может неблагоприятно сказаться на коррозионной стойкости шва, так вследствие большой площади катода (основного металла)
по сравнению с площадью анода (шва) плотность анодного тока может быть значительной.
28
Соотношение коррозионной стойкости основного металла и шва можно определить, измерив электрохимические потенциалы различных зон сварного соединения. Этим методом можно быстро обнаружить наиболее коррозионно уязвимые участки сварного соединения. Например, если потенциал шва отрицательнее потенциала основного металла, при коррозии сварного соединения шов будет анодом, что приведет к его усиленной коррозии.
Измерением потенциалов можно пользоваться для выбора наиболее безопасного в коррозионном отношении метода сварки.
Примеры электродных потенциалов, характеризующих неоднородность зон сварного соединения представлены в таблице 5.1.
Таблица 5.1 – Электродные потенциалы различных зон сварных соединений в 3%-ом растворе NaCl
|
|
|
Электродный потенциал, мВ |
|||
|
|
|
|
|
|
|
Материал |
Способ сварки |
Основной |
|
Зона |
||
Сварной шов |
термического |
|||||
|
|
металл |
|
|||
|
|
|
|
влияния |
||
|
|
|
|
|
||
|
|
|
|
|
|
|
09Г2С |
Ручная, дуговая, |
-460 |
|
-540 |
-480 |
|
|
электрод типа |
|
|
|
|
|
17Г2С1 |
-500 |
|
-540 |
-550 |
||
Э55 |
|
|||||
|
|
|
|
|
||
|
|
|
|
|
|
|
12Х18Н10Т |
|
+137 |
|
+108 |
+75 |
|
|
|
|
|
|
|
|
10Х14АГ15 |
Аргонодуговая |
-170 |
|
-165 |
-250 |
|
|
|
|
|
|
||
Амг6 |
-492 |
|
-514 |
-567 |
||
|
|
|||||
|
|
|
|
|
|
|
ВТ1-1 |
|
-125 |
|
-180 |
-140 |
|
|
|
|
|
|
|
|
Практическая часть
1.Зачистите образцы пластинок наждачной бумагой и обезжирьте растворителем.
2.Уложите узкие полоски фильтровальной бумаги (2-3 мм) поперек образцов на сварной шов и зоны основного металла по обе стороны от
29
сварного шва. Смочите полоски фильтровальной бумаги 10%-ым раствором
H2SO4. После трехминутной выдержки измерьте потенциалы каждой зоны сварного шва с помощью медно-сульфатного электрода сравнения.
Результаты запишите в таблицу 5.2.
Примечание: для предотвращения изменения потенциалов разных участков вследствие поляризации при работе пары основной металл – шов необходимо следить,
чтобы кислота не достигла границы шва с основным металлом.
Таблица 5.2 – Форма записи результатов проведения испытания
|
|
|
|
|
Заключение о |
|
Номер |
Материал |
Номер измерения |
Потенциал участка по |
полярности металла |
||
образца |
отношению к МСЭ, В |
основного металла и |
||||
|
|
|
||||
|
|
|
|
|
металла шва |
|
|
|
|
|
|
||
|
|
Основной металл 1 |
|
|
||
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Металл шва |
1 |
|
|
|
|
|
|
|
|
||
|
|
Основной металл 1 |
|
|
||
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Металл шва |
1 |
|
|
|
|
|
|
|
|
||
|
|
Основной металл 1 |
|
|
||
3 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Металл шва |
1 |
|
|
|
|
|
|
|
|
|
|
3. Очистите образцы пластинок от остатков кислоты (промойте,
зачистите наждачной бумагой и обезжирьте).
4. Поместите образцы пластинок в агрессивную среду (3%-ый раствор
NaCl при температуре 20°С и плотности ρ=1,02 г/см3) и проводите испытания
втечении 7 суток.
5.По истечению 7 суток достаньте образцы пластинок, просушите и при необходимости очистите от продуктов коррозии с помощью металлической щетки.
30
