
Лабораторный практикум
.pdfПрактическая часть
1.Определите площадь образцов металлических пластинок.
2.Очистите образцы металлических пластинок от следов коррозии и загрязнений. Обезжирьте образцы металлических пластинок.
3.Взвесьте массы образцов металлических пластинок до проведения
испытания – 1Ст.3 и 117Г1С. Результаты измерений занесите в таблицу 1.2.
4. Поместите образцы металлических пластинок в агрессивную среду
(3%-ый раствор NaCl при температуре 20°С и плотности ρ=1,02 г/см3) и
проводите испытания в течении 7 суток.
5. По истечению 7 суток достаньте образцы металлических пластинок,
просушите и при необходимости очистите от продуктов коррозии с помощью металлической щетки.
Таблица 1.2 – Форма записи результатов проведения испытания
|
|
|
Масса образца |
Изме- |
Массовый |
Глубинный |
|
||
|
|
Корро- |
показатель |
показатель |
Корро- |
||||
Номер |
|
|
|
нение |
|||||
Материал |
зионная |
|
|
скорости |
скорости |
зионная |
|||
образца |
|
|
массы, |
||||||
До |
После |
||||||||
|
среда |
коррозии, |
коррозии, |
стойкость |
|||||
|
|
|
|||||||
|
|
|
|
г |
|||||
|
|
|
испы- |
испы- |
2 |
мм/год |
|
||
|
|
|
|
|
|
г/(мм ·ч) |
|
||
|
|
|
тания, г |
тания, г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.Взвесьте массы образцов металлических пластинок после проведения испытания – 1Ст.3 и 117Г1С. Результаты измерений занесите в таблицу 1.2.
7.Определите массовый показатель скорости коррозии материала образцов металлических пластинок по формуле 1.1. Полученные результаты занесите в таблицу 1.2.
11
8.Определите глубинный показатель скорости коррозии материала образцов металлических пластинок по формуле 1.4. Полученные результаты занесите в таблицу 2.
9.Сделайте вывод о балле коррозионной стойкости материала металлических пластинок в соответствии с таблицей 1.1 (ГОСТ 5272-68).
12
Лабораторная работа №2
Коррозия при контакте двух различных металлов
Цель работы: ознакомиться с явление коррозии при контакте двух различных металлов; экспериментальным путем определить место образцов металлов в электрохимическом ряду напряжения металлов.
Оборудование и материалы: образцы металлических пластинок
(медная, железная, алюминиевая), раствор серной кислоты.
Теоретическая часть
Под электрохимической системой подразумевается совокупность всех веществ, участвующих в образовании электродного потенциала.
Окислительно-восстановительная способность представляет собой одно из понятий, характеризующих именно электрохимическую систему
(«электрохимический процесс в системе»). Окислительно-восстановительная реакция протекает в гальваническом элементе несмотря на то, что окислитель и восстановитель друг с другом не соприкасаются.
Если привести металл (M) в контакт с раствором его соли, то ионы металла (MZ+) переходят из металлической фазы в раствор и обратно из раствора в металл. Поскольку энергетическое состояние ионов в этих фазах неодинаково, то в первый момент ионы металла переходят из металла в раствор и обратном направлении с различной скоростью. Если преобладает скорость перехода ионов из металла в раствор, то раствор приобретает положительный заряд, а металлический электрод заряжается отрицательно.
По мере накопления положительных зарядов в растворе переход катионов металла в одноимённо заряженный раствор затрудняется. Скорость перехода
13
зарядов из металла в раствор уменьшается, в то время как скорость перехода катионов из раствора в металл возрастает. В результате скорости обоих процессов выравниваются и устанавливается равновесие
MZ+ (металл) MZ+ (раствор)
При этом металлический электрод оказывается заряженным отрицательно, а раствор – положительно. Если установить контакт металлического электрода с раствором его соли и при этом скорость перехода катионов из металла в раствор будет меньше, чем скорость их перехода в обратном направлении, то в этом случае электрод заряжается положительно,
а раствор отрицательно.
Если же при этом соединить проводником электроды различных металлов, погруженных в растворы собственной соли, то образуется гальванический элемент, по которому будет протекать электрический ток в следствие возникновения ЭДС. Протекание электрического тока по данному гальваническому элементу будет сопровождаться окислением (разрушением)
более электроотрицательного заряженного электрода и восстановлением
(осаждением металла) менее электроотрицательного заряженного электрода.
Для примера рассмотрим подробно процессы, происходящие в гальваническом элементе Якоби – Даниэля (рисунок 2.1).
В этом элементе соответствующие равновесия устанавливаются между цинковым электродом и раствором сульфата цинка
Zn2+ (металл) Zn2+ (раствор ZnSO4)
Точно также устанавливается равновесие и между медным электродом и раствором сульфата меди
Cu2+ (металл) Cu2+ (раствор CuSO4)
14
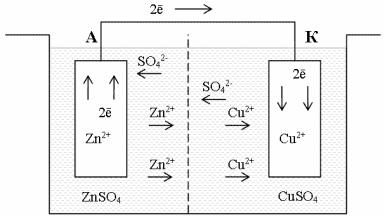
Как видим, в элементе Якоби – Даниэля имеются еще две границы раздела фаз: между растворами сульфатов цинка и меди, а также между самими элект-
Рисунок 2.1 – Схема гальванического элемента Якоби-Даниэля
родами цинка и меди. Рассмотрим влияние каждой из трех границ на величину ЭДС гальванического элемента. Граница между растворами неоказывает существенного влияния ни на величину ЭДС, ни на протекание реакции при работе элемента. Через границу между металлами могут проходить не ионы, как в случае границы металл – раствор, а электроны. При этом диффузия атомов и ионов из металла в металл происходит медленно и практически не влияет на установление равновесия на границе между металлами. Здесь вследствие неодинакового энергетического состояния электронов в цинке и в меди первоначальные скорости перехода электронов из одного металла в другой и в обратном направлении различны. Однако и в этом случае равновесие, при котором металлы также приобретают заряды противоположного знака, устанавливается быстро
e(медь) e(цинк)
Таким образом, при разомкнутой цепи элемента Якоби – Даниэля на трех рассматриваемых границах раздела фаз устанавливаются равновесия, причем
15
фазы заряжаются. Энергетическое состояние электронов на концах разомкнутой цепи оказывается неодинаковым: на цинковом электроде энергия Гиббса электронов выше, а на медном электроде – ниже. Разность энергий Гиббса электронов на концах цепи и определяет ЭДС данного элемента.
При замыкании внешней цепи электроны перемещаются от цинкового электрода к медному. В этом случае равновесие на фазовых границах нарушается, происходит направленный переход ионов цинка из металла в раствор, ионов меди – из раствора в металл, электроны протекают от цинка к меди. Так осуществляется окислительно-восстановительная реакция в гальваническом элементе Якоби – Даниэля, так, в принципе, образуется ЭДС в любом гальваническом элементе при контакте двух различных металлов.
Практическая часть
1.Налейте в пробирку 5-6 мл раствора серной кислоты.
2.Поочередно опустите туда алюминиевую, железную и медную пластинку. Наблюдайте медленное выделение водорода. Объясните выделение водорода на пластинках.
3.Опустите в пробирку медную и алюминиевую пластину и приведите их в электрический контакт. Наблюдайте выделение водорода на медной пластинке. Объясните выделение водорода на медной пластинке.
4.Опустите в пробирку медную и железную пластину и приведите их в электрический контакт. Наблюдайте выделение водорода на железной пластинке. Объясните выделение водорода на железной пластинке.
16
5.Опустите в пробирку железную и медную пластину и приведите их в электрический контакт. Наблюдайте выделение водорода на медной пластинке. Объясните выделение водорода на медной пластинке.
6.Сделайте вывод о порядке расположения железа, алюминия и меди в электрохимическом ряду напряженности металлов.
17
Лабораторная работа №3
Электродный потенциал металлов относительно медно-
сульфатного электрода сравнения
Цель работы: ознакомиться с понятием электродного потенциала металлов; экспериментальным путем определить электродные потенциалы представленных образцов металлов.
Оборудование и материалы: образцы стальной и цинковой пластинок,
медно-сульфатный электрод сравнения, милливольтметр, емкость с водой.
Теоретическая часть
Электродный потенциал – это разность электрических потенциалов между электродом и электролитом.
Разность потенциалов между металлом и раствором, в который он погружен, можно измерить, «соединив» раствор проводником с измерительным прибором. Самое трудное – это присоединить к прибору раствор. Такое соединение можно сделать только при помощи металлического проводника, который служит для погружения в раствор. Но при соприкосновении с раствором на поверхности металла проводника образуется двойной электрический слой и появляется разность потенциалов.
Значит, при помощи измерительного прибора можно определить не потенциал одного электрода, а разность потенциалов между двумя электродами.
Электрод сравнения – это электрод, который применяется для определения электродного потенциала некоторого металла. В качестве
18
электродов сравнения выбирают электроды, потенциалы которых характеризуются хорошей стабильностью и воспроизводимостью.
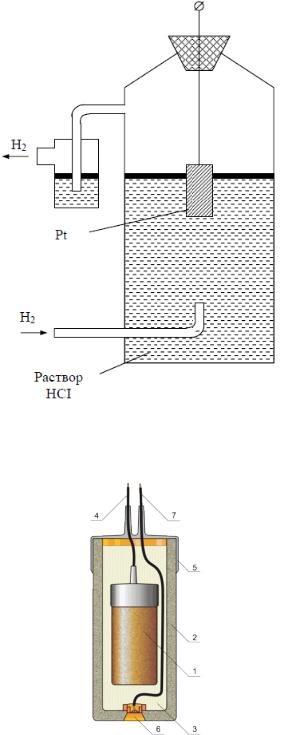
Поскольку электродные потенциалы металлов, измеренные относительно различных электродов сравнения, будут различны для расчетов электродных потенциалов был выбран электрод, потенциал которого условно принят равным нулю. В качестве такого электрода был выбран платиновый электрод, который погружен в раствор, содержащий ионы водорода,
омывается пузырьками газообразного водорода, продуваемого через раствор,
и адсорбирует на своей поверхности водород, образуя водородный мешок
(рисунок 3.1). Количество воды, содержание соляной кислоты и давление обтекающего его потока водорода должны иметь строгое значение.
Водородный электрод, электролит которого в расчете на 1000 г воды содержит 43,18 г соляной кислоты, а обтекающий его поток водорода имеет давление 1 кгс/см2 называется нормальным водородным электродом. Его электродный потенциал по соглашению принимается равным нулю.
Электродный потенциал металлов, измеренный относительно нормально водородного электрода сравнения называется нормальным, или
стандартным, потенциалом металла. Классический электрохимический ряд напряжения металлов построен на основании нормальных потенциалов металлов.
Наибольшее распространение помимо водородного электрода получили следующие электроды сравнения: каломельные, хлорсеребряные,
ртутносульфатные, ртутноокисные, хингидронные и другие.
В области трубопроводного транспорта для измерения защитных потенциалов трубопроводов относительно земли при катодной поляризации применяется медно-сульфатный электрод сравнения. Классическая схема медно-сульфатного электрода сравнения представляет собой медный
19
стержень внутри корпуса из диэлектрика, заполненного насыщенным раствором медного купороса CuSO4, который отделяется от грунта пористой перегородкой (ионообменной мембраной). Раствор медного купороса проса-
Рисунок 3.1 – Нормальный водородный электрод сравнения
Рисунок 3.2 – Медносульфатный электрод сравнения
20
