
Биомаркеры перинатального поражения центральной нервной системы
.pdf
ISSN 2308-2402 (Print)
ISSN 2658-7424 (Online)
en (http://www.neonatology-nmo.ru/en/jarticles_neonat/260.html? |
|
|
SSr=0401343bdf20ffffffff27c__07e4040f140410-78e) |
||
|
(/)
Главная (http://www.neonatology-nmo.ru/ru/pages/index.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
О журнале (http://www.neonatology-nmo.ru/ru/pages/about.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
Архив (http://www.neonatology-nmo.ru/ru/pages/archive_page.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e) Pедколлегия (http://www.neonatology-nmo.ru/ru/pages/editorial_board.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
Рецензирование (http://www.neonatology-nmo.ru/ru/pages/reviewing.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
Авторам (http://www.neonatology-nmo.ru/ru/pages/to_authors.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
Этика (http://www.neonatology-nmo.ru/ru/pages/ethics.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
Контакты (http://www.neonatology-nmo.ru/ru/pages/contacts.html?SSr=0401343bdf20ffffffff27c__07e4040f140410-78e)
К содержанию (http://www.neonatology-nmo.ru/ru/journals_neonat/15.html? |
|
SSr=0401343bdf20ffffffff27c__07e4040f140410-78e) |
1 . 2017 |
Биомаркеры перинатального поражения центральной нервной системы
Задворнов Алексей Анатольевич, Голомидов Александр Владимирович,
Григорьев Евгений Валерьевич
РезюмеПеринатальное поражение головного мозга - одна из самых актуальных проблем неонатологии. К наиболее перспективным инструментам для выявления поражения центральной нервной системы (ЦНС) относятся биомаркеры поражения головного мозга. Несмотря на большое количество исследований, касающихся биомаркеров у новорожденных, данный диагностический инструмент не проник в широкую клиническую практику. В настоящей статье суммированы данные литературы о природе биомаркеров, измерения их уровня в биологических жидкостях у новорожденных с интактной и поврежденной ЦНС, а также рассмотрены данные о прогностической ценности биомаркеров. Для внедрения биомаркеров в
клиническую практику в первую очередь необходимо решить вопрос их клинического позиционирования, определить референсные величины, интерпретацию отклонений их уровня.
Ключевые слова:биомаркеры поражения головного мозга, гипоксически-ишемическая
энцефалопатия
Неонатология: новости, мнения, обучение. 2017. № 1. С. 47-57. DOI: 10.24411/2308-2402-2017-00016
Гипоксически-ишемическая энцефалопатия (ГИЭ) - это неврологическая дисфункция в ранние дни жизни у доношенных детей, характеризующаяся нарушением начала и поддержки дыхания, ослаблением мышечного тонуса и рефлексов, нарушением сознания и частым возникновением судорог. Актуальность проблемы проявляется широким распространением заболевания (1-3
Купить номер
(http://medknigaservis.ru/productcategory/zhurnaly/neonatologiya- novosti-mneniya-obuchenie/)
Оформить подписку
(https://www.akc.ru/itm/neonatolog novosti-mneniy_a-
obuc_henie/)
(https://elibrary.ru/ti(htletps://cyberlenabout.asp? id=48965) novosti-
mneniyaobuchenie)
(http://ulrichsweb.(https://vakserialssolutions.min
type=19&name=
(http://catalog.viniti(http.ru/s://pravonarchresult IRL=QUERY+ID%3A2540088&ADVo-
nas/zhurnalneonatologiianovostimneniiaobuchenie/)
(http://prof.ncagp.(https://wwwru/index.php?.nc _t8=52) term=2308-
2402)

случая на 1000 живорожденных), а также высокой летальностью (до 20%) и инвалидизацией (до 25% выживших) детей после перенесенной ГИЭ [1]. Раннее выявление и начало церебропротекции гипоксически-ишемического поражения центральной нервной системы (ЦНС) остается единственным способом снижения летальности и инвалидизации новорожденных.
Оценка клинической картины занимает важнейшее место в выявлении неонатальной энцефалопатии, но в ряде ситуаций, таких как применение седативных и противосудорожных препаратов, имеет свои ограничения. К потенциальным направлениям экспресс-диагностики
поражения ЦНС относится выявление биомаркеров нейронального повреждения (нейромаркеров) в биожидкостях новорожденного. Нейромаркеры - специфические продукты деградации нейрональной ткани, уровень которых повышается при различных видах поражения ЦНС, 8 из них в той или иной степени изучены в неонатологии (табл. 1). К нейромаркерам не относятся метаболиты, возбуждающие аминокислоты, метаболиты свободнорадикального повреждения, цитокины, факторы роста сосудов и эндотелия, эритропоэтин, а также прочие ве- щества, уровень которых изменяется в крови и ликворе под воздействием гипоксии, ишемии и воспаления.
Креатинкиназа
Креатинкиназа ВВ-фракции (КК-ВВ) - исторически первый детально изученный нейромаркер у новорожденных [2], фермент, принимающий участие в клеточных энергетических процессах. Молекула КК состоит из двух субъединиц: М и В, различное сочетание которых образует 3 изофермента: ММ, ВВ и МВ. Изофермент ВВ содержится преимущественно в тканях головного мозга, а также в скудном количестве в прочих тканях организма. В нейрональной ткани КК-ВВ содержится и в нейроцитах, и в глиальных (преимущественно в астроцитах) клетках. Кроме нейрональной ткани КК-ВВ богаты опухоли нейроэктодермального происхождения, что приводит к повышению ее уровня, например, при мелкоклеточном раке и нейробластоме.
Известно, что уровень КК-ВВ повышается при развитии неонатальной энцефалопатии [2, 3], а также у умерших новорожденных [2, 4]. Однако следует помнить, что особенностью постнатальной кинетики КК-ВВ является повышение ее уровня после родов даже у здоровых новорожденных [2, 3], не зависящее от режима родов [2], обусловленное, вероятно, высвобождением из плаценты и пупочных сосудов, имеющих обильные ее запасы [5]. Это снижает специфичность данного маркера у новорожденных в диагностике поражения ЦНС, что подтверждается рядом работ, выявивших его низкую прогностическую ценность [3, 4, 6].
Нейронспецифическая енолаза
Енолазы (2-фосфо-D-глицератгидролаза, 80 кДа) -семейство ферментов гликолитической системы клетки. Одна молекула енолазы состоит из двух субъединиц, и каждая из них может иметь 3 изоформы: α, β и γ, различная комбинация последних (αα, αβ, αγ, ββ и γγ) обусловливает разнообразие ферментов данного семейства. Гамма-форма (содержащая γ-субъединицу - αγ и γγ) известна как нейронспецифическая енолаза (НСЕ, Neuron-speciIc enolase, NSE), гамма- енолаза, енолаза-2), так как впервые она была обнаружена в нейронах и нейроэндокринных клетках. Уровень НСЕ повышается в крови и ликворе при поражении ЦНС, а также при нейроэндокринных опухолях.
Общепринятых референсных значений уровня НСЕ у детей и новорожденных нет, но результаты ряда работ дают возможность предположить, что для ликвора и крови он не превышает 20 нг/ мл (см. табл. 1) и не зависит от пола [7]. У недоношенных детей уровень НСЕ выше по сравнению с доношенными (21,83±15,06 нг/мл) [8]. Кроме того, имеются данные о более высоком уровне НСЕ в артериальной пуповинной крови по сравнению с венозной, что объясняется фетальной природой белка [9]. Данные, относящиеся к дальнейшей возрастной динамике, говорят о повы- шении уровня НСЕ в ликворе на 1% в год до 60-летнего возраста [10] и понижении с возрастом в крови [9].
Скачать книгу
(/patrns/images/block.pdf)
(https://www.vshouz.ru/orgzdrav2
(ttps://www.icpd.am/ru)
(http://www.lsgeotar.ru? XFrom=journal_neonat)
(http://vshouz.ru? XFrom=journal_neonat)
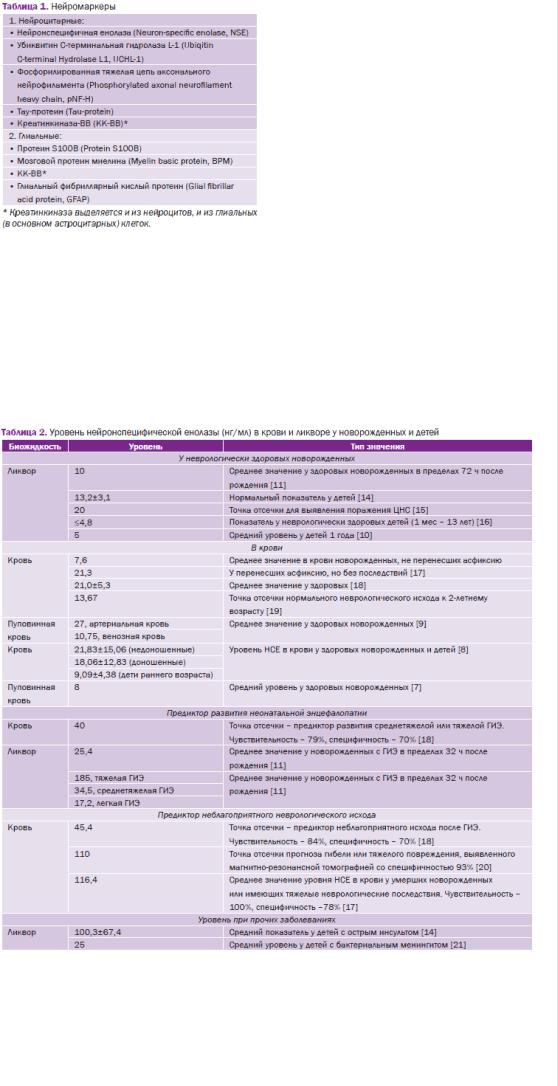
Уровень НСЕ в крови и ликворе у новорожденных, перенесших ГИЭ, поднимается >25 нг/мг, при этом отмечается прямая зависимость между тяжестью гипоксически-ишемической энцефалопатии и уровнем НСЕ как у доношенных [11], так и у недоношенных детей [12]. У детей, перенесших ГИЭ, уровень НСЕ после рождения постепенно снижается, причем при терапевтической гипотермии уровень НСЕ снижается интенсивнее [13]. К тому же мониторинг уровня НСЕ может иметь высокое прогностическое значение. Так, уровень НСЕ в крови >45 нг/ мл может говорить о высоком риске неблагоприятных последствий: гибели или развития больших неврологических нарушений - детского церебрального паралича (ДЦП), задержки умственного развития или симптоматической эпилепсии (табл. 2).
Протеин S-100
S100 - семейство низкомолекулярных (9-13 кДа) кальцийсвязывающих белков, насчитывающих 25 различных белков, распространенных в различных тканях. Данное семейство было открыто в 1965 г. в виде отдельной белковой фракции, оно получило свое название в связи с растворимостью в 100% сульфате аммония. В последующем была обнаружена неоднородность

белков этой фракции. Вследствие его обилия в нервной системе и ограниченности иммунохимических систем на тот момент, S100 расценивался как нейроспецифический глиальный протеин, но в 1981 г. было доказано, что его распространение не ограничено мозговой тканью. По мере выявления отдельных белков данного семейства был выделен белок S100B, обладающий самой высокой нейроспецифичностью, так как у млекопитающих он наиболее распространен в глиальных клетках центральной (астро-циты) и периферической (шванновские клетки) нервной системы, а также в меланоцитах, хондроцитах и адипоцитах.
Физиологическая роль кальцийсвязывающих белков заключается в связывании свободных ионов кальция для передачи внутриклеточного сигнала, а также для предотвращения взаимодействия с фосфатами и образования нерастворимого фосфата кальция.
У неврологически здоровых новорожденных уровень протеина S100В выше, чем у взрослых, причем у недоношенных уровень S100 и S100B в крови, моче и слюне более высокий по сравнению с доношенными [22, 23], вероятно, вследствие более высокой проницаемости незрелого гематоэнцефалического барьера. В пупочной артерии уровень S100B выше по сравнению с пупочной веной [9, 24], что вкупе с данными о его нормальном уровне в сыворотке
матери при гибели плода позволяет предположить его частичную утилизацию в плаценте при непроницаемости через плацентарный барьер.
Уровень белка выше после вагинальных родов, чем после кесарева сечения [24], что наряду с более высокими уровнями глюкозы и лактата, более низким рН и избытком оснований может быть объяснено более высоким родовым стрессом плода при вагинальных родах, особенно затяжных. Есть данные, что гемолиз влияет на уровень S100, а это может иметь значение при гемолитических состояниях [9]. Данные о зависимости уровня S100 от пола ребенка разнятся: одни исследователи выявили такую зависимость с более высоким уровнем у девочек, другие же данную зависимость отрицают [25].
По имеющимся данным, средний уровень S100 и S100B в крови у здоровых новорожденных <1,0 нг/мл у доношенных (но может достигать 1,79 нг/мл) и >1,0 нг/мл у недоношенных (см. табл. 2). В ликворе средний уровень S100 - 1,5 нг/мл, а уровень S100B в моче - ≤1,0 нг/мл у доношенных и 6,8 нг/мл у недоношенных. Уровень S100 в крови новорожденных, перенесших ГИЭ, поднимается выше 2,35 нг/мл. При этом наблюдается корреляция уровней S100 и S100B с тяжестью ГИЭ. Уровень S100B крови при легкой ГИЭ превышает 1,72 нг/мл, при среднетяжелой и тяжелой ГИЭ - 3,61 нг/мл. У детей с ГИЭ точка отсечки уровня S100B в первой моче составляет 0,41 нг/мл, достигая пиковой концентрации 28,4 нг/мл в 1-е сутки жизни. При наличии ГИЭ у доношенных новорожденных уровень S100, повышенный в 1-е сутки, снижается с достижением нормы к 14-м суткам [22], при проведении гипотермии снижается быстрее [20].
Также выявлена важная прогностическая роль протеинов S100 и S100B в крови и мочи новорожденного. По данным ряда статей, при превышении уровня в крови 12 нг/мл белка S100 и 1,6 нг/мл белка S100B имеется неблагоприятный исход ГИЭ. Медиана прогностически важного уровня S100B в моче составляет 0,23 нг/мл при благоприятном и 0,28 при неблагоприятном исходе. Кинетика S100B в первые дни жизни также может играть важную прогностическую роль. Нарастание в динамике концентрации протеина S100B в моче от 0-го к 72-му часу жизни имеет неблагоприятное прогностическое значение, в противоположность снижения у группы новорожденных, не имеющих неблагоприятного исхода [26, 27].
Основной белок миелина
Основной белок миелина (ОБМ, myelin bask protein, MBP) - один из белков миелиновой оболочки ЦНС. Миелин характеризуется высоким содержанием протеинов (2530%), состоящих из 342 различных белков. Основной белок протеина (ОБП) относится ко второму по распространен- ности после миелин-ассоциированного протеина белку центральной (35%) и периферической (15-20%) нервной системы, характеризуется высоким содержанием (около 25%) основных (катионных) аминокислот. У человека встречаются 3 изоформы данного белка с молекулярной массой 17,5, 18,5 и 21,5 кДа.
В формировании и поддержании миелинового слоя принимает участие олигодедроглия, на основании этого ОБМ относят к глиальным маркерам. При фокальном инфаркте мозга ОБП может служить маркером субкортикального поражения ЦНС. Уровень ОБМ крови повышается

при внутричерепных кровоизлияниях, опухолях ЦНС, ишемическом инсульте, травмах [43].
На основании ограниченного количества работ известно, что уровень ОБМ в крови и ликворе у новорожденных с НЭК повышается в течение первых 24 ч жизни и коррелирует с тяжестью последнего. В динамике к концу периода новорожденности уровень ОБМ снижается, кроме недоношенных и новорожденных детей с текущим инфекционным процессом [44-46].
Глиальный фибриллярный кислый протеин
Глиальный фибриллярный кислый протеин (Glial brillar acid protein, GFAP) относится к промежуточным филаментам цитоскелета, характерен только для астроцитов, в большей степени фибриллярных, известен еще как астроцитспецифичный церебропротеин (астропротеин). Незначительное количество GFAP обнаружено в хрусталике глаза, шванновских и тестикулярных клетках Лейдига, звездчатых клетках печени и поджелудочной железы, энтеральной глии, подоцитах, мезангиальных клетках и хондроцитах.
Уровень GFAP повышается в крови и ликворе при черепно-мозговых травмах, постреанимационном повреждении мозга, ишемическом инсульте [43], а также ГИЭ у ново- рожденных [47-49].
Уровень GFAP у неврологически здоровых новорожденных в пуповинной крови, по данным С. Ennen, повышается до 0,2 нг/мл. У детей с перинатальным поражением головного мозга он превышает 0,2 нг/мл, точка отсечки высокого риска патологических изменений на МРТ головного мозга - 0,15 нг/мл. Также выявлена прогностическая роль: медиана уровня GFAP в группе детей с летальным исходом составляет 0,61 нг/мл; в группе детей, имеющих бульбарные расстройства при выписке, - 0,26±0,1 нг/мл; у детей, вскармливаемых через соску, - 0,04±0,06 нг/ мл [47]. Данные М. Blennow тоже подтверждают повышение уровня GFAP у детей с перенесенной асфиксией по сравнению с контрольной группой, а также корреляцию с тяжестью энцефалопатии [49].
У недоношенных новорожденных, перенесших и не перенесших асфиксию, уровень GFAP в ликворе одинаковый (до 0,7 и 0,56 нг/мл соответственно), но по прошествии 1 дня жизни
уровень в группе недоношенных с развившейся перивентрикулярной лейкомаляцией достоверно выше (до 1,03 нг/мл) по сравнению с контрольной группой (до 0,06 нг/мл) [48]. Постепенное высвобождение GFAP в ликвор описано и у взрослых пациентов, перенесших ишемический инсульт, с достижением максимальной концентрации к 2-4-му дню жизни [50].
Убиквитин С-терминальная гидролаза L1
Убиквитин карбоксил-терминальная гидролаза L1 (Ubiqitin С-terminal Hydrolase L1, UCHL-1) - один из ферментов деубиквитинизирующей системы, участвующей в регуляции внутриклеточных белков путем отщепления сигнального протеина убиквитина. UCH-L1 - нейронспецифичный белок, концентрируется в дендритах, составляет 1-5% от тотального растворимого протеина клетки, известен еще как протеиновый генный продукт 9,5 (PGP 9.5). При мутации гена, кодирующего убиквитингидролазы, в клетке происходит накопление дефектных белков с последующим развитием нейродегенеративного состояния.


Ввиду своей нейротропности UCHL-1 в настоящее время рассматривается как перспективный маркер поражения мозговой ткани. Выявлено повышение его уровня при черепно-мозговой травме, нейроэктодермальных и прочих опухолях, а также при ГИЭ [51-53].
В настоящее время известно 3 работы, исследующие изменение уровня UCH-L1 у новорожденных. При развитии ГИЭ уровень UCH-L1 повышается в первые 72 ч жизни по сравнению с контрольной группой (2,1±1,3 нг/мл), достигая у пациентов с летальным исходом 10,8 нг/мл в первые 6 ч жизни и 87-170 нг/мл в возрасте старше 6 ч жизни. Уровень UCH-L1 коррелирует с тяжестью неонатальной энцефалопатии, а также обладает прогностической ценностью неврологических последствий (медиана 1,88 нг/мл при нормальном исходе и 2,38 нг/ мл при неблагоприятном). В динамике при тяжелой и среднетяжелой ГИЭ уровень UCH-L1 снижается (медиана 2,6 нг/мл при рождении и 0,5 нг/мл на 84-96-й час жизни), в отличие от легкой формы, где аналогичной динамики не наблюдается (1,3 нг/мл при рождении и 0,9 нг/мл на 84-96-й час жизни) [51-53].
Фосфорилированный аксональный нейрофиламент, тяжелая цепь (pNF-H) Фосфорилированный аксональный нейрофиламент, тяжелая цепь (phosphorylated neuroSlament heavy chain, pNF-H, neuroSlament-200) - один из белков цитоскелета, относящийся к IV типу промежуточных филаментов. Фосфорилированная форма тяжелого белка нейрофиламентов (pNF-H) находится только в аксонах нейроцитов, в связи с чем его используют как маркер аксонального повреждения.
Имеются данные о более поздней экспрессии тяжелой цепи по сравнению с легкой и средней цепями в развивающемся мозге, что вкупе с поздним фосфорилированием в процессе онтогенеза обусловливает более низкое содержание pNF-H в ткани головного мозга новорожденных и, возможно, более низкое содержание в крови и ликворе при поражении головного мозга [54].
Имеются данные о повышении уровня pNF-H у больных с наследственной оптической нейропатией Лебера, при рассеянном склерозе, спинальной травме, субарахноидальном кровоизлиянии, болезни Альцгеймера, а также черепно-мозговой травме у детей и взрослых
[52].
Пилотное исследование у новорожденных, перенесших асфиксию, выявило повышение уровня pNF-H в крови и корреляцию с тяжестью ГИЭ и изменениями на магнитно-резонансной томографии (МРТ). Медиана уровня pNF-H в группе детей с развившейся ГИЭ составила 0,44 нг/ мл по сравнению с 0,015 нг/мл контрольной группы. Точка отсечки развития ГИЭ составила 0,71 нг/мл. Пиковое значение у погибшего ребенка достигало 5,15 нг/мл [52].
Тау-протеин (тепловой протеин) Тау-протеин - нейрональный протеин, относящийся к классу белков, ассоциированных с микротрубочками (БАМ, microtubule-associated proteins, MAPs), играющий важную роль в их стабилизации, процессах нейронального роста и развития, а также проведения нервного импульса [55]. Считается, что тау-протеин - аксонспецифичный белок, хотя имеются данные о выявлении фосфорилированных форм в соматодендритном пространстве.
При патологии ЦНС с разрушением белого вещества происходит выделение тау-протеина с повышением его уровня в сыворотке. Известно, что уровень тау-протеина повышен у пациентов,
имеющих неблагоприятный неврологический исход после перенесенного ишемического инсульта и черепно-мозговой травмы [56].
Исследования, касающиеся изменение уровня тау-протеина у новорожденных, дают противоречивые данные. Одни исследования не выявляют повышения уровня тау-протеина при развитии энцефалопатии по сравнению с контрольной группой [57], в то время как другие отме- чают повышение, а также корреляцию его уровня на 3-й и 7-й день жизни с неблагоприятным неврологическим исходом [56, 58, 59].
Нормативные показатели неизвестны. В исследовании Р. Liliang и соавт. средний уровень в группе с хорошим исходом составил 51,6±81,5 пг/мл по сравнению с 436,2+473,6 пг/мл в группе с неблагоприятным исходом. Повышение уровня тау-протеина выше 114,5 пг/мл имело неблагоприятный неврологический прогноз с чувствительностью 88% и специфичностью 94% [56].

Заключение
Несмотря на перспективность и длительную историю изучения нейромаркеров, отсутствует их текущее клиническое применение. Для введения в клиническую практику необходимо решить ряд вопросов, таких как подбор наиболее подходящего для использования в неонатологии нейромаркера и выявление его референсных величин, унификация лабораторных показателей диагностических тестов разных производителей.
Для выбора подходящего нейромаркера необходимо быстрое повышение его концентрации в биологических жидкостях при поражении ЦНС у новорожденных, что требует знания их кинетики. Так, имеются данные об отсроченном повышении концентрации НСЕ и GFAP (18-96 ч) в крови у взрослых пациентов, перенесших инсульт [60]. Для снижения инвазивности необходимо стремиться к использованию биомаркеров, выявляемых в моче или слюне.
Помимо вышеперечисленных вопросов использования нейромаркеров остается неясным вопрос о позиционировании роли нейромаркеров в клинической практике ограничить круг клинических ситуаций, в которых необходимо использование нейромаркеров. С целью прояснения данного вопроса необходимо создать рабочую группу для сбора, упорядочивания и анализа всех имеющихся на настоящий момент данных.
Финансирование. Финансовой поддержки не было.
ЛИТЕРАТУРА
1.Volpe J.J. Neurology of Newborn. 5th ed. Philadelphia : W.B. Saunders, 2008. 1120 p.
2.Cuestas R.A. Jr. Creatine kinase isoenzymes in high-risk infants // Pediatr. Res. 1980. Vol. 14, N 8. P. 935-938.
3.Nagdyman N., Grimmer I., Scholz T., Muller C. et al. Predictive value of brain-speciIc proteins in serum for neurodevelopmental outcome after birth asphyxia // Pediatr. Res. 2003. Vol. 54, N 2. P. 270-275.
4.Primhak R.A., Simmonds E. First day serum creatine kinase BB isoenzyme in high-risk infants // Eur. J. Pediatr. 1991. Vol. 150, N 4. P. 271-273.
5.Laboda H.M., Britton V. Creatinc kinase isoenzyme activity in human placenta and in serum of women in labor // Clin. Chem. 1977. Vol. 23, 7. P. 1329-1332.
6.Fernandez F., Verdu A., Quero J., Perez-Higueras A. Serum CPK-BB isoenzyme in the assessment of brain damage in asphyctic term infants // Acta Paediatr. Scand. 1987. Vol. 76, N 6. P. 914-918.
7.Kintzel K., Sonntag J., Strauss E., Obladen M. Neuron-speciIc enolase: reference values in cord blood // Clin. Chem. Lab. Med. 1998. Vol. 36, N 4. P. 245-247.
8.Abbasoglu A., Sarialioglu F., Yazici N., Bayraktar N. et al. Serum neuron-speciIc enolase levels in preterm and term newborns and in infants 1-3 months of age // Pediatr. Neonatol. 2015. Vol. 56, N 2. P. 114-119.
9.Amer-Wahlin I., Herbst A., Lindoff C., Thorngren-Jerneck K. et al. Brain-speciIc NSE and S-100 proteins in umbilical blood after normal delivery // Clin. Chim. Acta. 2001. Vol. 304, N 1-2. P. 57-63.
10.van Engelen B.G., Lamers K.J., Gabreels F.J., Wevers R.A. et al. Age-related changes of neuron-
speciIc enolase, S-100 protein, and myelin basic protein concentrations in cerebrospinal uid // Clin. Chem. 1992. Vol. 38, N 6. P. 813-816.
11.Thornberg E., Thiringer K., Hagberg H., Kjellmer I. Neuron speci c enolase in asphyxiated newborns: association with encephalopathy and cerebral function monitor trace // Arch. Dis. Child. Fetal Neonatal Ed. 1995. Vol. 72, N 1. P. 39-42.
12.Giuseppe D., Sergio C., Pasqua B., Giovanni L.V. et al. Perinatal asphyxia in preterm neonates leads to serum changes in protein S-100 and neuron speci c enolase // Curr. Neurovasc. Res. 2009. Vol. 6, N 2. P. 110-116.
13.Sun J., Li J., Cheng G., Sha B. et al. Effects of hypothermia on NSE and S-100 protein levels in CSF in neonates following hypoxic/ ischaemic brain damage // Acta Paediatr. 2012. Vol. 101, N 8. P. 316-320.

14. Suzuki Y., Toribe Y., Goto M., Kato T. et al. Serum and CSF neuron-speciIc enolase in patients with West syndrome // Neurology. 1999. Vol. 53, N 8. P. 1761-1764.
15. |
Inoue S. A clinical study on neuron-speciIc enolase activities in cerebrospinal uid of neonates // No |
To Hattatsu. 1992. Vol. 24, N 6. P. 548-553. |
|
16. |
Rodriguez-Nunez A., Cid E., Eiris J., Rodriguez-Garcia J. et al. Neuron-speciIc enolase levels in the |
cerebrospinal uid of neurologically healthy children // Brain Dev. 1999. Vol. 21, N 1. P. 16-19.
17.Verdu Perez A., Falero M.P., Arroyos A., Estevez F. et al. Blood neuronal speci c enolase in newborns with perinatal asphyxia // Rev. Neurol. 2001. Vol. 32, N 8. P. 714-717.
18.Celtik C., Acunas B., Oner N., Pala 0. Neuron-speciIc enolase as a marker of the severity and outcome of hypoxic ischemic encephalopathy // Brain Dev. 2004. Vol. 26, N 6. P. 398-402.
19.Costantine M.M., Weiner S.J., Rouse D.J., Hirtz D.G. et al. Umbilical cord blood biomarkers of neurologic injury and the risk of cerebral palsy or infant death // Int. J. Dev. Neurosci. 2011. Vol. 29, N 8. P. 917-922.
20.Massaro A.N., Chang T., Kadom N., Tsuchida T. et al. Bio-markers of brain injury in neonatal encephalopathy treated with hypothermia // J. Pediatr. 2012. Vol. 161, N 3. P. 434-440.
21. Inoue S., Takahashi H., Kaneko K. The uctuations of neuron-speciIc enolase (NSE) levels of cerebrospinal uid during bacterial meningitis: the relationship between the uctuations of NSE levels and neurological complications or outcome // Acta Paediatr. Jpn. 1994. Vol. 36, N 5. P. 485-488.
22.Голосная Г.С., Петрухин А.С., Маркевич К.А., Трифонова О.Е. Изменение уровня белка S100 у новорожденных с перинатальным гипоксическим поражением ЦНС // Педиатрия. 2004. Т. 83, №
1.С. 1-6.
23.Gazzolo D., Vinesi P., Bartocci M., Geloso M.C. et al. Elevated S100 blood level as an early indicator of intraventricular hemorrhage in preterm infants. Correlation with cerebral Doppler velocimetry // J. Neurol. Sci. 1999. Vol. 170, N 1. P. 32-35.
24.Wirds J.W., Duyn A.E., Geraerts S.D., Preijer E. et al. S100 protein content of umbilical cord blood in healthy newborns in relation to mode of delivery // Arch. Dis. Child. Fetal Neonatal Ed. 2003. Vol. 88, N 1. P. 67-69.
25.Portela L.V., Tort A.B., Schaf D.V., Ribeiro L. et al. The serum S100B concentration is age dependent // Clin. Chem. 2002. Vol. 48, N 6. P. 950-952.
26.Gazzolo D., Marinoni E., Di Iorio R., Bruschettini M. et al. Measurement of urinary S100B protein concentrations for the early identi cation of brain damage in asphyxiated full-term infants // Arch. Pediatr. Adolesc. Med. 2003. Vol. 157, N 12. P. 1163-1168.
27.Gazzolo D., Frigiola A., Bashir M., Iskander I. et al. Diagnostic accuracy of S100B urinary testing at birth in full-term asphyxiated newborns to predict neonatal death // PLoS One. 2009. Vol. 4, N 2. Article ID 4298.
28.Maschmann J., Heinemann M.K., Ziemer G., Speer C.P. Evaluation of protein S100 serum concentrations in healthy newborns and seven newborns with perinatal acidosis // Acta Paediatr. 2000. Vol. 89, N 5. P. 553-555.
29.Nagdyman N., Komen W., Ko H.K., Muller C. et al. Early biochemical indicators of hypoxic-ischemic encephalopathy after birth asphyxia // Pediatr. Res. 2001. Vol. 49, N 4. P. 502-506.
30.Spinella P.C., Dominguez T., Drott H.R., Huh J. et al. S-100beta protein-serum levels in healthy children and its association with outcome in pediatric traumatic brain injury // Crit. Care Med. 2003. Vol. 31, N 3. P. 939-945.
31.Qian J., Zhou D., Wang Y.W. Umbilical artery blood S100beta protein: a tool for the early identi cation of neonatal hypoxic-ischemic encephalopathy // Eur. J. Pediatr. 2009. Vol. 168, N 1. P. 71-77.

32.Gazzolo D., Vinesi P., Marinoni E., Di Iorio R. et al. S100B protein concentrations in cord blood: correlations with gestational age in term and preterm deliveries // Clin. Chem. 2000. Vol. 46, N 7. P. 9981000.
33.Андреева Н.Г. Белок S100B как маркер перинатального поражения ЦНС у новорожденных детей // Вестн. Рос. Воен.-мед. акад. 2012. № 4 (40). С. 276-278.
34.Ruetzler K., Buhrer C., Grimmer I., Muller C. et al. Urinary S-100B concentrations in term and preterm infants at risk for brain damage // Biol. Neonate. 2006. Vol. 89, N 4. P. 260-264.
35.Gazzolo D., Bruschettini M., Lituania M., Serra G. et al. S100b protein concentrations in urine are correlated with gestational age in healthy preterm and term newborns // Clin. Chem. 2001. Vol. 47, N 6. P. 1132-1133.
36.Soliman A.M., Al-Gendy R.A., Hanaa A.M. Hypoxic-ischemig encephalopathy in term neonates: early biochemical indicators // Aust. J. Basic Appl. Sci. 2011. Vol. 5, N 5. P. 82-87.
37.Hizli D., Altinbas S.K., Kosus A., Kosus N. et al. Cord blood S100B levels in low-risk term pregnancies with meconium-stained amniotic Xuid // J. Matern. Fetal Neonatal Med. 2013. Vol. 26, N 3. P. 233-236.
38.Martins R.O., Rotta N.T., Portela L.V., Souza D.0. S100B protein related neonatal hypoxia // Arq. Neuropsiquiatr. 2006. Vol. 64, N 1. P. 24-29.
39.Gazzolo D., Marinoni E., Di Iorio R., Bruschettini M. et al. Urinary S100B protein measurements: A tool for the early identi cation of hypoxic-ischemic encephalopathy in asphyxiated full-term infants // Crit. Care Med. 2004. Vol. 32, N 1. P. 131-136.
40.Thorngren-Jerneck K., Alling C., Herbst A., Amer-Wahlin I. et al. S100 protein in serum as a prognostic marker for cerebral injury in term newborn infants with hypoxic ischemic encephalopathy // Pediatr. Res. 2004. Vol. 55, N 3. P. 406-412.
41.Murabayashi M., Minato M., Okuhata Y., Makimoto M. et al. Kinetics of serum S100B in newborns with intracranial lesions // Pediatr. Int. 2008. Vol. 50, N 1. P. 17-22.
42.Liu L., Zheng C.X., Peng S.F., Zhou H.Y. et al. Evaluation of urinary S100B protein level and lactate/creatinine ratio for early diagnosis and prognostic prediction of neonatal hypoxic-ischemic encephalopathy // Neonatology. 2010. Vol. 97, N 1. P. 41-44.
43.Brouns R., De Vil B., Cras P., De Surgeloose D. Et al. Neurobiochemical markers of brain damage in
cerebrospinal uid of acute ischemic stroke patients // Clin. Chem. 2010. Vol. 56, N 3. P. 451-458.
44.Garcia-Alix A., Cabanas F., Pellicer A., Hernanz A. et al. Neuron-speciIc enolase and myelin basic protein: relationship of cerebrospinal Ruid concentrations to the neurologic condition of asphyxiated fullterm infants // Pediatrics. 1994. Vol. 93, N 2. P. 234-240.
45.Дидманидзе Т.Д. Динамика показателей нейрон-специфичной енолазы и миелин-основного белка у детей с перинатальными поражениями ЦНС : автореф. дис. ... канд. мед. наук. М., 2003.
46.Баканов М.И, Алатырцев В.В, Гончарова О.В., Дидманидзе Т.Д. и др. Клинико-
диагностическое значение енолазы и основного белка миелина у новорожденных с перинатальными гипоксическими поражениями ЦНС // Рос. педиатр. журн. 2003. Т. 6, № 4. С. 19-
47.Ennen C.S., Huisman T.A., Savage W.J., Northington F.J. et al. Glial Pbrillary acidic protein as a biomarker for neonatal hypoxic-ischemic encephalopathy treated with whole-body cooling // Am. J. Obstet. Gynecol. 2011. Vol. 205, N 3. P. 251-257.
48. |
Stewart A., Tekes A., Huisman T.A., Jennings J.M. et al. Glial brillary acidic protein as a biomarker |
for periventricular white matter injury // Am. J. Obstet. Gynecol. 2013. Vol. 209, N 1. P. 27. e1-7. |
|
49. |
Blennow M., Hagberg H., Rosengren L. Glial brillary acidic protein in the cerebrospinal uid: a |
possible indicator of prognosis in full-term asphyxiated newborn infants? // Pediatr. Res. 1995. Vol. 37, N 3. P. 260-264.
