
- •15. Противосвертывающая система крови. Естественные антикоагулянты.
- •20. Легочные объемы и емкости.
- •21. Количественная характеристика вентиляции легких.
- •22. Альвеолярная вентиляция легких. Диффузия газов.
- •23. Транспорт кислорода. Кривая диссоциации оксигемоглобина.
- •24.Доставка кислорода к тканям и потребление ими кислорода.
- •25.Транспорт углекислого газа.
- •26.Дыхательный центр продолговатого мозга, его функции. Локализация и функциональные свойства дыхательных нейронов продолговатого мозга.
- •27.Дыхательные нейроны спинного мозга и варолиевого моста, их роль в регуляции вентиляции легких.
- •28. Генерация дыхательного ритма. Дыхательный цикл. Классификация инспираторных и экспираторных нейронов дыхательного центра продолговатого мозга.
- •29. Рефлексы регуляции дыхания с рецепторов слизистой полости носа, гортани, трахеи, бронхиол и j-рецепторов.
- •30.Рефлексы регуляции дыхания с рецепторов растяжения легких (Геринга-Брейера) и проприорецепторов грудной клетки.
- •31. Гуморальная регуляция вентиляции легких. Влияние изменений рО2, рСо2, рН крови на вентиляцию легких.
- •32. Артериальные (периферические) и центральные хеморецепторы, их роль в регуляции вентиляции легких.
- •33. Координация (взаимодействие) функции внешнего дыхания с кровообращением и другими функциями организма.
- •34.Изменения вентиляции легких при физической нагрузке.
- •35. Изменения вентиляции легких при сдвигах парциального давления газов.
- •36.Изменения вентиляции легких при высотной гипоксии.
- •37.Изменения вентиляции легких при повышенном атмосферном давлении.
23. Транспорт кислорода. Кривая диссоциации оксигемоглобина.
О2 переносится к тканям в двух формах: связанный с гемоглобином и растворенный в плазме. В крови содержится лишь незначительное количество О2, растворимого в плазме. Согласно закону Генри, количество газа, растворенного в жид¬ кости, прямо пропорционально его парциальному давлению и коэффи¬ циенту растворимости. Растворимость О2 в плазме крови низка: при РО2 = = 1 мм рт.ст. в 100 мл крови растворяется 0,0031 мл О2
![]()
При нормальных физиологических условиях (РаО2 = 100 мм рт.ст.) в 100 мл крови растворяется 0,31 мл О2, т.е. 0,31 об.%. Такое количество О2 не обеспечивает потребности организма, поэтому основное значение име¬ ет другой способ переноса — в виде связи с гемоглобином внутри эритро¬ цита. Гемоглобин является основным протеином эритроцитов. Главной функцией гемоглобина является транспорт О2 от легких к тканям и транс¬ порт СО2 от тканей к легким. Каждая молекула гемоглобина человека со¬ стоит из белка глобина и гема. Основной глобин взрослых — НЬА являет¬ ся тетрамером, состоящим из двух полипептидных цепей а и двух поли¬ пептидных цепей р. В спиральную структуру каждой полипептидной цепи глобина встроен гем, который является комплексным соединением двух¬ валентного иона железа Fe2+ и порфирина. Ион железа гема способен присоединять одну молекулу О2, т.е. одна молекула гемоглобина способна связать 4 молекулы О2 Следует особо подчеркнуть уникальные особенно¬ сти иона Fe2+ тема обратимо связывать молекулу О2 НЬ + О2 <-> НЬО2, в то время как обычно при реакции изолированного Fe2+ и кислорода обра¬ зуется Fe3+. Окисленный ион Fe3+ не способен высвобождать О2, т.е. об¬ разуется необратимая связь, а связь иона Fe2+ тема с О2 происходит за счет конформационных изменений третичной и четвертичной структуры глобина, она обратима, т.е. в тканях происходит высвобождение О2 Гемоглобин, связанный с четырьмя молекулами О2, называется оксигемоглобином, а гемоглобин, не содержащий О2или менее четырех молекул О2, — деоксигенированным гемоглобином. 1 г гемоглобина способен максимально связать 1,34 мл О2 Учитывая, что нормальное содержание гемоглобина составляет 15 г/100 мл, можно рассчитать, что в 100 мл крови максимально может содержаться 20.1 мл О2 связанного с гемоглобином. Данная величина называется кислородной емкостью крови (КЕК):
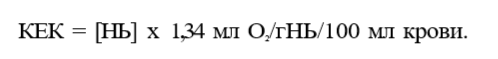
Наиболее важным параметром, определяющим количество кислорода, связанного с гемоглобином, является насыщение гемоглобина кислоро¬ дом — сатурация (SаО2), который рассчитывают по формуле:

При РаO2, равном 100 мм рт.ст., насыщение гемоглобина кислородом артериальной крови составляет около 97 %. В венозной крови (РО2 = 40 мм рт.ст.) SaO2 приблизительно равна 75 %.
Кривая диссоциации оксигемоглобина Зависимость насыщения гемоглобина О2 от парциального напряжения О2 может быть представлена графически в виде кривой диссоциации окси¬ гемоглобина. Кривая имеет сигмовидную форму, при этом нижняя часть кривой (РаО2< 60 мм рт.ст.) имеет крутой наклон, а верхняя часть (РаО2 > 60 мм рт.ст.) относительно пологая. Нижний участок кривой диссоциа¬ ции оксигемоглобина показывает, что при снижении РаО2 продолжается насыщение гемоглобина кислородом,т.е. ткани продолжают извлекать до¬ статочное количество О2 из крови. Верхняя пологая часть кривой демонст¬ рирует относительное постоянство насыщения гемоглобина кислородом, а следовательно, и содержания кислорода в крови независимо от изменений РаО2 (рис. 7.9).
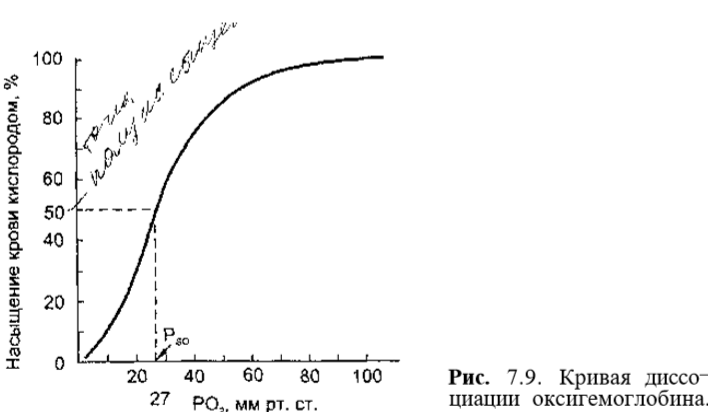
Положение кривой диссоциации оксигемоглобина зависит от сродства гемоглобина с кислородом. При снижении сродства гемоглобина к О2, т.е. облегчении перехода О2 в ткани, кривая сдвигается вправо. Повышение сродства гемоглобина к О2 означает меньшее высвобождение кислорода в тканях, при этом кривая диссоциации сдвигается влево. Важным показате¬ лем, отражающем сдвиги кривой диссоциации оксигемоглобина, является параметр Р50, т.е. такое РО2, при котором гемоглобин насыщен кислоро¬ дом на 50 % (см. рис. 7.9). В нормальных условиях у человека (при t 37 °С, рН 7,40 и РаСО2= 40 мм рт.ст.) Р5о - 27 мм рт.ст. При сдвиге кривой дис¬ социации вправо Р50 увеличивается, а при сдвиге влево — снижается. На сродство гемоглобина к О2оказывают влияние большое количество метаболических факторов, к числу которых относятся рН, РСО2 темпера¬ тура, концентрация в эритроцитах 2,3-дифосфоглицерата (2,3-ДФГ). Сни¬ жение рН, повышение РСО2 и температуры снижают сродство гемоглоби¬ на к О2 и смещению кривой вправо. Такие метаболические условия созда¬ ются в работающих мышцах, и такой сдвиг кривой является физиологиче¬ ски выгодным, так как повышенное высвобождение О2необходимо для активной мышечной работы. В противоположность этому повышение рН, снижение температуры и снижение РСО2(такие условиях создаются в лег¬ ких) смещают кривую диссоциации оксигемоглобина влево (рис. 7.10).
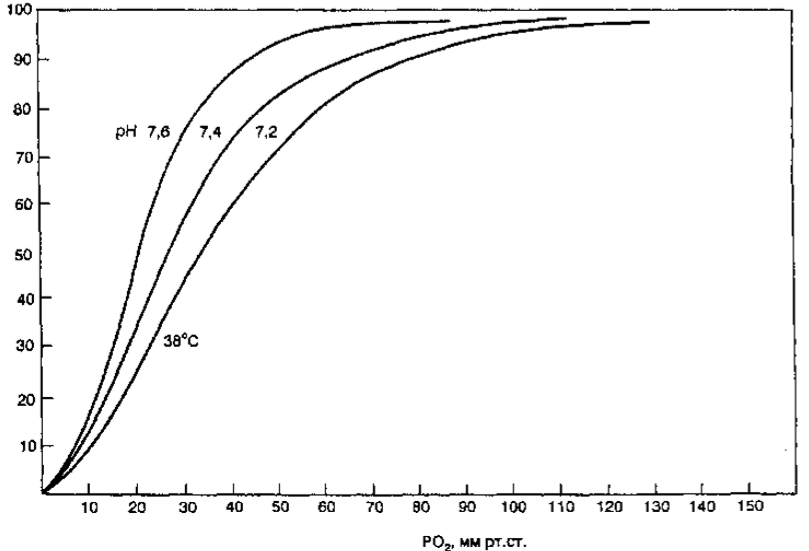
Влияние рН и РаСО2 на кривую диссоциации называется эффектом Бора. 2,3-ДФГ образуется в эритроцитах в процессе гликолиза и выполняет функцию главного энергетического субстрата (в эритроцитах отсутствуют митохондрии, поэтому не происходят реакции окислительного фосфорилирования, и АТФ не имеет большого значения как источник энергии). В условиях продолжительной гипоксии увеличивается содержание 2,3-ДФГ в эритроцитах, что приводит к снижению сродства гемоглобина к O2 и более интенсивному переходу его из крови в ткани. Снижение концентра¬ ции 2,3-ДФГ в эритроцитах приводит к сдвигу кривой диссоциации влево. На кривую диссоциации оксигемоглобина может оказать влияние и окись углерода (СО). СО имеет сродство к гемоглобину в 240 раз выше, чем О2, и, связываясь с гемоглобином, образует карбоксигемоглобин (НЬСО). При этом даже небольшие количества СО могут связать большую часть НЬ крови и значительно уменьшить содержание О2 крови. Кроме того, СО сдвигает кривую диссоциации влево, что препятствует высвобож¬ дению О2 в тканях и также усугубляет гипоксию. Еще одним фактором, влияющим на сродство НЬ к кислороду, является метгемоглобин — гемоглобин, содержащий железо, окисленное до Fе3+. У здорового человека общее содержание метгемоглобина не превышает 3 %, однако при приеме некоторых лекарств (например, фенацетин, суль¬ фаниламиды, нитроглицерин) и дефиците фермента метгемоглобин-редуктазы происходит образование значительных количеств метгемоглобина. Метгемоглобинемия вызывает смещение кривой диссоциации влево, т.е препятствует высвобождению в тканях, а при повышении концентрации метгемоглобина более 60 % происходит также и уменьшение нормального НЬ, что приводит к тяжелой гипоксии.
