
Большой практикум / Белки и ДНК / Лабораторные по экспрессии белков
.pdfФедеральное государственное автономное образовательное учреждение
высшего образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт фундаментальной биологии и биотехнологии
Базовая кафедра биотехнологии
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
Большой практикум
Преподаватель |
|
|
|
Л. П. Буракова |
||
|
|
|
подпись, дата |
|
инициалы, фамилия |
|
Студент |
|
|
|
|
|
|
|
номер группы, номер зачетной книжки |
подпись, дата |
|
инициалы, фамилия |
||
Красноярск 2020
Работа 1. Трансформация клеток E. coli (XL1Blue) плазмидами pGLO и pGRN
Цель работы: дать представление о процедуре генетической трансформации. Провести эксперимент по трансформации клеток E. coli, продемонстрировать связи ДНК → РНК→БЕЛОК→СВОЙСТВО организма.
Материалы и оборудование:
1.Компонентные клетки E. coli (XL1Blue) в буфере для трансформации;
2.Раствор плазмидной ДНК (pGRN);
3.LB-среда;
4.Агар на LB-среде;
5.Ампициллин, р-р 200 мг/мл;
6.Арабиноза, 20% раствор;
7.Чашка Петри;
8.Пипетки, стерильные типсы;
9.Пластиковые пробирки типа Eppendorf;
10.Стеклянные петли; 11.Контейнер со льдом, водяная баня (42 ), термостат (30 ); 12.Микробиологический бокс;
13.UV-лампа.
Ход работы:
1.Подписать две пластиковые пробирки +ДНК и -ДНК;
2.Поместить пробирки в ледяную баню. В боксе стерильно отобрать по 50 мкл суспензии компонентных клеток в буфере для трансформации в каждую пробирку;
3.В пробирку +ДНК внести 1 мкл раствора плазмидной ДНК (30 нг/мкл). В пробирку -ДНК внести такое же количество воды. Выдержать обе смеси на льду 30 мин.
4.Чашки Петри подписать на дне следующим образом: LB-ДНК, LB/amp-
ДНК, LB/amp+ДНК, LB/amp/ara+ДНК;
5.Расплавить агар в микроволновой печи, перенести его в бокс;
6.На дно соответствующих чашек поместить растворы ампициллина (0,02 мл, конечная конц. 200 мкг/мл) и арабинозы (0,1 мл, конечная конц. 0,1%). Залить в чашки агар (по 20 мл), осторожно перемешать и оставить полимеризоваться в боксе под UV-облучением;
2

7.Провести процедуру теплового шока. Для этого обе пробирки поместить в водяную баню (42 ) на 45 сек (строго!), после чего быстро перенести их опять на лед. Выдержать 2-3 минуты;
8.Пробирки вынуть изо льда, добавить по 200 мкл свежей LB-среды (стерильно!) и инкубировать при 37 в течение 1 часа;
9.Высеять полученные клетки на соответствующие чашки с агаром. Для этого отобрать по 100 мкл клеточной суспензии и перенести ее на поверхность агара. Растереть стерильной стеклянной петлей досуха, закрыть чашки, перевернуть и поместить в термостат (37 ) на ночь.
Анализ полученных результатов:
1. Для трансформации использовалась плазмида pGRN.
Таблица 1 – Результаты
+DNA, LB/amp |
Рост колоний, устойчивых к ампициллину, нет |
|
свечения |
|
|
+DNA, LB/amp/ara |
Рост колоний, излучение в видимом свете |
|
|
-DNA, LB/amp |
Нет роста, контроль контаминации |
|
|
-DNA, LB |
Газон, клетки жизнеспособны, подтверждается |
|
ростом на среде без антибиотика |
|
|
2.Трансформированные бактерии приобрели свойство свечения в видимом свете благодаря внедрению в них плазмиды pGRN (при внедрении плазмиды pGLO они бы светились в UV-свете). Помимо этого, побочным результатом трансформации стала устойчивость бактерий к ампициллину.
3.Эффективность трансформации.
Таблица 2 – Расчет эффективности трансформации
Эфф. Транс. = число колоний на чашке / кол-во ДНК на чашку (мкг)
Число колоний |
в |
2660 кол |
+DNA, LB/amp/ara |
|
|
|
|
|
Число колоний |
в |
3032 кол |
+DNA, LB/amp |
|
|
|
|
|
Количество ДНК |
|
Концентрация раствора ДНК = 30 нг/мкл |
|
|
50 мкл XL1Blue + 200 мкл LB = 250 мкл |
|
|
30 нг / 250 мкл → по 100 мкл на чашку |
|
|
=> 12 нг ДНК на чашку |
|
|
|
ЭТ (+DNA, LB/amp/ara) = 2660 / 0,012 = 2,2 * 10 кол/мкг ЭТ (+DNA, LB/amp) = 3032 / 0,012 = 2,5 * 10 кол/мкг
3
Эффективность трансформации зависит от состояния клеток, от качества плазмидной ДНК, ее снижают субъективные ошибки экспериментатора (перемешивание, heat shock, пипетирование, высев клеток на чашку, перегрев клеток). Максимальная эффективность трансформации достигается качеством работы.
Вывод: контрольные чашки показали жизнеспособность, трансформация прошла успешно. Чашки с индуктором арабинозы способны к флуоресценции, эффективность трансформации ожидаемая. Таким образом мы изменили состояние клеток путем внесения изменений в ДНК и проследили путь передачи признака в цепочке ДНК → РНК→БЕЛОК→СВОЙСТВО организма, используя ген GFP в качестве маркера.
Работа 2.1. Экспрессия генов, клонированных в прокариотических системах. Культивирование рекомбинантных клеток E. coli.
Цель работы: культивирование рекомбинантных клеток E. coli BL21 (DE3) Codon Plus RIPL, с контролируемой экспрессией различных рекомбинантных белков: акворина AV (плазмида pET22b-AV), обелина OL (плазмида pET19bOL) и беровина BA (плазмида pET22b-BA).
Материалы и оборудование:
1.Ночная культура из трансформированных клеток;
2.Стерильная LB-среда;
3.Стерильная колба объемом 500 мл – 1 шт;
4.Ампициллин (р-р, 200 мг/мл);
5.ИПТГ (изопропил-бета-D-тиогалактопиранозид) 1М раствор;
6.Микробиологический бокс;
7.Термостатированный шейкер-инкубатор;
8.Сперктрофотометр (СФ) и кюветы к нему;
9.Центрифуга и центрифужные стаканы к ней;
10.Весы для уравновешивания центрифужных стаканов;
11.Набор автоматических пипеток и наконечников к ним.
Ход работы:
1.Подписать колбы для культивирования (AV);
2.В стерильных условиях внести в колбы объемом 500 мл по 100 мл стерильной LB-среды, раствор ампициллина до конечной концентрации 200 мкг/мл и 2 мл ночной культуры соответствующих
бактерий. Инкубировать при 37 при активном перемешивании до
4

OD560=0,5-0,6. Оптическую плотность измерять через каждые 45-60 мин с помощью СФ против исходной среды. Пробу отбирать стерильными наконечниками;
3.Отцентрифугировать клетки (3000 g, 4 , 5 мин);
4.При плотности OD590=0,6-0,8 отобрать 2 мл культуры и отцентрифугировать. Хранить осадки клеток при -20 ;
5.Провести индукцию транскрипции рекомбинантного белка. Для этого в колбы добавить 100 мкл 1М р-ра ИПТГ (до концентрации 1 мМ);
6.Продолжить культивировать в течение 3-х часов, отбирая аликвоты с измерением OD каждый час. Отобрать 2 мл клеточной суспензии, отцентрифугировать и хранить образец, как описано в п.4;
7.Построить кривую роста оптической плотности OD600 от времени;
Таблица 3 – Зависимость оптической плотности от времени
OD600 |
0 |
0,61 |
1,1 |
1,36 |
1,61 |
|
|
|
|
|
|
Время, ч |
- |
0 |
1 |
2 |
3 |
|
|
|
|
|
|
Рисунок 1 – Кривая роста оптической плотности от времени
8. Отцентрифугировать полученную культуру (3000 g, 4 , 15 мин). Хранить осадок клеток при -20 .
Вывод: в ходе работы мы научились культивировать рекомбинантные клетки с рекомбинантным белком – акворином. Были отобраны образы культуральной жидкости за разное время культивации. Кривая роста оптической плотности от времени не вышла на плато, а продолжила расти, но интенсивность роста после часа индукции снизилась.
Работа 2.2. Приготовление реактивов
5
Материалы и оборудование:
1.Мерные цилиндры (на 250 мл и на 100 мл);
2.Мерные стаканы (на 1 л и на 200 мл);
3.Автоматические дозаторы переменного объема и носики к ним;
4.Магнитная мешалка и магниты к ней;
5.Фильтровальная система и фильтры к ней (0,8 мкм);
6.Электронные весы;
7.Ванночки и шпатели для взвешивания;
8.Мочевина (сухая);
9.NaCl (сухая соль);
10.Тритон X-100
11.1 М водный раствор Трис-HCl pH 7.0
Приготовление растворов:
1.20 мМ Трис-HCl pH 7.0 – 100 мл
2.0,9% р-р NaCl в 20 мМ Трис-HCl pH 7.0 – 20 мл
3.1% р-р Тритон X-100 – 20 мл
4.Буфер A: 6 М р-р мочевины в 20 мМ Трис-HCl pH 7.0 – 300 мл
5.Буфер B: 1 М р-р NaCl в Буфере A – 400 мл
Ход работы:
1.Приготовить требуемые растворы, используя стоковые растворы и навески сухих солей. Отфильтровать приготовленные растворы с помощью фильтровальной системы. До использования все растворы хранить при 4 .
Таблица 4 – Приготовление растворов
100 мл 20 мМ Трис-HCl |
100 мл – 1 М |
pH 7.0 |
X мл – 20 мМ |
Сток: 1 М Трис-HCl pH |
X = 2 мл 1 М Трис-HCl pH 7.0 |
7.0 |
либо 0,02 М меньше 1 М в 50 раз, 100/50=2 мл |
|
Взять 2 мл стока и довести водой до 100 мл |
|
|
20 мл 0,9% р-р NaCl в |
Переведем массовую долю в молярную C |
20 мМ Трис-HCl pH 7.0 |
M=p [г/мл] * w [%] / 58,5 [г/моль] |
Сток: 5 М NaCl |
M= (1,005*0,9/58,5) * (1000 (за г/л) / 100 (за %)) |
|
M= 0,155 моль/л |
|
20 мл / (5М/0,155М=32,25) = 0,62 мл = 620 мкл |
|
Взять 620 мкл 5 М NaCl и довести до 20 мл |
|
буфером |
|
|
|
6 |
20 мл 1% р-р Тритон |
20 – 100% |
X-100 |
X – 1% |
Сток: 100% Тритон X- |
X= 20/100 = 0,2 |
100 |
Взять 200 мкл стока и довести водой до 20 мл |
|
|
300 мл A: 6 М р-р |
0,02 М < 1 М в 50 раз, 300 мл/50 = 6 мл стока |
мочевины в 20 мМ |
довести водой до 300 мл |
Трис-HCl pH 7.0 |
Mm (мочевина) =60г/моль |
Сток: 1 М Трис-HCl pH |
6 М р-р мочевины = 6*60 = 360 г/л |
7.0, мочевина (сухая) |
360 г – 1 л |
|
X г – 300 мл |
|
X = 360*0,3=108 г мочевины |
|
Взять 108 г мочевины и довести до 300 мл |
|
20 мМ Трис-HCl pH 7.0 |
|
|
400 мл B: 1 М р-р NaCl |
1 М < 5 М в 5 раз, 400/5=8 мл |
в Буфере A |
Взять 8 мл 5 М р-ра NaCl и довести до 400 мл |
Сток: 5 М NaCl, Буфер A |
буфером A |
|
|
2.Провести отмывку телец включения, содержащих рекомбинантный белок. Для этого к осадку клеток добавить 20 мМ Трис-HCl pH 7.0 и поместить в ультразвуковой дезинтегратор-гомогенизатор (3 раза по 20 сек). Раствор профильтровать.
3.Промыть осадок в 0,9% р-ре NaCl в 20 мМ Трис-HCl pH 7.0. Промыть
осадок в 1% р-ре Тритон X-100. Промыть осадок в 20 мМ ТрисHCl pH 7.0.
Работа 3.1. Определение концентрации белков в полученных образцах методом Лоури
Цель работы: провести определение концентрации белка в полученных препаратах и оценить продукционную способность использованных рекомбинантных клеток.
Материалы и оборудование:
1.Раствор A: (1) 20 г Na2CO3 растворить в 1 л 0,1 н р-ра NaOH (4 г NaOH растворить в 600 мл H2O и довести до 1 л водой); (2) 10 г Na2C4H4O6 + 300 мл H2O + 5 г медного купороса (CuSO4*5H2O) довести до 1 л H2O;
(1) + (2) = 50 : 1;
2.Раствор B (Реактив Фолина): 100 г вольфрамата натрия (Na2WO4*2H2O) 25 г молибдата натрия (Na2MoO4*2H2O) растворить в 700 мл H2O + 50 мл 80% H3PO4 (или 55 мл 72% H3PO4) + 100 мл HClконц. → к колбе присоединить обратный холодильник и смесь кипятить в течение 8 ч +
7
150 г сернокислого лития (Li2SO4) + 50 мл H2O + 5 капель бромной воды → смесь кипятят без холодильника 15 мин под тягой, охладить, довести до 1 л водой, отфильтровать и хранить в темной склянке;
3.Раствор бычьего сывороточного альбумина (БСА);
4.Растворы белков для анализа;
5.Спектрофотометр и кюветы для измерений к нему.
Ход работы:
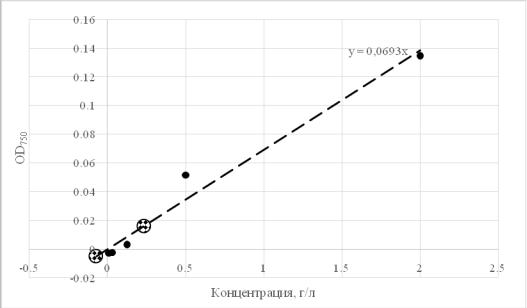
1.Построить калибровочную кривую. Для этого приготовить по 1 мл растворов БСА с концентрацией 2; 0,5; 0,125; 0,0310; 0,0078 мг/мл.
2.К 50 мкл каждого стандартного раствора БСА и опытного образца добавить по 250 мкл раствора A, перемешать и добавить 2 мл раствора B. Инкубировать 15 мин при комнатной температуре, затем измерить OD полученного раствора при λ=750 нм.
3.Построить калибровочную кривую зависимости оптической плотности раствора от концентрации белка:
Таблица 5 – Построение калибровочной кривой
OD750 |
-0,0029 |
-0,0025 |
0,0031 |
0,0516 |
0,1347 |
|
|
|
|
|
|
C, г/л |
0,0078 |
0,0310 |
0,1250 |
0,5000 |
2,0000 |
|
|
|
|
|
|
Рисунок 2 – Калибровочная кривая
4.Определить концентрацию целевого белка согласно калибровочной кривой.
Исходя из уравнения y=0,0693x была рассчитана концентрация белка:
8
C = OD / 0,0693 = 0,0162 / 0,0693 = 0,23376 * 4 = 0,935 г/л
Концентрацию белка методом Лоури определяли в том же образце с разведением в 4 раза от исходной пиковой фракции.
Расчет концентрации белка через коэффициент экстинкции:
C [М] = OD / E280 * l, l=1
E(AV) = 43555 M-1см-1
Mв(AV) = 22000 Да
C = 0,626 / 43555 = 0,000014 * 22000 = 0,316 г/л * 4 = 1,264 г/л
5.Определить количество апобелка, полученное в результате хроматографии.
Общее кол-во апобелка = C в пиковой фракции * V пиковой фракции
В результате хроматографической очистки было получено 2 мл раствора апобелка.
Общее кол-во апобелка = 1,264 мг/мл * 2 мл = 2,528 мг
6.Подсчитать продукцию рекомбинантного белка на 1 л клеточной культуры E. coli.
Из 100 мл культуры рекомбинантных клеток было получено 2,528 мг рекомбинантного апо-акворина. С 1 литра культуры, при том же уровне экспрессии, можно получить 25,28 мг белка.
Вывод: в ходе работы было проведено определение концентрации белка в препаратах и оценена продукционная способность использованных рекомбинантных клеток. Для определения концентрации были использованы методы Лоури, использующий калибровочную кривую на основе оптической плотности стандартного раствора БСА, и метод расчета с помощью коэффициента экстинкции. Различие полученных концентраций белка в растворе методом Лоури и определением белка оптическим методом составило около 1,35 раза или 35%. Такое различие между результатами может быть по нескольким причинам. Во-первых, ошибки при разведении стандартных растворов для построения калибровочной кривой, во-вторых – точность самой калибровочной кривой. В данном случае расчет концентрации белка с использованием коэффициента экстинкции является более точным, т.к. использован только один раствор белка. С другой стороны, коэффициент экстинкции и молекулярная масса – это табличные значения, которые указаны для идеальных условий.
9
Была также оценена продукционная способность культуры: 1 л культуры может дать 25,28 мг апоакворина.
Работа 3.2. Очистка апо-белков ионообменной хроматографией на DEAE-сефарозе
Материалы и оборудование:
1.Хроматографическая колонка DEAE FF (5 мл);
2.Растворы для проведения хроматографии:
(A) 6 М раствор мочевины в 20 мМ Трис-HCl pH 7.0 – 200 мл; (B) 1 М NaCl в буфере A – 100 мл;
3.Хроматографическая установка BioLogic (BioRad);
4.Пробирки для сбора фракций;
5.Набор автоматических пипеток и наконечники к ним;
6.Тельца включения апо-белка.
Ход работы:
1.К осадку отмытых телец включения добавить 5 мл буфера A и оставить на 20 минут при 4 , а затем центрифугировать 10 минут при 5000 g, осторожно отобрать супернатант в чистую пробирку;
2.Буферы A и B выдержать при комнатной температуре не менее часа, затем на хроматографе поместить шланги для элюента в емкости с соответствующими буферами. Прокачать поочередно буферы B и A через систему с помощью опции “purge” пока кондуктивность не приобретет постоянную величину;
3.Отсоединить коннектор, присоединить колонку к системе и запустить программу “DEAEwash” (10 мл буфер A, 10 мл буфер B, 10 мл буфер A, скорость элюции 2 мл/мин) для уравновешивания колонки. Дождаться завершения программы;
4.Нанести образец с помощью капилляра через шланг для буфера A на колонку. Запустить программу “DEAE FF” (15 мл буфер A, 25 мл 0- 80% буфер B, 10 мл 100% буфер B, 20 мл буфер A, скорость элюции 2 мл/мин) и собрать пиковые фракции в пробирки для сбора образцов. Дождаться завершения программы;
5.Зарисовать профиль элюции:
10
