
- •Культивирование макрофагов и моноцитов. Методики.
- •Брюшинные макрофаги. Материалы и оборудование
- •Получение макрофагов из моноцитсодержащих суспензий клеток
- •Разделение клеток крови в градиенте плотности Получение мононуклеаров из крови: мононуклеары получают из гепаринизированной крови (10 me гепарина/мл),
- •Центрифугирование в градиенте плотности
- •**Разделение гранулоцитов и фракции лимфоциты/моноциты человека в градиенте фиколл/триомбраст:
- •Седиментация в градиенте плотности
- •Оценка метода
- •Идентификация и подсчет макрофагов и моноцитов
- •Получение культур макрофагов и моноцитов
- •Модификация метода
http://imuno.net/208.php
Культивирование макрофагов и моноцитов. Методики.
Брюшинные макрофаги. Материалы и оборудование
а) Для получения перитонеальных клеток необходимы инбредные мыши различных штаммов в возрасте 3—4 мес, изотонический фосфатный буфер (например, Институт иммунных препаратов и питательных сред, Берлин), после получения сухого препарата его растворяют в тридистиллированной воде и проводят стерилизацию фильтрованием при 4°С 4—6 нед. Нужно иметь также раствор гепарина без консервантов (5000 МЕ/мл), сыворотку эмбрионов коров, инактнвированную нагреванием в течение 30 мин при 56 °С, 70% этанол, вату, кубики льда, анатомические пинцеты, ножницы, стеклянные шприцы на 10 и 20 мл, стальные иглы № 16 и 18, стакан на 400 мл, силиконизированные стеклянные центрифужные пробирки на 25 мл, настольную центрифугу,
б) Для подсчета и дифференциального определения макрофагов и моноцитов используют смесь цитрат/NаСl (8 объемов 1М NaCl+ 2 объема 1М лимонной кислоты; подводят рН 20% NaOH до 3,0—3,5 при 4°С после добавления небольшого количества тимола), 0,1% раствор кристаллического фиолетового в 1М лимонной кислоте, 0,1% раствор нейтрального красного в дистиллированной воде (краситель хранят при комнатной температуре несколько месяцев), раствор туши (коммерческую черную тушь разводят в соотношении 1 : 20 0,15 М NaCl, автоклавируют), мерные пипеткидля лейкоцитов и эритроцитов, камеру Biirker, обогреваемый столик, световой микроскоп,
в) Для получения культур макрофагов и моноцитов нужно иметь раствор Хенкса (например, Институт иммунных препаратов и питательных сред, Берлин), концентрат растворяют в тридистиллированной воде, стерилизуют фильтрацией, хранят при 4°С в течение 4—6 нед; среду Игла-МЕМ (тот же поставщик) и PPMI 1640; к средам добавляют по 2 г гидрокарбоната натрия и по 290 мг глутамина, растворяют в 1 л тридистиллированной воды, стерилизуют фильтрацией, хранят 4—6 нед при 4°С. Также необходимы растворы антибиотиков: 1 000 000 ЕД пенициллина +1 г стрептомицина растворяют в 100 мл тридистиллированной воды, стерилизуют фильтрацией, делят на небольшие порции и сохраняют при —20°С, инактивированная сыворотка эмбрионов коров, нормальная лошадиная сыворотка (инактивированная), человеческая сыворотка (инактивированная), газовая смесь: 92,5 частей воздуха и 7,5 частей СОг, стеклянные чашки Петри диаметром 5 см, пипетки на 1, 5 и 10 мл, мерные цилиндры на 50 и 100 мл, эрленмейеровские колбы на 50 и 100 мл, эксикатор, термостат, качалка.
Для силиконирования стеклянной посуды ее скачивают раствором силикона (Serva, ФРГ) и высушивают 1 ч при 100 °С. Способы очистки посуды см. раздел "Образование антител культурами клеток". Посуду упаковывают в алюминиевую фольгу и стерилизуют 2 ч при 180 °С. Так же стерилизуют ножницы и пинцеты. Растворы и среды стерилизуют пропусканием через антибактериальный фильтр G5.
Получение макрофагов из моноцитсодержащих суспензий клеток
а) Получение перитонеальных клеток: мышей забивают цервикальной дислокацией. Шкуру животного смачивают 70% этанолом. Захватывают пинцетом шкуру на животе и делают надрез ножницами с таким расчетом, чтобы разрез раздвигался в краниально-каудальном направлении. В брюшную полость вводят 3—4 мл жидкости (изотонический буфер с добавлением 5000 ЕД гепарина и 20 мл сыворотки эмбрионов коров из расчета на 1л). Жидкость вводят осторожно, стараясь не повредить кишечник, слегка приподнимая брюшную стенку пинцетом. После инъекции живот массируют большим и указательным пальцами 20—30 сек. Перитонеальную жидкость медленно отсасывают шприцем. Для этого иглу вводят в латеральную часть живота параллельно брюшной стенке. Рекомендуется отсасывать перитонеальную жидкость с обеих сторон живота, тогда из 4 мл введенной жидкости получают 3,5 мл перитонеальной жидкости, которую собирают в охлажденные до 0°С силиконнзированные центрифужные пробирки. Перитонеальную жидкость, загрязненную кровью, не используют. Клетки осаждают центрифугированием в течение 10 мин при 150 g, ресус-пендируют осадок в растворе Хенкса. До засева культуры клетки сохраняют на льду. Ниже приводится состав клеток перитонеальной жидкости у различных штаммов мышей.
Состав клеток перитонеальной жидкости у различных штаммов мышей
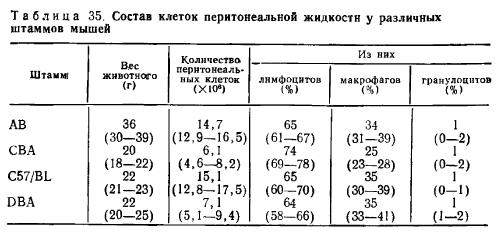
Примечание. Представлены данные от 5 животных 3-месячного возраста, в скобках — размах вариации.
Внутрибрюшинное введение различных раздражающих средств за 3—4 дня до получения перитонеальной жидкости существенно увеличивает число клеток и содержание в них макрофагов.
Влияние различных раздражающих веществ на число и состав клеток перитонеального экссудата (данные получены на мышах СБА)
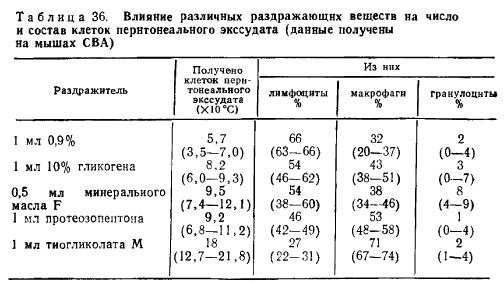
Следует указать, что индуцированные перитонеальные макрофаги отличаются по целому ряду свойств от неиндуцированных. К числу таких свойств относятся усиление пиноцитоза и фагоцитоза, а также усиление секреции биологически активных веществ in vitro.
