
Опорні конспекти та дидактичні матеріали з органічної хімії
.pdf
Харків Видавнича група «Основа»
2013
УДК 37.016 ББК 74.262.4 Н34
О. В. Наумкіна
Н34 Опорні конспекти та дидактичні матеріали з орга нічної хімії. — Х. : Вид. група «Основа», 2013. — 128, [3] с. — (Б ка журн. «Хімія»; Вип. 7 (127)).
ISBN 978-617-00-1812-0.
Ця методична розробка призначена для учнів, які готуються до скла дання ЗНО з хімії, а також для вчителів, що можуть використати цей матеріал як на уроках, так і під час підготовки школярів до тестування.
УДК 37.016 ББК 74.262.4
ISBN 978-617-00-1812-0 |
© Наумкіна О. В., 2013 |
© ТОВ «Видавнича група “Основа”», 2013 |
Зміст
Передмова . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
Теоретична частина Основні положення будови органічних сполук . . . . . . . . 5
Теорія Бутлерова . . . . . . . . . . . . . . . . . . . . 5 Вуглеводні . . . . . . . . . . . . . . . . . . . . . . 6 Гібридизація в молекулах вуглеводнів. Просторова будова . . 14 Типи хімічних реакцій у органічній хімії . . . . . . . . . 18 Алкани . . . . . . . . . . . . . . . . . . . . . . . 19 Розв’язання завдань на виведення формули речовини . . . . 24 Алкени . . . . . . . . . . . . . . . . . . . . . . . 26 Алкіни . . . . . . . . . . . . . . . . . . . . . . . 30 Циклоалкани . . . . . . . . . . . . . . . . . . . . . 33 Арени (ароматичні вуглеводні) . . . . . . . . . . . . . . 36 Бензен . . . . . . . . . . . . . . . . . . . . . . . . 38 Природні джерела вуглеводнів . . . . . . . . . . . . . . 41 Оксигеновмісні органічні сполуки . . . . . . . . . . . . 44 Нітрогеновмісні органічні сполуки . . . . . . . . . . . . 71 Полімери . . . . . . . . . . . . . . . . . . . . . . 78 Волокна . . . . . . . . . . . . . . . . . . . . . . . 82 Узагальнення навчального матеріалу з органічної хімії . . . . 84
Перевірочні роботи з органічної хімії Основні положення будови органічних сполук . . . . . . . 87
Алкани . . . . . . . . . . . . . . . . . . . . . . . 92 Алкени. Алкіни . . . . . . . . . . . . . . . . . . . . 95 Циклоалкани. Бензен . . . . . . . . . . . . . . . . . 99 Спирти . . . . . . . . . . . . . . . . . . . . . . . 101 Альдегіди. Кислоти . . . . . . . . . . . . . . . . . . 107 Естери. Жири . . . . . . . . . . . . . . . . . . . . 112 Вуглеводи . . . . . . . . . . . . . . . . . . . . . . 117 Аміни. Амінокислоти. Білки . . . . . . . . . . . . . . 119 Узагальнення з органічної хімії . . . . . . . . . . . . . 125

4Опорні конспекти та дидактичні матеріали з органічної хімії
Передмова
Ця методична розробка призначена для учнів, які готуються до скла дання ЗНО з хімії, а також для вчителів, що можуть використати цей мате ріал як на уроках, так і під час підготовки школярів до тестування.
Посібник «Опорні конспекти та дидактичні матеріали з органічної хімії» складається із двох частин. Перша частина — опорні конспекти — схеми, які містять новий матеріал, де пропущено поняття, слова або фор мули, що є ключовими під час вивчення цього матеріалу. Мета цих схем — зробити учнів не пасивними «споживачами» нової інформації, а актив ними учасниками в одержанні нових знань або закріпленні вже відомого матеріалу. Заповнення схем може бути як самостійною роботою учня з до помогою підручників і посібників, так і роботою під керівництвом учите ля. Використання схем дозволяє:
1.Заощаджувати час і повторювати великі блоки інформації за відносно стислий проміжок часу.
2.Навчитися бачити логічний узаємозв’язок між різними темами.
3.Навчитися працювати з навчальною й додатковою літературою, виді ляти головне й складати стислий конспект вивченого матеріалу. Методику роботи зі схемами обирають учні або вчитель залежно від
рівня їхньої підготовки:
1.Учні заповнюють схему з допомогою вчителя або навчальної літератури.
2.Учні заповнюють схему самостійно, а потім із допомогою вчителя або навчальної літератури перевіряють правильність і знаходять поняття або визначення, які було пропущено.
Друга частина — це завдання для відпрацьовування практичних нави чок і вмінь. Ураховуючи, що зараз перевіркою знань учнів є ЗНО, більшість завдань зошита — тестові питання. Використано питання всіх форм: за критої, відкритої, на встановлення відповідності, правильної послідовнос ті. На відміну від завдань ЗНО, у тестах закритої форми можуть бути кіль ка правильних відповідей. Велику увагу приділено схемам перетворень.
Автор буде радий конструктивним зауваженням, відзивам і пропози ціям (моя електронна адреса: nova70.70@mail.ru).
Теоретична частина |
5 |
|
|
Теоретична частина
Основні положення будови органічних сполук
Характеристика |
Неорганічні речовини |
Органічні речовини |
|
|
|
Якісні сполуки |
Всі елементи |
C, H, O (елементи- |
|
з періодичної системи |
органогени) |
|
|
N, S, P, Fe і деякі |
|
|
інші |
|
|
|
Валентність елементів |
Змінна |
C — IV, H — I, O — II |
|
|
|
Види зв’язків |
Ковалентні, йонні |
Ковалентні, |
усередині молекули |
|
у деяких — |
|
|
йонні, у великих |
|
|
молекулах — водневі |
|
|
|
Кількість сполук |
Сотні тисяч |
Мільйони |
|
|
|
Органічна хімія — розділ хімії, який вивчає сполуки, основою яких є карбоновий ланцюг.
Карбоновий ланцюг — послідовне сполучення атомів ________
один з одним.
Теорія Бутлерова
Передумови:
1)валентність С — ____; Н — ____; О — ____;
2)можливе утворення зв’язку C − C.
I положення. У молекулах існує хімічного зв’язування атомів згідно з їх яку називають
II положення. Хімічні визначаються частин, їхньою кількістю й
6Опорні конспекти та дидактичні матеріали з органічної хімії
III положення. Якщо в речовин з однаковим складом і молеку
лярною масою різні |
|
, |
|||||
у них різне |
|
|
|
. |
|||
IV положення. Оскільки в реакціях змінюються тільки деякі |
|||||||
частини молекули, то дослідження |
|
про |
|||||
дукту реакції допомагає визначити |
|
|
|
ви |
|||
хідної молекули. |
|
|
|
|
|||
V положення. Реакційна здатність окремих атомів молекули залежно від того,
з якими атомами інших елементів вони з’єднані. Атоми й групи атомів
один на одного.
Вуглеводні
Вуглеводні — органічні речовини, до складу яких входять
і |
. |
Вуглеводні |
|
циклічні
Насичені
(алкани)
Ненасичені
цетиленові
(алкіни)
Алкадієни
(дієнові)
Етиленові
(алкени)
Теоретична частина |
7 |
||
|
|
|
|
|
|
|
|
|
|
|
|
Циклічні
Циклопарафіни
(циклоалкани)
Ароматичні
Гомологічний ряд — послідовність вуглеводнів, які відповіда
ють одній |
|
, |
||||
|
|
|
|
|
|
|
але відрізняються на |
|
. |
||||
Гомологи — речовини з одного гомологічного ряду, які відріз |
||||||
няються на |
|
|
. |
|||
|
|
|
|
|
— гомологічна різниця. |
|
Форми запису молекул вуглеводнів
Молекулярна |
|
Структурна формула |
|||||||||||
формула |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкани |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(насичені) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкени
(етиленові)
Алкіни
(ацетиленові)

8Опорні конспекти та дидактичні матеріали з органічної хімії
Види атомів Карбону в карбонових ланцюгах
С– — первинний −C− — вторинний – C –
– C –
Дописати символи атомів Гідрогену в карбонових ланцюжках, визначити види атомів Карбону (первинний, вторинний, тре тинний, четвертинний).
а) CH – CH – CH – CH – CH – CH
CH CH CH
б) CH – CH – CH – CH – CH  CH
CH
CH – CH – CH
в) CH – CH – CH = CH – CH
CH – CH – CH
CH CH
г) CH – CH – CH – CH – CH CH –––––– CH
Для запропонованих речовин:
yвизначити клас, до якого належить вуглеводень; yyнаписати молекулярні формули гомологів для речовини; yyнаписати структурну формулу речовини.
C3H8
C3H6
Теоретична частина |
9 |
|
|
C3H4
C4H10
C4H8
C4H6
Ізомерія
Ізомерія — явище існування речовин з однаковим ___________
____________________________ і |
, |
|||||
|
|
|
|
|
|
|
але різних за ________________________ і |
. |
|||||
|
|
|
|
|
|
|
Ізомери — речовини, однакові за ________________________
і _____________________, але різні за _______________________
і .
Структурна ізомерія
У структурних ізомерів відрізняються:
1)довжина головного карбонового ланцюга;
2)довжини радикалів;
3)положення радикала (радикалів) щодо головного ланцюга. Головний карбоновий ланцюг — найбільш ________________
безперервна послідовність |
|
. |
10 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
Радикал — частинка з неспареним електроном, яка заміщує атом .
У результаті утворюються відгалуження від
.
Приклад — ізомери бутану:
C4H10
CH3 − CH2 − CH2 − CH3
CH3 − CH − CH3
CH3
 Напишіть структурні ізомери таких речовин:
Напишіть структурні ізомери таких речовин:
C5H12
C6H14
Увага!
1.Головний ланцюг не обов’язково прямий, він може згинатися.
2.Радикали не можна прикріплювати до початку й кінця голов ного ланцюга.
3.Нумерація головного ланцюга:
yyз того боку, до якого ближче розташований радикал (якщо не має кратних зв’язків);
yyз того боку, до якого ближче кратний зв’язок.
Теоретична частина |
11 |
|
|
Ізомерія за положенням кратного зв’язку
У речовин однакове _______________________ карбонового ланцюга, але різне кратного зв’язку.
Приклад: C4H8.
1)CH2 = CH − CH2 − CH3 бут-1-ен
2)CH3 − CH = CH − CH3 бут-2-ен
3)CH2 = C − CH3 2-метилпроп-1-ен
CH3
1 і 2 — ізомери за положенням кратного зв’язку
1 і 3, 2 і 3 — структурні ізомери Напишіть ізомери за положенням кратного зв’язку й струк турні ізомери для речовини C5H10.
Просторова ізомерія
У речовин відрізняється розташування частин молекули від носно .
Приклад:
H3C |
|
|
|
|
CH3 |
цис-бут-2-ен |
|
|
|
|
|
||||
С |
|
|
C |
|
|||
|
|
|
|||||
|
|
|
|||||
H |
|
|
|
|
H |
|
|
H3C |
|
|
|
|
H |
|
|
С |
|
|
C |
|
тран-бут-2-ен |
||
|
|
||||||
|
|
||||||
H |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|||
Напишіть просторові ізомери для пент-2-ену.

12 |
|
|
|
|
Опорні конспекти та дидактичні матеріали з органічної хімії |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Міжкласова (міжгомологічна) ізомерія |
|
|||||||||||
Речовини, однакові за |
|
, |
||||||||||
але належать до різних |
|
. |
||||||||||
Приклади: |
|
|||||||||||
1) C4H8 |
|
|||||||||||
CH2 |
= CH − CH2 − CH3 |
|
|
|
|
|||||||
|
|
|
|
|||||||||
|
|
CH2 |
− |
|
CH2 |
|
||||||
|
|
CH2 − |
|
CH2 |
|
|
|
|
|
|
|
|
2) C5H8 |
|
|||||||||||
CH ≡ C − CH2 − CH2 − CH3 |
|
|
|
|||||||||
|
|
|
||||||||||
CH2 |
= CH − CH2 − CH = CH2 |
|
|
|||||||||
|
|
|||||||||||
Назва вуглеводнів
Локант |
|
Назва радикала |
Назва головного |
|||||||
|
ланцюга |
|||||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||
Номер атома Карбону |
В основі назви — корінь, який залежить від |
|||||||||
головного ланцюга, |
числа атомів Карбону в ланцюзі: |
|
|
|
|
|||||
біля якого стоїть |
C1 |
— мет, C2 — ет, C3 |
— проп, C4 — бут, |
|||||||
радикал. |
C5 |
— пент, C6 |
— гекс, C7 — гепт, C8 |
— окт, |
||||||
yyЯкщо немає |
C9 |
— нон, C10 |
— дек |
|
|
|
|
|
|
|
кратних зв’язків, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
головний ланцюг |
|
Корінь + суфікс |
Алкани |
|
|
|
|
|||
нумерують із того |
yyЯкщо кілька одна |
Корінь + |
|
|
|
|
|
|||
кінця, де ближче |
|
кових радикалів, |
Алкени |
|
|
|
|
|||
радикал. |
|
ставлять префікс ди |
корінь + |
|
|
|
— |
|||
yyЯкщо є кратний |
|
(2), три (...), тетра |
локант подвійного |
|||||||
зв’язок, головний |
|
(...), пента (...). |
зв’язку |
|
|
|
|
|||
ланцюг нумерують |
yyЯкщо декілька |
Алкіни |
|
|
|
|
||||
із того кінця, де |
|
різних за довжиною |
корінь + |
|
|
|
— |
|||
ближче кратний |
|
радикалів, їх на |
локант потрійного |
|||||||
зв’язок. |
|
водять за порядком |
зв’язку |
|
|
|
|
|||
Число локантів = чис |
|
збільшення довжи |
Алкадієни |
|
|
|
|
|||
лу радикалів. |
|
ни |
|
корінь + |
|
|
|
— |
||
Сума локантів — міні |
|
|
|
локанти подвійних |
||||||
мальна |
|
|
|
зв’язків |
|
|
|
|
||
|
|
|
|
Циклоалкани |
|
|
|
|
||
|
|
|
|
цикло + корінь + |
||||||
|
|
|
|
Арени |
|
|
|
|
||
|
|
|
|
бензен |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Теоретична частина |
13 |
|
|
Дати назви таким речовинам: а) CH3 − CH2 − CH2 − CH3
б) CH3 − CH − CH2 − CH3
CH3
в) CH3 − CH − CH − CH2 − CH3
CH3 CH3
г) CH3 − CH − CH − CH2 − CH3
CH3 C2H5
д) CH2 = C − CH2 − CH3
CH3
е) CH2 = C −−− CH − CH3
CH3 CH3
ж) CH2 = CH − CH − CH3
CH3
з) CH3 − C ≡ C − CH − CH3
CH3
и) CH ≡ C − CH − CH3
CH3
к) CH ≡ C − CH − CH − CH3
CH3 CH3
л) 
м) CH3 
14 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
н) CH3  CH3
CH3
CH3
о) CH3 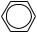
п) CH2 = CH − CH − CH = CH2
C2H5
р) CH2 = C −−− C = CH − CH3
CH3 C2H5
Гібридизація в молекулах вуглеводнів. Просторова будова
Гібридизація — явище зміни форми й енергії електронних орбіталей з утворенням
за формою й енергією гібридних орбіталей.
2s2 |
|
2p2 |
розпарування |
2s2 |
|
|
2p2 |
||||
1s2 |
|
|
|
|
2s2 електронів |
1s2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
6 |
C |
|
|
|
|
6 |
C* |
|
|
|
|
|
|
|
|||||||
Електрони |
Електрони |
|||||||||
|
|
|||||||||
в атомі Карбону |
в атомі Карбону |
|||||||||
в нормальному стані |
в збудженому стані |
|||||||||
Теоретична частина |
15 |
|
|
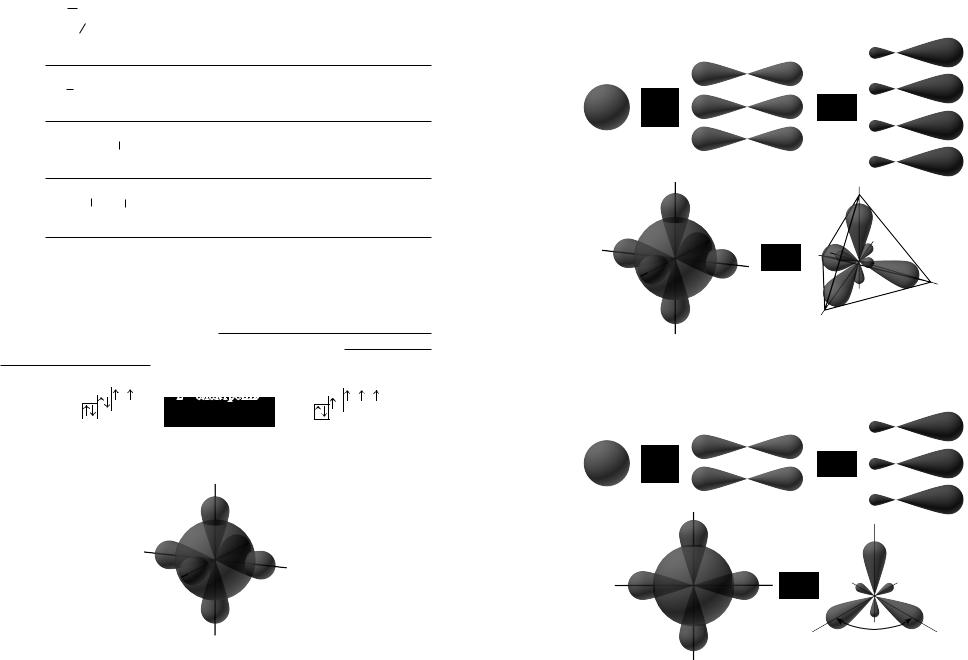
sp3-гібридизація
1s +3p → 4sp-гібридні хмари
Форма молекули — тетраедр
sp2-гібридизація
1s +3p →3sp +1p-гібридні хмари
120°
(s + p + p + p)
16 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
sp-гібридизація
1s +3p →2sp +2p-гібридні хмари
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
180° |
|
|
|||
Валентний кут — кут між |
|
|
|
|
орбіталями. |
||||||
sp3 -гібридизація — |
|
|
. |
||||||||
sp2 -гібридизація — |
|
|
. |
||||||||
sp-гібридизація — |
|
|
. |
||||||||
yyσ-зв’язок — вид зв’язку, за якого перекривання орбіталей від
бувається на осі, яка з’єднує центри атомів. |
|
||
Енергія зв’язку — |
|
. |
|
Обертання навколо зв’язку — |
|
. |
|
yyπ-зв’язок — вид зв’язку, за якого перекривання орбіталей від бувається перпендикулярно осі, яка з’єднує центри атомів.
Енергія зв’язку — |
|
|
. |
||
|
|
|
|
|
|
Обертання навколо зв’язку — |
|
|
. |
||
|
|
|
|
|
|
|
H |
|
H |
||
|
|
|
|
||
|
|
|
|
σ-зв’язок |
|
σ-зв’язок |
C |
C |
|||
|
|
|
H |
||
|
|
|
|
||
|
H |
|
H |
||
|
|
|
|
||
|
|
|
H |
|
|
|
Етан |
|
|
|
|
Теоретична частина |
|
|
|
|
|
|
|
|
|
|
|
|
17 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
H |
|
σ 120° |
|
|
H |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
120° |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
H |
|
σ |
C C σ |
|
|
|
|
C |
|
C |
σ |
|||||||||
|
|
σ |
H |
|
|
H |
σ |
120° |
σ |
|
H |
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
||
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Етилен |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
H |
|
|
|
|
C |
|
C |
|
|
H |
|
σ |
C |
|
C |
|
σ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
p |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H− C = C− H
Ацетилен
Циклобутан Бензен
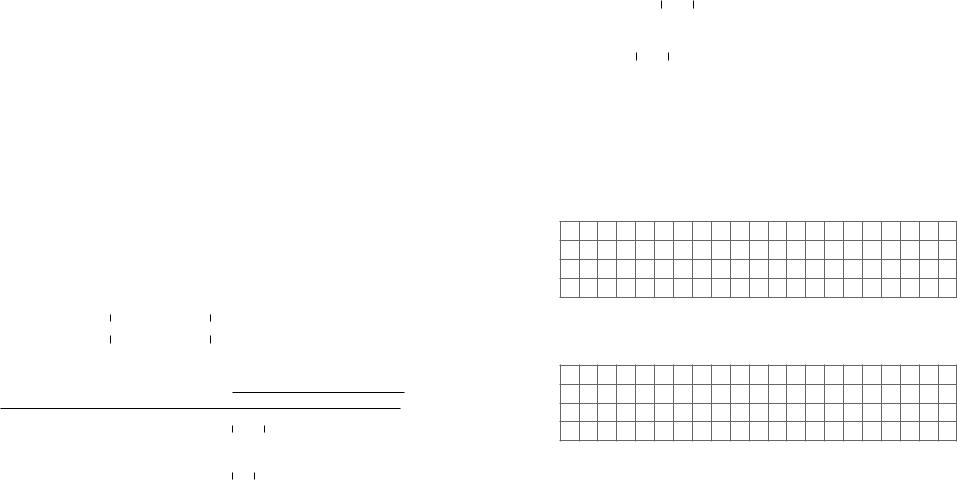
Заповніть таблиці.
Будова молекул ациклічних вуглеводнів
Особливості |
Алкани |
Алкени |
Алкіни |
|
будови |
||||
|
|
|
Гібридизація атомів С
Вид зв’язку
C − C
Вид зв’язку
C− H
18 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Особливості |
|
|
Алкани |
Алкени |
|
Алкіни |
||
будови |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентні кути |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Просторова фор |
|
|
|
|
|
|
|
|
ма молекул |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Будова молекул циклічних вуглеводнів |
|
||||||
|
|
|
|
|
||||
Особливості будови |
|
Циклоалкани |
|
Арени |
||||
|
|
|
|
|
|
|
||
Гібридизація атомів С |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
Вид зв’язку C − C |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
Вид зв’язку C− H |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Валентні кути |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Просторова форма |
|
|
|
|
|
|
||
молекул |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Типи хімічних реакцій у органічній хімії
1.Заміщення
−C− A + B− D → −C− B+ A − D
Механізм: розрив |
|
зв’язку у вихідній речовині й утво |
||
рення нового |
|
|
|
зв’язку в продукті реакції. |
Характерні для класів вуглеводнів:
.
2.Приєднання −CH = CH− +A − B → −CH− CH−
A B
−C ≡ C− +A − B → −C = C−
|
|
|
|
A |
B |
|||||
|
|
|
|
A |
|
B |
||||
|
|
|
|
|
||||||
|
−C ≡ C− +2A − B → −C |
|
C− |
|||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
A |
|
B |
||||
Механізм: розрив |
|
зв’язку у вихідній речовині й утво |
||||||||
рення нових |
|
|
|
зв’язків у продукті реакції. |
||||||
Характерні для класів вуглеводнів: |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
. |
||
Теоретична частина |
19 |
|
|
3.Відщеплення
−CH− CH− → −CH = CH− +A − B
AB
−CH− CH− +CD → −CH = CH− +AC+ BD
A B |
|
|
|
|||
Механізм: розрив |
|
зв’язку у вихідній речовині |
||||
й утворення нових |
|
|
зв’язків у продукті реакції. |
|||
Характерні для вуглеводнів: |
|
|
|
|||
|
|
|
|
|
. |
|
Алкани
Загальна формула
Гомологічний ряд CH4, C2H6, |
|
, |
|
. |
|
|
Види ізомерії
Номенклатура
Суфікс у назві |
|
|
|
. |
|
Нумерація головного ланцюга починається з того кінця, де |
|||||
ближче |
|
|
й більше |
|
. |
Будова
Гібридизація атома С |
|
|
|
. |
||||
Валентний кут: |
|
|
|
|
. |
|||
Типи зв’язків C− C |
|
|
C− H |
. |
|
|||
Довжина зв’язку |
|
|
|
|
|
. |
||
|
|
|
|
|
|
|
|
|
