
Опорні конспекти та дидактичні матеріали з органічної хімії
.pdf
40 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
Одержання
1.3CH ≡ CH →
2. |
|
→ |
|
|
|
+3H2 |
|
3. |
|
Pt,t ° |
|
|
|
|
+4H2 |
CH3 − (CH2 )4 − CH3 |
→ |
||||||
|
|
|
|
Cr2O3, Al2O3, t° |
|
|
|
Застосування бензену
1.Бензен є вихідною речовиною для синтезу дуже багатьох орга нічних сполук.
2.Реакцією нітрування одержують нітробензен C6H5NO2, хло руванням бензену — хлорбензен C6H5Cl (розчинник) та інші хлорпохідні.
3.Бензен використовують як вихідний продукт під час синтезу лікарських і пахучих речовин, різноманітних барвників, моно мерів для синтезу високомолекулярних сполук і т. д.
4.Його застосовують також як розчинник і добавку до моторного палива з метою поліпшення його властивостей.
5.Хлорпохідні бензену та інших вуглеводнів використовують у сільському господарстві як хімічні засоби захисту рослин.
Так, продукт заміщення в бензені атомів Гідрогену Хлором — гексахлорбензен C6Cl6 — застосовують для сухого протравляння насіння пшениці й жита проти твердої сажки.
Із галогенопохідних інших вуглеводнів можна назвати гекса хлорбутадієн C4Cl6, аналогічний за будовою бутадієну-1,3, необ хідний для боротьби з філоксерою на виноградниках.
У сільському господарстві використовують багато отрутохімі катів для боротьби з комахами.
Також бензен використовують для знищення бур’янів, захис ту рослин від хвороб і т. д.
Застосування отрутохімікатів вимагає гарного знання їхніх властивостей і суворого дотримання встановлених правил їх вико ристання, тому що в разі неправильного поводження вони небез печні для людини й можуть завдати великої шкоди природі.
Теоретична частина |
41 |
|
|
Природні джерела вуглеводнів
Природні джерела вуглеводнів
Нафта |
Природний |
Вугілля |
|
|
|
|
газ |
|
Нафта
Фізичні властивості
Агрегатний стан: в’язка масляниста рідина. Колір: від світло-бурого до чорного. Густина: коливається від 0,65 до 1,05 г/см3.
t°кип — від 280 °С |
У воді не розчинна |
Хімічний склад
yyКарбон (84–87 %) yyГідроген (12–14 %)
yyОксиген, Нітроген, Сульфур (1–2 %, іноді до 3–5 %)
Головні групи вуглеводнів: yyметанові (насичені); yyнафтенові (алкени); yyароматичні.
Класифікація нафти
1.За вмістом сірки.
2.За потенційним умістом фракцій, які википають до 3500 °С.
3.За потенційним умістом олій.
4.За якістю олій.

42Опорні конспекти та дидактичні матеріали з органічної хімії
Первинна переробка нафти — перегонка
Нафтова фракція |
Кількість атомів |
Інтервал |
|
Карбону в молекулі |
температур, °С |
||
|
|||
|
|
|
|
Гази |
C1 − C4 |
|
|
|
|
|
|
Бензин |
C5 − C12 |
40–80 |
|
|
|
|
|
Лігроїн |
C12 − C18 |
|
|
Гас |
C16 − C20 |
180–240 |
|
Газойль |
C18 − C25 |
240–260 |
|
Мазут |
Залишок перегонки |
|
|
|
|
|
Нафта надходить у ректифікаційні колони, де розподіляється на кілька фракцій відповідно до температур кипіння.
Якість одержуваних фракцій не відповідає вимогам, що вису вають до товарних нафтопродуктів, тому фракції піддають подаль шій (вторинній) переробці.
Схема ректифікаційної колони
Гази
Це метан, етан, пропан і бутан.
20 °С
Бензин
20–70 °С
70–160 °С
160–250 °С
250–350 °С
Піч 400 °С
Застосовують як пальне для автомобілів, а також як сировину в органічному син тезі.
Лігроїн
З нього отримують пальне для автомобілів і різноманітні хімічні речовини.
Гас
Використовують як пальне для літаків і паливо для печей.
Газойль
Використовують як дизельне пальне й па ливо для печей.
Гудрон
Після подальшої переробки з нього отримують пальне, мазут, парафін, мастила й асфальт.
Ректифікаційна колона
Теоретична частина |
43 |
|
|
Вторинна переробка нафти
Мета — збільшення кількості продуктів переробки: бензину, гасу і т. д.
За своїми напрямками всі вторинні процеси можна розділити на три види:
yyкрекінг — розщеплення молекул важких вуглеводнів; yyриформінг (сировина — бензин) — збагачення бензинової
фракції ароматичними сполуками, при цьому октанове число бензину підвищується до 85.
|
Продукти переробки нафти та їх застосування |
|
|
|
|
Гази |
|
Паливо |
|
|
|
Бензин |
|
Пальне для двигунів внутрішнього згоряння |
|
|
|
Гас |
|
Дизельне й реактивне пальне |
|
|
|
Газойль |
|
Дизельне пальне й котельне паливо |
|
|
|
Мазут |
|
Переробляють на мастильні засоби, котельне паливо, |
|
|
вазелін, гудрон |
|
|
|
Природний газ
У земних надрах газ перебуває:
yyу газоподібному стані — у вигляді окремих скупчень (газові по клади);
yyу розчиненому стані в нафті.
Хімічний склад
Вуглеводні |
Невуглеводневі речовини |
|
|
|
|
Метан — від 92 до 98 % |
Водень (H2 ) |
(H2S) |
Етан, пропан, бутан |
Гідроген сульфід |
|
|
Карбон(IV) оксид |
(CO2 ) |
|
Азот (N2 ) |
|
|
Гелій (Не) |
|
|
|
|
Фізичні властивості за нормальних умов
yyНе має кольору й запаху (щоби можна було визначити витік за запахом, у газ додають етилмеркаптан (16 г на 1000 куб. м при родного газу)).
yyГустина:
від 0,68 до 0,85 кг/м3 відносно повітря (сухий газоподібний); 400 кг/м3 (рідкий).
yyТемпература самозаймання: 650 °C.

44 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
yyВибухонебезпечні концентрації суміші газу з повітрям — від 5 до 15 % (за об’ємом).
yyЛегше за повітря в 1,8 раза, тому у випадку витоку не збираєть ся в низинах, а піднімається нагору.
Транспортування природного газу
На сьогодні основним видом транспорту є трубопровідний.
Вугілля
Це вид викопного палива, що утворився із частин давніх рос лин під землею без доступу кисню.
Види вугілля
yyАнтрацит — містить 95 % Карбону. Характеризується великою густиною й блиском. Застосовують як тверде висококалорійне паливо (теплотворність становить 6800–8350 ккал/кг).
yyКам’яне вугілля — вміст Карбону становить від 75 до 95 %. Ви користовують як паливо й у хімічній промисловості.
yyБуре вугілля — містить 65–70 % Карбону. Використовують як паливо, а також як хімічну сировину.
Видобуток вугілля
yyВідкритим способом у вугільних розрізах, якщо глибина заля гання вугільного шару не перевищує 100 метрів.
yyДля видобування вугілля з великих глибин використовують шахти.
Оксигеновмісні органічні сполуки
Спирти
CxHy (OH)z
|
Феноли |
|
|
|
|
|
|
|
|
CxHy (OH) |
|
|
|
|
|
|
|
|
|
|
|
Вуглеводи |
||||
|
z |
|
|
|
|
|||
|
|
Загальна |
Cn (H2O) |
|||||
|
|
|||||||
|
Альдегіди |
формула |
|
m |
||||
|
|
|
|
|||||
|
CxHyCOH |
CxHyOz |
|
Прості ефіри |
|
|||
|
|
|
||||||
|
|
|
|
|||||
|
|
|
|
|
|
(етери) |
|
|
|
Карбонові кислоти |
|
|
|
||||
|
|
|
|
|
|
|
||
|
|
Складні ефіри |
|
|
||||
|
|
|
||||||
|
CxHyCOOH |
|
|
|
||||
|
|
|
|
(естери) |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теоретична частина |
45 |
||
|
|
|
|
|
|
Спирти |
|
|
|
|
|
|
|
|
|
|
|
Функціональна група — група атомів, |
|
|
Загальна |
|
яка визначає властивості речовин пев |
|
|
|
ного класу. |
||
|
формула |
|
Вуглеводневий радикал — частинка |
|
|
R− OH |
|
||
|
|
|
|
|
Класифікація спиртів
1.За вуглеводневим радикалом
CnH2n+1OH — насичені (алканоли) |
|
|
CnH2n 1OH — ненасичені (алкеноли) |
|
|
CnH2n 3OH — ненасичені ( |
|
) |
|
||
−R− OH ароматичні |
|
|
– OH феноли |
|
|
2.За кількістю груп ОН R− OH одноатомні
R(OH)2
R(OH)3
3.За назвою атома Карбону, з’єднаного з групою OH CH3 − OH — первинні
−CH2 − OH −
−CH− OH−
Насичені одноатомні спирти
Загальна формула
Ізомерія
1.
2.За положенням групи ОН

46 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|||
|
|
|
|
|
|
Номенклатура |
|
|
|
|
Нумерація головного карбонового ланцюга — |
|
||
|
За ІЮПАК: назва вуглеводню + |
|
— локант групи ОН |
|
Назвіть спирти:
CH3OH —
C2H5OH —
Скласти ізомери й дати їм назви за номенклатурою ІЮПАК для речовини, формула якої C4H9OH.
Фізичні властивості
C1 − C12 — рідини. |
C13 − |
Характерний запах |
t°кип |
У воді |
Вплив на організм людини |
|
|
Будова спиртів
Будова молекули спирту
δ+ |
δ- |
||
R |
|
O |
|
|
|||
110° |
δ+ |
||
H |
|||
|
|
||
Водневі зв’язки між молекулами спирту
RR
δ+ |
|
δ- |
|
δ+ |
|
δ- |
|
O δ+ |
|
O δ+ |
|
||||
H |
|
H |
δ- |
H |
|
H |
δ- |
|
|
|
O |
|
|
|
O |
RR
За збільшення довжини R швидкість розриву зв’язку O− H
|
|
, |
реакційна активність спиртів |
|
. |
Теоретична частина |
47 |
|
|
Хімічні властивості
1.Горіння
CH3OH + O2 →
2.Амфотерні властивості (властивості за участі функціональної групи)
CH3OH + Na →
CH3OH + HCl →
3.Дегідратація
yyВнутрішньомолекулярна
CH3 − CH2 |
− OH → |
|
|
|
|
|
|
|
|
|
|
(t > 140 °С) |
|||||||||||
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
yyМіжмолекулярна
CH3 −CH2 −OH + CH3 −CH2 −OH H2SO4→
(t > 140 °С)
Етер (простий ефір)
4. Якісна реакція
|
|
|
CH3OH + CuO → H − C = O + Cu ↓ + H2O |
|||||||||||||||||
|
|
|
|
|
|
чорний |
|
|
червоний |
|||||||||||
|
|
|
|
|
|
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

48 Опорні конспекти та дидактичні матеріали з органічної хімії
5. Реакція естерифікації
O O
R1 − С − OH + HO − R2 R1 − С − O − R2 + H2O
естер (складний ефiр)
Одержання
Промислові методи
1.CO + H2 t, p, k→CH3OH
2.CH2 = CH2 + H2O →
3.R − C = O + H2 →
H
Лабораторні методи
1.C6H12O6 →2C2H5OH +2CO2
2.R − Cl + NaOH →
Застосування
yyПродукти для органічних синтезів; yyзастосування як палива; yyвиробництво розчинників;
yyвиробництво синтетичних мийних засобів, парфумерії та кос метики;
yyвикористання в харчовій і фармацевтичній промисловості.
Написати рівняння реакцій узаємодії етанолу з такою речови
ною: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
а) |
літієм; |
б) хлоридною кислотою; |
||||||||||||||||||
в) |
киснем; |
г) купрум(II) оксидом. |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теоретична частина |
49 |
|
|
Насичені багатоатомні спирти
Загальна формула
Номенклатура
1.Назва вуглеводню + … +… — локанти груп ОН
2.Тривіальні назви
Ізомерія
Основні представники
CH2 − CH − CH2
гліцерин
OH OH OH
CH2 − CH2
етиленгліколь
OH OH
 Дати назви формулам і скласти формули за назвами: OH CH3 OH
Дати назви формулам і скласти формули за назвами: OH CH3 OH
а) CH2 − CH − CH2
б) 2,3-диметилбутандіол-1,2
Фізичні властивості
Характеристики |
Гліцерин |
Етиленгліколь |
|
|
|
Агрегатний стан |
В’язка рідина |
Злегка в’язка рідина |
|
|
|
Колір, запах, смак |
—, —, солодкий |
—, —, солодкий |
|
|
|
t°пл., t°кип. |
18 °С, 290 °С |
–13 °С, 197 °С |

50 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
||
|
|
|
|
|
|
|
|
Характеристики |
Гліцерин |
Етиленгліколь |
|
|
|
|
|
У воді |
|
Розчинний |
Розчинний |
|
|
|
(гігроскопічний) |
|
|
|
|
Для людини |
|
Не небезпечний |
Токсичний |
|
|
|
|
Хімічні властивості
1.Спільні з одноатомними спиртами
|
|
CH2 |
− |
CH − |
CH2 |
+3Na → |
|
|
+ |
|
|
|
|
|
|
|
|
(натрій тригліцерат) |
|
OH |
OH OH |
|
|
||||||
|
|
|
|
||||||
|
|
CH2 |
− |
CH − |
CH2 |
+3HCl → |
|
|
+ |
|
|
|
|
|
|
|
|
1,2,3-трихлорпропан |
|
OH |
OH OH |
|
|
||||||
2.Якісна реакція
|
CH2 |
− |
CH − |
CH2 + Cu(OH)2 |
→ |
|
|||
(темно-фіолетовий розчин) |
|||||||||
|
|
|
|
|
голубий осад |
|
|
||
OH |
OH OH |
|
|
||||||
|
|
|
|
||||||
3. Нітрування |
|
|
|
|
|||||
|
CH2 |
− |
CH − |
CH2 + HNO3 → |
|
|
|
||
|
|
|
|
|
|
|
|
(тринітрогліцерин) |
|
OH |
OH OH |
|
|
|
|||||
|
|
|
|
||||||
Одержання
1.CH2 = CH2 + H2O кип’ятiння з KMnO4→
2.CH2 − CH − CH2 + NaOH водний розчин→
Сl Сl Сl
3.CH2 = CH2 − CH3 + H2O кип’ятiння з KMnO4→ _
Застосування
Етиленгліколь
yyЯк компонент автомобільних антифризів і гальмових рідин; yyу виробництві полімерів;
yyяк розчинник;
yyв органічному синтезі; yyдля поглинання води.
Гліцерин
yyХарчова промисловість; yyмедицина;
Теоретична частина |
51 |
|
|
yyвиробництво мийних і косметичних засобів; yyтекстильна, паперова й шкіряна галузі промисловості; yyвиробництво пластмас;
yyлакофарбова промисловість.
Тринітрогліцерин
yyВ 1 %-му спиртовому розчині — для купірування гострих нападів спазмів коронарних судин;
yyодержання динаміту (вибухотехніка).
Феноли
Загальна формула
Ізомерія
Номенклатура
1.Назва радикала + фенол.
2.Тривіальні назви:
орто-крезол |
; |
|
|
|
|
мета-крезол |
; |
|
пара-крезол |
|
. |
Скласти ізомери й дати їм назви за номенклатурою ІЮПАК для формули C8H9OH.

52 Опорні конспекти та дидактичні матеріали з органічної хімії
Фенол
Молекулярна формула |
. |
|||||||||||||||||||||
Структурна формула |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фізичні властивості
Агрегатний стан — рідина |
|
Колір — |
|
|
|||||||
t°пл |
|
|
|
t°кип |
|
|
|
|
|||
У холодній воді |
, Запах — різкий |
|
|
||||||||
у гарячій воді розчинний |
|
Під час зберігання рожевіє |
|||||||||
|
|
|
|
|
|||||||
Дія на організм людини |
|
|
|
|
|
|
|
|
|||
Знищує мікроорганізми (антисептик) |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||
Взаємовплив груп атомів у молекулі фенолу |
|
|
|||||||||
|
|
|
|
|
|
|
|
δ+ |
|
|
|
|
|
|
δ- |
|
O |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
δ- |
δ- |
|
|
|
|
||||
Бензенове кільце взаємодіє з електронами атома О, роблячи |
|||||||||||
зв’язок O− H більш |
|
|
|
|
|
|
|
|
. |
||
Можливість відділення атома Н від атома О |
|
|
. |
||||||||
Зростає |
|
|
|
|
|
|
|
|
. |
||
Електрони атома О, притягаючись до бензенового |
кільця, |
||||||||||
____________________________ його електронну густину, у ре
зультаті положення 2,4,6, стають |
|
. |
||||||
Хімічні властивості |
|
|||||||
1. За групою OН |
|
|||||||
−OH + Na → |
___________________ |
+ |
|
|
|
|||
|
|
(натрій фенолят) |
|
|||||
−OH + NaOH → _________________ + |
|
|||||||
|
|
|
|
|
|
|
|
|
Теоретична частина |
53 |
|
|
2. За бензеновим кільцем
 −OH +3Br2 → 3HBr +
−OH +3Br2 → 3HBr +
(2,4,6-трибромфенол, білий осад)
 −OH+3HNO3 → ______________ +
−OH+3HNO3 → ______________ +
(тринітрофенол)
3. Якісна реакція
 −OH + FeCl3 →
−OH + FeCl3 →
(темно-фіолетове забарвлення)
Застосування
У виробництві: yyполімерів; yyлікарських препаратів; yyбарвників;
yyповерхнево-активних речовин; yyантисептиків;
yyвибухових речовин.
Одержання
1. +Cl2 →
+Cl2 →
_________ +NaOH →
2.Кумольний метод
+CH2 = CH − CH3 → |
|
|
|
(кумол) |
|
|
|
||
[ ] |
|
|
||
|
|
O , H2O |
|
|
______________________ → |
|
|||
|
|
|
|
|
3. 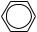 +H2O2 →
+H2O2 →
Альдегіди
Загальна |
CnH2n+1 — |
|
|
|||||
|
|
|||||||
формула |
|
|
|
|
|
|||
|
|
|
O |
|||||
CnH2n+1CHO |
|
|
|
|
|
— карбонільна група |
||
|
C |
|||||||
|
||||||||
(CnH2nO) |
|
|
|
H |
|
|||
|
|
|
|
|
|
|
група альдегідів |
|
(натрій фенолят)

54 |
|
Опорні конспекти та дидактичні матеріали з органічної хімії |
|||||
|
|
|
|
|
|
|
|
|
Номенклатура |
|
|
|
|
||
|
Нумерація головного карбонового ланцюга — з атома C функ |
||||||
ціональної групи. |
|
|
|
|
|||
|
Назва вуглеводню + |
. |
|||||
|
Тривіальні назви |
|
|
|
|
||
|
НСОН — |
|
мурашиний альдегід, або формальдегід. |
||||
|
|
|
|
|
|
|
|
|
CH3COH — |
|
|
|
оцтовий альдегід, або ацетальдегід. |
||
|
|
|
|
||||
Ізомерія
Будова |
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
R |
|
C |
|||
|
|
|
|||||
|
|
|
|
OH |
|||
Гібридизація C |
. |
||||||
|
|
|
|
|
|
|
|
Види зв’язків: |
|
|
|
|
. |
||
Валентний кут: |
. |
||||||
|
|
|
|
|
|
|
|
Скласти ізомери й дати їм назви за номенклатурою ІЮПАК для формули C5H10O.
Фізичні властивості
НСНО — газ із характерним запахом, розчинний у воді, 40 %-й розчин у воді — формалін. Токсичний.
CH3CHO — рідина з характерним запахом, розчинна у воді, токсична.
Теоретична частина |
55 |
|
|
Хімічні властивості
1.Реакції відновлення (розрив зв’язку C = O)
R −C = O+ H2 t, p, k→R −CH2 −OH
H
2.Реакції окиснення (розрив зв’язку C− H)
Якісні реакції на альдегіди |
O |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
O |
+ 2Cu(OH) t→R − C |
|
|
|
|
|
|
|
|
||||||||
a) R − C |
|
|
+ Cu2O ↓ + 2H2O |
|||||||||||||||||
|
|
|
H |
2 |
|
|
|
OH |
оранжевий |
|||||||||||
|
|
|
голубий осад |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
осад |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) Реакція «срібного дзеркала» |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
O |
|
|
O |
|
|
|
|
|
|
|
|||||||||
|
R −C + Ag2O →R −C |
|
+2Ag ↓ + H2O |
|||||||||||||||||||
|
|
|
|
|
|
|
t, NH4OH |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
H |
|
|
OH |
|
|
|
|
|
|
|
|||||||||
|
|
(AgNO3 + NH4OH → Ag2O + H2O + NH4NO3 ) |
||||||||||||||||||||
2 |
Ag(NH ) |
OH |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Застосування
НСНО:
yyУ виробництві феноло-формальдегідних смол; yyдля синтезу ліків і барвників;
yyдля дублення шкір;
yyяк дезінфікуючий, антисептичний засіб.

56 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
CH3CHO :
yyОдержання оцтової кислоти; yyодержання етилового спирту.
Одержання
1.Лабораторний метод
|
|
|
|
|
|
O |
|
|
|
|
|
t |
+ Cu ↓ +H2O |
|
R −CH2 −OH + CuO →R −C |
|||||
|
|
|
|
|
|
H |
2. Промислові способи |
|
|||||
CH ≡ CH + H2O → |
|
|
|
|||
|
|
|
||||
|
t, p, k |
|
||||
CH4 |
+ O2 → |
|
|
|
|
|
CH2 |
= CH2 + O2 k→ |
|
|
|||
|
|
|||||
|
k |
|
||||
CH3OH + O2 → |
|
|
||||
|
|
|||||
Карбонові кислоти
Загальна |
R — |
|
|
||
формула |
O |
|
|
||
OC — карбоксильна група
R |
|
|
|
|
OH |
|
||||
C |
||||||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
група кислот |
|
Класифікація |
|
|
|
|||||||
|
|
|
|
|||||||
Теоретична частина |
57 |
|
|
Насичені одноосновні карбонові кислоти
Загальна формула
CnH2n+1COOH
(CnH2nO2 )
Номенклатура
Нумераціяголовноголанцюга—затомаCфункціональноїгрупи. Назва вуглеводню + _______________ кислота.
|
Назва за |
Тривіальні |
Формула |
Назва |
|
Формула |
номенклату- |
кислотного |
кислотного |
||
назви |
|||||
|
рою ІЮПАК |
залишку |
залишку |
||
|
|
||||
|
|
|
|
|
|
НСООН |
|
Мурашина |
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
CH3COOH |
|
Етанова |
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
C2H5COOH |
|
Пропіонова |
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
C3H7COOH |
|
Олійна |
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
C4H9COOH |
|
Валеріанова |
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
1. |
За вуглеводневим радикалом |
|
Будова |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
CnH2n+1COOH — насичені |
|
|
|
δ- |
|
|
Найбільш полярний зв’язок |
. |
|
|
CnH2n 1COOH, CnH2n 3COOH — ненасичені |
|
|
δ+ |
O |
|
|
Розрив зв’язку |
|
|
|
−COOH ароматичні |
|
R |
C |
O- |
H+ |
|
спричиняє |
властивості. |
|
|
|
|
|
|
Чим довше R, тим |
|
||||
2. За кількістю груп СООН |
|
|
|
|
|
|
кислотні властивості |
|
||
|
|
O |
H |
O |
|
Між молекулами кислот утворюється |
||||
|
R− COOH одноосновні |
|
|
R |
||||||
|
R(COOH)2 |
R |
C |
O H |
C |
|
зв’язок. |
|||
|
O |
|
Температури кипіння кислот |
|
||||||
3. |
За кількістю атомів Карбону |
|
|
|
|
|||||
|
|
|
|
|
|
температур кипіння відповідних спиртів |
||||
|
C1 − C14 |
— нижчі |
|
|
|
|
|
|
||
|
|
|
0,26 нм |
|
і альдегідів |
|
||||
|
C15 − C18 |
— |
|
|
|
|
|
|
|
|

58 |
Опорні конспекти та дидактичні матеріали з органічної хімії |
|
|
Ізомерія
Скласти ізомери й дати їм назви за номенклатурою ІЮПАК для формули C5H10O2.
Фізичні властивості
yyНСООН — рідина з характерним запахом, t°кип. = 100,8 °C, роз чинна у воді, їдка.
yyCH3COOH — рідина, із запахом, t°кип. = 118,1 °C, розчинна у воді, їдка. 80 %-й розчин — оцтова есенція, 3–9 %-й роз
чин — столовий оцет.
Хімічні властивості
1.Спільні з неорганічними кислотами
RCOOH RCOO− + H+ (змінюють колір індикаторів)
RCOOH + Me(акт.) →
RCOOH + Me2Ox →
RCOOH+ MeOH →
RCOOH + MeCO3 →
Сила кислот (за зменшенням)
HCOOH → CH3COOH → C2H5COOH →
2.Характерні для карбонових кислот Реакція етерифікації
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
||||||||
|
|
R1 |
− C |
+ HO − R2 R1 − C |
|
|
+ H2O |
|||||||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
складний ефiр O – R2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.Галогенування
CH3 −COOH + Cl2 hν→CH2Cl −COOH + HCl
Теоретична частина |
59 |
|
|
Мурашина кислота
Альдегідокислота — біфункціональна сполука (містить дві функціональні групи)
Карбоксильна |
Карбонільна |
|
група |
||
група |
||
|
Якісна реакція
HCOOH + Ag2O →
HCOOH t, H2SO4→H2O + CO
Поширення у природі
НСООН — у хвої ялини, кропиві, фруктах, їдких виділеннях бджіл і мурах.
CH3COOH — є продуктом шумування вина.
C2H5COOH — знайдено в нафті, утворюється під час шумуван ня вуглеводів.
C3H7COOH та її етери містяться у коров’ячій олії й нафті.
Одержання
1.Лабораторні методи
CH3COONa + H2SO4 →t CH3COOH + NaHSO4
RCHO+ Cu(OH)2 →
RCHO+ Ag2O →
2.Промислові методи
RCOH [O]→RCOOH
CH4 + O2 t, p, k→
R −CH2 −OH + O2 t, k→
CO + NaOH t, p→HCOONa + H2SO4 →t HCOOH + NaHSO4
3.Оцтовокисле шумування
C2H5OH бактерiї→CH3 − COOH
Застосування
НСООН — для синтезу естерів, консервування соків. CH3COOH — у харчовій промисловості (харчова добавка E260)
і побутової кулінарії, а також у консервуванні, для одержання лі карських і запашних речовин, як розчинник.
