
Опорні конспекти та дидактичні матеріали з неорганічної хімії
.pdf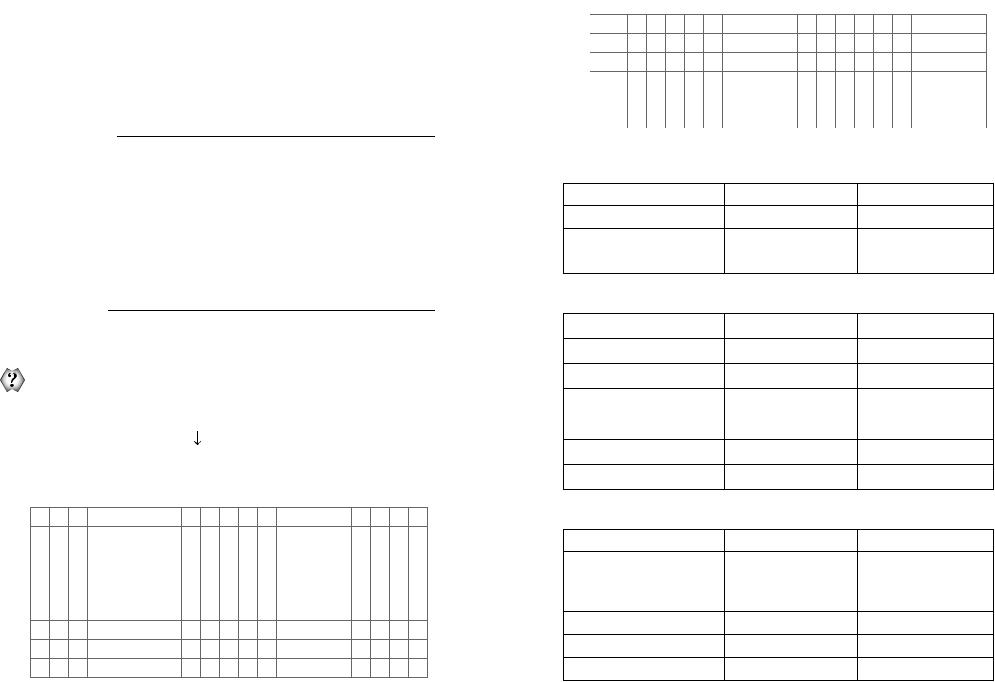
60 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
||||||
|
Гідроксид амонію (нашатирний спирт) NH |
OH |
|||||
|
|
|
|
|
|
4 |
|
|
Гідроксид амонію — існує тільки в розчині у вигляді йонів. Він |
||||||
утворює лужне середовище. |
|
|
|
|
|||
|
NH3 |
+ |
|
|
+ + |
OH |
− |
|
|
H2O NH4OH |
NH4 |
|
|||
Хімічні властивості
NH3 + HCl →
Солі амонію (NH4 )n X
Тверді, без запаху, розчинні у воді
(NH4 )n X nNH4+ + X−n
NH4Cl
NH4X+ Me(OH)n → MeXn + NH3↑ + H2O (якісна реакція)
(NH4 )n X →t nNH3 + HX (для солей слабких кислот)
NH4Cl →t
NH4X + MeX'→ MeX + NH4X'
NH4Cl + AgNO3 →
Напишіть рівняння реакцій для здійснення схеми перетво рень:
Ca3N2 ←1 N2 →2 NH3 →4 NH4OH →5 NH4Cl
3
NO
Для реакції 1 складіть електронний баланс, для реакції 5 — йонні рівняння.
Теоретична частина |
61 |
Оксиди Нітрогену
Характеристика |
Нітроген(II) оксид |
Нітроген(IV) оксид |
Молекулярна формула |
|
|
Назва |
|
|
Тривіальне |
Монооксид Нітрогену |
Діоксид Нітрогену |
Фізичні властивості
Характеристика |
Нітроген(II) оксид |
Нітроген(IV) оксид |
Агрегатний стан (за н. у.) |
Газ |
Газ |
Колір |
Безбарвний |
Бурий |
Запах |
— |
Різкий |
tкип.,°С |
–152 |
20,7 |
tпл,°С |
–163 |
–11,2 |
Токсичність |
Отруйний |
Отруйний |
Хімічні властивості
Реагент |
Нітроген(II) оксид |
Нітроген(IV) оксид |
|
Несолетворний |
Кислотний оксид |
|
оксид |
|
+ O2 |
NO + O2 → NO2 |
— |
+ H2O |
— |
HNO2 + HNO3 |
+ NaOH |
— |
NaNO2 + NaNO3 + H2O |
|
NO + Cl2 → NOCl |
NO2 N2O4 |
62 Опорні конспекти та дидактичні матеріали з неорганічної хімії
Одержання
Нітроген(II) оксид |
Нітроген(IV) оксид |
|
N2 + O2 → NO |
NO + O2 |
→ NO2 |
Cu + HNO3 (p.) → |
Cu + HNO3 |
(конц.) → |
Cu(NO3 ) + NO + H2O |
Cu(NO3 ) + NO2 + H2O |
|
2 |
2 |
|
Застосування |
|
|
Нітроген(II) оксид |
Нітроген(IV) оксид |
|
Проміжний продукт виробництва |
Проміжний продукт виробництва |
|
HNO3 |
HNO3 |
|
Складіть електронний баланс і зрівняйте окисно відновну ре акцію:
Cu + HNO3 (p.) → Cu(NO3 )2 + NO + H2O
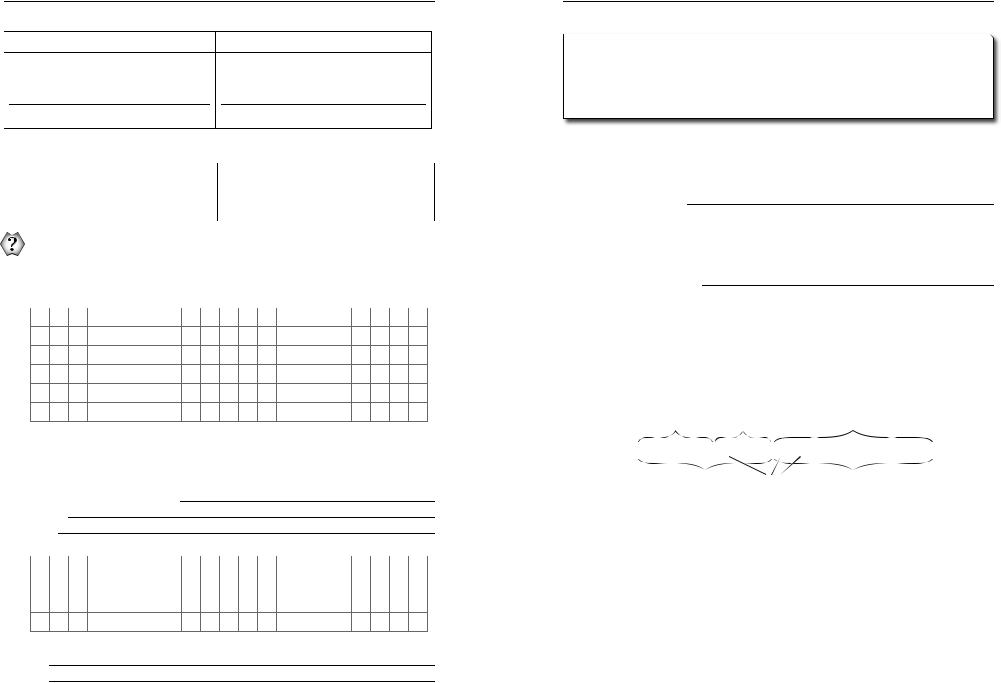
Нітратна (азотна) кислота
Характеристика за формулою
Молекулярна формула
Mr =
M =
Структурна формула
Клас:
1)
2)
Теоретична частина |
63 |
Фізичні властивості |
|
Агрегатний стан за н. у. — рідина |
Колір — жовтіє під час зберігання |
Запах різкий |
У воді розчинна |
Вибухонебезпечна, «димить» |
|
Хімічні властивості
Спільні з іншими кислотами:
1.HNO3 + Me2Ox → Me(NO3 )x + H2O
HNO3 +ZnO →
2.HNO3 + Me(OH)x → Me(NO3 )x + H2O
HNO3 + Ba(OH)2 →
3.HNO3 + MeK → Me(NO3 )x + HK
HNO3 + CaCO3 →
Специфічні:
HNO3 t, свiтло→H2O + NO2 + O2
HNO3 + органiчнi речовини → нiтросполуки
(жовтий колiр)
HNO3 + X → HXO+ NO2 + H2O
HNO3 + Me → Me(NO3 )x + H2O + A
розведена NH3 (NH4NO3 ) |
N2 |
NO |
|
3 |
|
|
|
HNO |
K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au |
||
|
|||
концентрована N2O |
за t |
NO2 |
|
Застосування
Увиробництві нітратних і комбінованих добрив, різних солей, вибухових речовин (тринітротолуену та ін.), органічних барвників.
Уметалургії застосовують для розчинення і травлення мета лів, а також для розподілу золота й срібла.
Ухімічній промисловості, у виробництві вибухових речовин,
увиробництві напівпродуктів для одержання синтетичних барвни ків та інших хімікатів.
Використовують під час нікелювання, гальванізації та хрому вання деталей, а також у поліграфічній промисловості. Широко ви
користовують у електротехнічній промисловості.
64 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Одержання
Лабораторний метод
NaNO3 (тв.) + H2SO4 (конц.) t→NaHSO4 + HNO3↑
Промисловий метод
1.NH3 +O2 t, k, p→NO +H2O
контактний апарат
2.NO + O2 → NO2
окисна вежа
3. NO2 + H2O + O2 → HNO3
поглинальна вежа
Cu + HNO3 (р.) →
Cu + HNO3 (р.) →
Солі нітратної кислоти
Me(NO3 )x — нітрати
Фізичні властивості
Агрегатний стан за н. у.: тверді |
Колір: білий |
У воді добре розчинні
Хімічні властивості
1.Спільні з іншими солями:
Cu(NO3 )2 + Zn →
Cu(NO3 )2 + NaOH →
Ba(NO3 )2 + CuSO4 →
2.Специфічні:
Me(NO2 )x + O2 (Ме до Mg)
Me(NO3 ) |
t |
Me2Ox + NO2 + O2 (Mg–Cu) |
|
x |
|
Me + NO2 + O2 (після Cu)
NH4NO3 →t N2O +H2O
Якісна реакція
Me(NO3 )x + H2SO4 + Cu t→Cu(NO3 )2 + NaHSO4 + NO2↑+ H2O
бурий
газ
Теоретична частина |
65 |
Застосування
Мінеральні добрива, виробництво вибухових речовин, хімічні синтези.
 Здійсніть схему перетворень.
Здійсніть схему перетворень.
N2 →1 NO →2 NO2 →3 HNO3 →4 NaNO3 →5 O2
Для реакції 1 складіть електронний баланс, для реакції 4 — йонні рівняння.
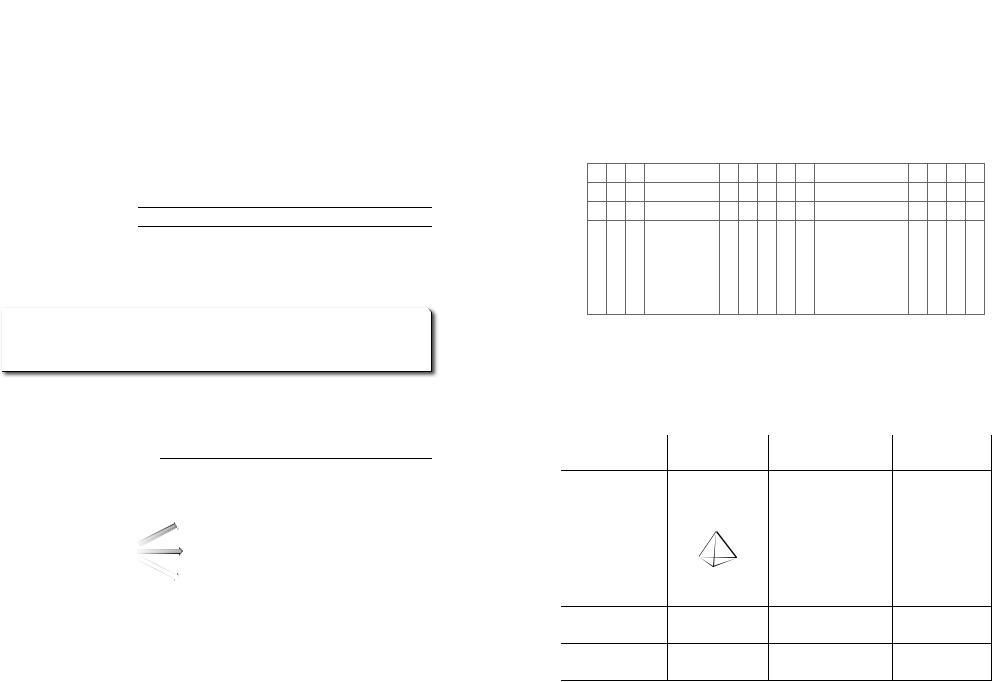
Фосфор
Проста речовина
видозміни Фосфору
Фізичні властивості
Характеристика Білий фосфор Червоний фосфор |
Чорний |
|
фосфор |
||
|
||
Формула |
|
|
Будова, |
|
|
вид зв’язку, вид |
|
|
ґратки |
|
Агрегатний |
Твердий |
Твердий |
Твердий |
стан (за н. у.) |
|
|
|
Колір |
Білий або жов |
Червоний |
Чорний |
|
туватий |
|
|
66 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Теоретична частина |
67 |
||||||
Характеристика |
Білий фосфор |
Червоний фосфор |
Чорний |
Поширення у природі у зв’язаному стані |
|||||
|
|
||||||||
фосфор |
Апатит |
, |
|||||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
Запах |
|
Часнику |
Без запаху |
Без запаху |
У складі білкових сполук у організмі людини: |
||||
tпл |
|
|
44,2 °С |
260 °С — запалю |
490 °С — запа |
тканини мозку — 0,38% |
|
||
|
|
м’язи — 0,27% |
|
||||||
|
|
|
|
ється |
|
люється |
|
||
|
|
|
|
|
|
|
|||
У воді |
Не розчинний |
Не розчинний |
Не розчинний |
Одержання |
|
||||
Специфічні |
|
Отруйний, |
Не світиться |
Напівпровід |
2Ca3 (PO4 )2 +10C + 6SiO2 → 6CaSiO3 + P4 +10CO |
||||
властивості |
|
світиться |
у темряві, не само |
ник |
(сплавлення в електропечі) |
||||
|
|
у темряві, за |
займається, не |
|
|||||
|
|
|
|
|
|||||
|
|
|
палюється на |
отруйний |
|
|
|
||
|
|
|
повітрі |
|
|
|
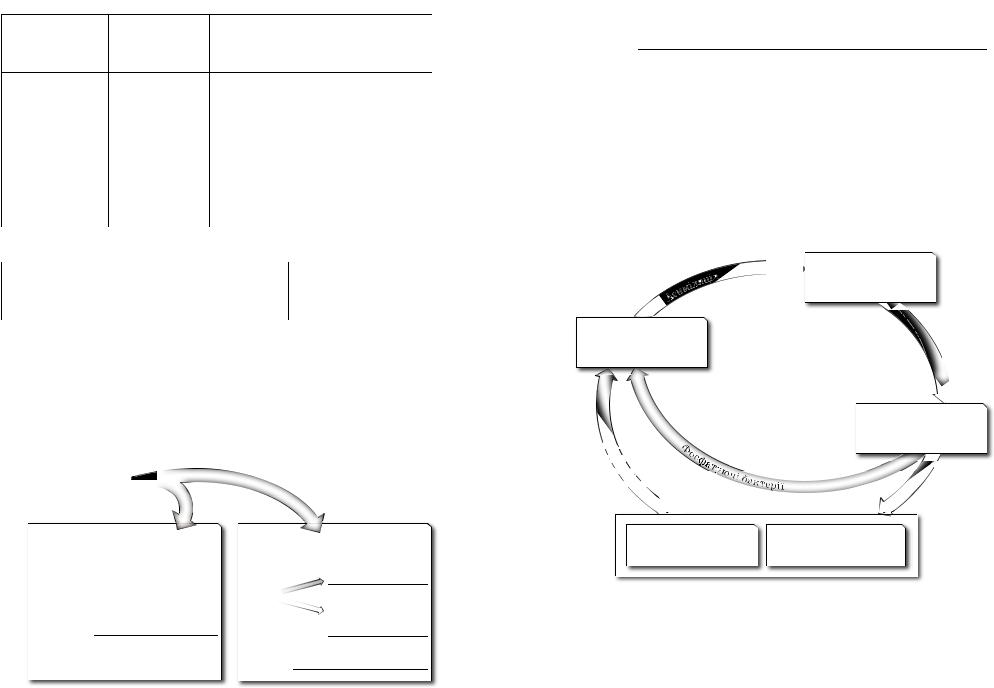
Кругообіг Фосфору в природі |
|
|
|
|
|
|
|
|
|
|
||
|
Застосування |
|
|
|
|
|
|
||
|
Білий фосфор |
|
Червоний фосфор |
Чорний фосфор |
|
Фосфор |
|||
|
Запальні бомби |
Виробництво сірників |
Одержання фосфорор |
|
у організмах |
||||
|
|
|
|||||||
|
|
|
|
|
ганічних препаратів |
|
|
||
|
Поширення у природі |
|
|
|
3– |
Мінералізація |
|||
|
|
|
|
Фосфат іони (PO4) |
органічних |
||||
|
Як проста речовина в природі через свою хімічну активність |
|
|||||||
|
|
речовин |
|||||||
він не трапляється. |
|
|
|
|
|||||
|
|
|
|
|
|||||
|
Взаємоперетворення |
|
|
|
|
|
|||
|
|
|
t |
t |
|
|
|
Фосфати |
|
|
Р (білий) → Р (червоний) → Р (чорний) |
|
|||||||
|
|
|
|
|
|
|
Вивільнення |
|
|
|
|
|
|
|
|
|
людиною |
|
|
|
Хімічні властив |
|
|
|
(добрива), |
|
|||
|
|
|
|
винос тваринами |
Водні |
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
екосистеми |
|
|
Окисні |
|
Відновні |
Органічні рештки |
Осади |
||||
|
|
(ґрунт, літосфера) |
|||||||
|
P0 +3e → P−3 |
|
|
|
|
||||
|
|
|
|
|
|
||||
P +Me →Me3Px |
P + O2 |
|
t |
P + Ca → |
|
|
Основні сполуки |
P + Na → |
|
|
Фосфор(V) оксид |
|
P + Cl2 |
→ |
|
|
Характеристика за формулою |
||
|
P + S → |
||
Молекулярна формула

68 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Структурна формула, тип зв’язку
Фізичні властивості
Агрегатний стан за н. у. ________ Колір _____________
У воді гігроскопічний
Хімічні властивості
оксид.
P2O5 + H2O → P2O5 + H2O →t
P2O5 + NaOH →
P2O5 + CaO →
Застосування
Ортофосфатна (фосфатна) кислота
Характеристика за формулою
Молекулярна формула Структурна формула
Mr =
M =
Клас:
Хімічні властивості
Дисоціація:
1 й ступінь: H3PO4 H+ + H2PO4− (α = 7,5 10−3 ) 2 й ступінь: H2PO4− H+ + ___ (α = 6,2 10−8 )
3 й ступінь: ___ ___ +PO34− (α = 5,0 10−13 )
H3PO4 + Me →
H3PO4 + Me2Ox →
Теоретична частина |
69 |
H3PO4 + Me(OH)x →
H3PO4 + Me(OH)x →
H3PO4 + Me(OH)x →
якісна реакція
H3PO4 + AgNO3 → Ag3PO4↓ +
жовтий
H3PO4 → H2P2O7 → HPO3 + H2O
Фізичні властивості
Агрегатний стан — твердий |
Колір — білий |
Запах — без запаху |
tпл. = 42,4 °С |
tкип. = 213 °С |
У воді добре розчинна |
Одержання
1)P2O5 +
2)Ca3 (PO4 )2 + H2SO4 →
3)P + HNO3 + H2O → H3PO4 + NO
Застосування
Солі ортофосфатної кислоти
Me(H2PO4 )x — дигідрогенортофосфати
Me2 (HPO4 )x —
Me3 (PO4 )x — ортофосфати
Хімічні властивості
1) Ca3 (PO4 )2 + H2SO4 →
2) Na3PO4 + Ba(OH)2 →
3) Na3PO4 + CaCl2 →
якісна реакція
MePO4 + AgNO3 → Ag3PO4↓ +
(жовтий)
Застосування: мінеральні добрива.
70 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
 Напишіть рівняння реакцій для здійснення схеми перетворень.
Напишіть рівняння реакцій для здійснення схеми перетворень.
PH3 ←P →P2O5 →H3PO4 →K3PO4 → Ag3PO4
NaH2PO4
Мінеральні добрива
Поживний елемент — хімічний елемент, необхідний для пра вильного росту й розвитку рослин і регулювання стану ґрунту.
yyМакроелементи — використовувані рослинами у значних кіль костях (від часток до декількох відсотків сухої маси). Макро елементи: Нітроген (N), Сульфур (S), Фосфор (Р), Калій (К), Магній (Mg), Кальцій (Са), Ферум (Fe).
yyМікроелементи — необхідні в незначних кількостях.
До мікроелементів належать Бор, Молібден, Купрум, Кобальт, Цинк, Ферум.
Добрива — речовини, які містять поживні елементи й застосо вуються для поліпшення харчування рослин, властивостей ґрунту, підвищення врожаїв.
yyПрості — до складу яких входить один поживний елемент. yyСкладні — містять два, три й більше поживні елементи.
Мінеральні добрива діляться також на групи за вмістом еле ментів:
yyНітратні — містять як основний поживний елемент Нітроген. Рідкий NH3, амоніакова вода, сульфати амонію (NH4 )2 SO4, амоніакова селітра 2NH4NO3, натрієва (NaNO3 ) й кальцієва Ca(NO3 )2 селітри, карбамід (сечовина) CO(NH2 )2 .
Теоретична частина |
71 |
yyКалійні — містять як основний поживний елемент Калій. До помагають рослинам засвоювати CO2, а також сприяють пере суванню вуглеводнів і підвищують стійкість до морозів, по сухи. Найпоширенішими є калій хлорид KCl, калій гідроген сульфат KHSO4.
yyФосфатні — містять як основний поживний елемент Фосфор. Підвищують стійкість культур до морозів і посух. Їх треба вно сити в ґрунт якнайглибше, тому що Фосфор малорухомий.
Назва добрива |
Формула |
Простий суперфосфат |
Ca(H2PO4 )2 + CaSO4 |
Подвійний суперфосфат |
Ca(H2PO4 )2 |
Преципітат |
CaHPO4 2H2O |
Кісткове борошно |
Ca3 (PO4 )2 |
yyМікродобрива — допомагають боротися із хворобами рослин, необхідні для нормального росту й розвитку рослин. Вносити їх потрібно в дуже малій кількості. Найпоширенішими є борні й марганцеві добрива, а також залізний купорос.
yyОрганічні добрива — збагачують ґрунт легкорозчинними по живними речовинами й перегноєм, поліпшують його фізичні властивості та структуру, а також активізують життєдіяль ність потрібних мікроорганізмів.
yyБактеріальні добрива — це препарати, які містять культуру мі кроорганізмів, що сприяють поліпшенню харчування рослин. Поживних речовин вони не містять.
ПІДГРУПА КАРБОНУ (IV головна підгрупа)
 Укажіть правильну відповідь для елементів IVА підгрупи.
Укажіть правильну відповідь для елементів IVА підгрупи.
1.Кількість зовнішніх електронів у атомах цих елементів: а) 3; б) 4; в) 5.
2.Характерні ступені окиснення: а) +1, +2, +3, +4, –1, –2, –3, –4; б) +2, +4, –1, –2, –3, –4; в) +2, +4, –4.
72 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
3.Формули можливих оксидів:
а) E2O3;
б) ЕО;
в) E2O5;
г) EO2.
4.Формули можливих гідроксидів: а) E(OH)2 ;
б) HEO2; в) E(OH)3 ;
г) H2EO3.
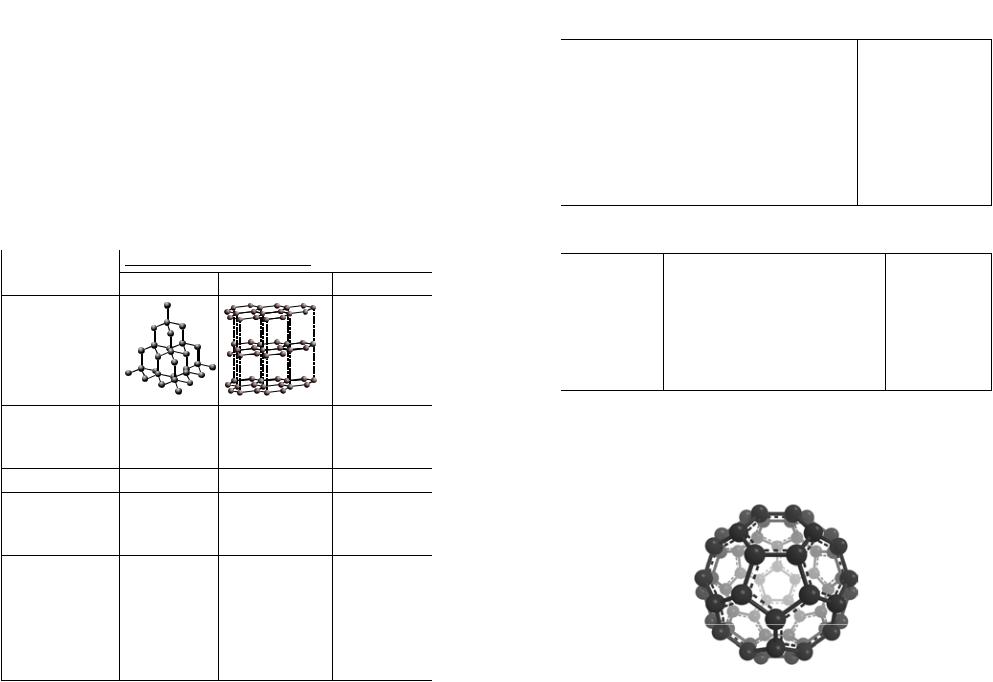
Карбон (проста речовина вуглець)
Фізичні властивості
|
|
видозміни Карбону |
Алмаз |
Графіт |
Карбін |
Структура й вид ґратки
C ≡ C − C ≡ C
Агрегатний стан |
Тверді крис |
Тверді кристали |
Твердий по |
|
тали |
|
рошок |
Колір |
Безбарвний |
Темно сірий |
Чорний |
Густина, г/см3 |
3,5 |
2,1–2,5 |
1,9–2 |
Твердість |
Максимальна |
М’який |
— |
Електропровід |
— |
Проводить струм |
Напівпровід |
ність |
|
|
ник |
Теплопровідність |
— |
Проводить тепло |
— |
Температура |
3700–4000 °C |
За pатм., |
|
плавлення |
|
|
|
|
t > 2000 °C |
|
|
|
|
возгоняється |
|
|
|
в безкисневому |
|
|
|
середовищі, |
|
|
|
3850 ± 50 °С |
|
Теоретична частина |
73 |
Застосування
Алмаз |
Графіт |
Карбін |
У ювелірній промис |
У металургії. У реакто |
У фотоелементах, |
ловості. Для виготов |
рах, як сповільнювач |
у електроніці, кос |
лення спеціального |
нейтронів. Як кон |
монавтиці, авіації |
інструмента для об |
струкційний матеріал. |
й медицині |
робної промисловості. |
Як наповнювач пласт |
|
Алмазні порошки |
мас, компонент спо |
|
використовують |
лук для виготовлення |
|
у пилках, бурових |
стрижнів для олівців, |
|
коронках, напилках |
під час одержання |
|
і як абразив |
алмазів |
|
Поширення у природі
Алмаз |
Графіт |
Карбін |
У родовищах |
У вигляді дрібно й тонколускатих |
У вигляді мі |
(кімберлітові |
агрегатів у суміші з іншими |
нералу чаоїту |
трубки) |
мінералами — слюдами, квар |
(білі прожилки |
|
цом, амфіболами. Вміст графіту |
та вкраплен |
|
в кристалічних сланцях становить |
ня у графіті) |
|
3–20%, у магматичних гірських |
і отриманий |
|
породах — 3–50%, у вугіллі— |
штучно |
|
60–85% |
|
Переходи алотропних модифікацій
Алмаз → 2000–3000 °С без доступу повітря → графіт графіт → t > 2000 °C, р = 130 000 атм > алмаз
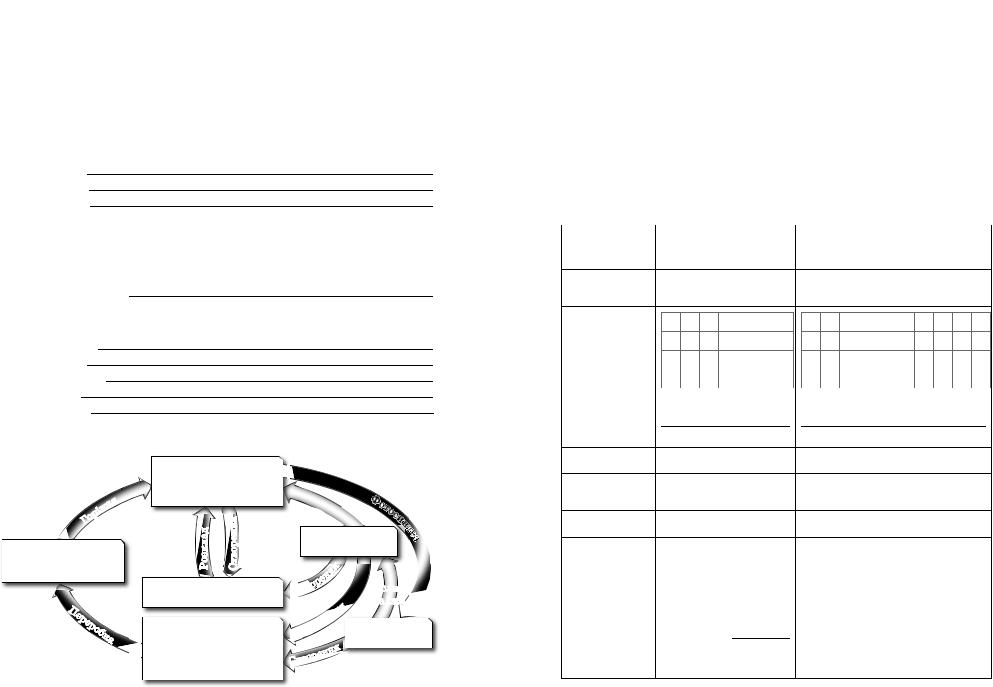
Фулерен C60
74 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Галузі застосування: створення наноматеріалів, оптичні за твори, як матеріал для напівпровідникової техніки, для створення нових ліків, як добавки у вогнезахисні фарби, для виготовлення со нячних елементів та ін.
Хімічні властивості вуглецю
Окисник
C + Me → Me4Cx (карбід)
C + Al →
C + Be →
C + H2 →
3C + CaO → CaC2 + CO
кальцiй
карбiд
Відновник
C + O2 (нест.) →
C + Me2Ox → Me + CO
C +ZnO →
C + O2 →
C + неMe →
C + S →
C + Cl2 →
Кругообіг Карбону в природі
Горіння
продукти
нафтоперерорбки
Переробка
CO2 атмосфери
Розклад |
Створення |
Природні карбонати
Вугілля, графіт, нафта та газ
|
|
Дихання |
|
|||||||
|
|
|
|
|
|
Тварини |
||||
|
|
|
|
|
|
|
|
я |
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
н |
|
|
|
||
|
|
|
|
е |
|
|
|
|
||
|
|
|
р |
|
|
|
|
|
||
|
|
о |
|
|
|
|
|
Рослин |
||
|
в |
|
|
|
|
|
|
|
||
Ст |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
я |
на їжа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
н |
|
|
||
|
|
|
|
|
е |
|
|
|
||
|
|
|
|
р |
|
|
|
|
||
|
|
|
о |
|
|
|
|
|
||
|
|
в |
|
|
|
|
|
|
||
|
т |
|
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
|
|
|
|
Рослини |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
я |
|
|
|
|
|
|
|
|
н |
|
|
||
|
|
|
|
|
н |
|
|
|
||
|
|
|
|
е |
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
||
|
о |
|
|
|
|
|
|
|
||
тв |
|
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
|
|
|
|
|
|
Теоретична частина |
75 |
Поширення у природі у зв’язаному стані
Вуглекислий газ — Крейда, мармур, вапняк — Поташ — Нафта, природний газ —
Вуглеводи — (сахароза, целюлоза, крохмаль) Білки —
Основні сполуки Карбону
Оксиди Карбону
|
Карбон(II) оксид |
Карбон(IV) оксид |
|
Формула |
|
|
|
Технічна на |
Чадний газ |
Вуглекислий газ |
|
зва |
|
|
|
Будова, тип |
|
|
|
зв’язку, тип |
|
|
|
ґратки |
|
|
|
Агрегатний |
Газ, |
, Газ, |
, |
стан за н. у., |
|
|
|
колір, запах |
|
|
|
Dповiтря |
|
|
|
Біологічна |
|
|
|
дія |
|
|
|
tкип. |
–191,50 °C |
−78 °C (195 K), возгоняється |
|
|
|
|
|
Застосування |
|
|
|
Хімічні влас |
Несолетворний |
Кислотний оксид, окисник |
|
тивості |
оксид, відновник |
CO2 + C →2CO |
|
|
|
|
|
|
CO + MeO → Me + CO2 |
CO2 + H2O H2CO3 |
|
|
CO + FeO → |
CO2 + Me(OH)x → Me(HCO3 )x |
|
|
|
|
2CO + O2 |
→2CO2 |
CO2 |
+ Me(OH)x |
→ Me2 (CO3 )x + H2O |
|
|
76 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Карбонатна кислота
Характеристика за формулою
Молекулярна формула
Mr = ,
M =
Будова
Клас
1)
2)
Фізичні властивості
Агрегатний стан |
Колір |
Запах |
У воді |
Хімічні властивості
Нестійка, у чистому вигляді не виділена, існує у вигляді йонів у розчині.
CO2 + H2O H2CO3 2H+ + CO23−
H2CO3
H2CO3
H2CO3
H2CO3
Одержання
CO2 + H2O H2CO3
Теоретична частина |
77 |
Солі карбонатної кислоти
Загальна
хімічна
формула  Назва
Назва
Класифіка ція
Основні представни ки
Фізичні
властивості
Хімічні
властивості
 Одержання
Одержання  Застосування
Застосування
Me2 (CO3 )x |
Me(HCO3 )x |
Na2CO3 |
NaHCO3 |
K2CO3 — поташ |
|
CaCO3 |
|
MeCO3 + HX → |
MeHCO3 + HX → |
→ MeX + H2O + CO2 |
→ MeX + H2O + CO2 |
(якісна реакція) |
(якісна реакція) |
CaCO3 + HCl → |
NaHCO3 + HNO3 → |
MeCO3 (н) →t MeO + CO2 |
MeHCO3 t→MeCO3 +CO2 +H2O |
CaCO3 → |
NaHCO3 → |
t |
t |
Na2CO3 → |
Ca(HCO3 ) → |
t |
t |
|
2 |
MeCO3 + H2O + CO2 → MeHCO3
CaCO3 + H2O + CO2 →
 Напишіть рівняння реакцій, із допомогою яких можна здій снити перетворення.
Напишіть рівняння реакцій, із допомогою яких можна здій снити перетворення.
C →1 CO2 →2 BaCO3 →3 Ba(HCO3 )2 4→BaCO3
5
Ba(NO3 )2
Для реакції 1 складіть електронний баланс, для реакції 5 — йонні рівняння реакцій.
Застосування
78 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Силіцій
Фізичні властивості
Агрегатний стан |
Колір |
Запах |
У воді |
tкип. = |
tпл = |
Поширення у природі
Si — другий за поширеністю елемент земної кори (27,6%). У чистому вигляді силіцій у природі не трапляється.
SiO2 — кварц, кремнезем, кремінь, гірський кришталь, гра ніт, польові шпати, сланці (слюди), азбест, тальк, каолініт, сма рагд, топаз, аквамарин.
Хімічні властивості
Окисні
Si + Me → Me4Six
Si + Mg →
Відновні
Si + F2 →
Si + O2 →
Теоретична частина |
79 |
Si + Br2 →
Si + S →
Si + Cl2 →
Si + H2 →
Si + C →
Si +2NaOH + H2O → Na2SiO3 +2H2O
Застосування
yyЯк матеріал для виготовлення напівпровідникових приладів (транзистори, термістори, силові випрямлячі струму, тирис тори; сонячні фотоелементи, використовувані в космічних кораблях).
yyУ металургії.
yyУ скляній, цементній, керамічній, електротехнічній промис ловості.
yyДля роботи сонячних батарей на супутниках, місяцеходах, космічних кораблях і станціях.
Основні сполуки
Силіцій(IV) оксид
Характеристика за формулою
Формула
Будова
Тип зв’язку Тип ґратки
Фізичні властивості
Агрегатний стан |
Колір |
tпл = |
У воді |
