
Опорні конспекти та дидактичні матеріали з неорганічної хімії
.pdf
40 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
|
3. |
H2O + Me → Me(OH)x + H2 (Me — |
) |
|
K+ H2O = |
|
|
Ca + H2O = |
|
4. |
H2O + Me → MeO + H2 (Me — |
) |
|
Zn + H2O = |
|
5. |
Fe + H2O = |
|
H2O → |
|
|
|
струм |
|
Одержання
1.H2 + O2 →
2.H2 + ZnO →t
4.
5.
Застосування
yyУ житті рослин і тварин (вода для зрошення полів). yyЯк розчинник у різних галузях народного господарства. yyУ побуті.
yyДля одержання основ. yyДля одержання кислот.
yyУ системах охолодження й опалення. yyУ парових турбінах.
yyАзотовмісні мінеральні добрива.
yyДля одержання органічних речовин (спирту, етанової кислоти та ін.).
yyДля одержання водню. yyХлоридна кислота НCl. yyАмоніак.
yyНітратна кислота.
yyДля одержання електрики.
 Складіть рівняння реакцій узаємодії: yyкупрум(II) оксиду з воднем
Складіть рівняння реакцій узаємодії: yyкупрум(II) оксиду з воднем
yyводню з бромом yyводню з магнієм yyводи з натрієм
yyводи з кальцій оксидом yyводи із cульфур(VI) оксидом
Теоретична частина |
41 |
ГАЛОГЕНИ
(елементи VII групи, головної підгрупи)
|
Хімічні елементи — галогени |
|
|
|
F |
Cl |
Br |
Зовнішній |
___ 2s_ 2p_ |
___ 3s_ 3p_ 3d_ |
___ 4s_ 4p_ 4d_ |
рівень |
|
|
|
Електронегатив |
4,1 |
2,8 |
2,7 |
ність |
|
|
|
Валентність |
|
|
|
Ступінь окис |
–1 |
–1, +1, +3, |
–1, +1, +3, +5 |
нення |
|
+5, +7 |
|
Формули оксидів, їхній характер
Формули гідро ксидів, їхній характер
Водневі спо луки
Прості речовини, утворені галогенами
|
F2 |
Cl2 |
Br2 |
I2 |
Агрегатний |
Газ |
Газ |
Рідина |
Кристали |
стан |
|
|
|
|
Колір |
Зеленувато |
Жовто зеле |
Темно бура |
Темно фі |
|
жовтий |
ний |
|
олетовий |
|
|
|
|
із блиском |
Запах |
Різкий |
Різкий |
Різкий |
— |
tкип. |
–188 |
–34 |
57,9 |
Возгонка |
tпл. |
–219 |
–101 |
–7 |
й субліма |
ція |
||||
Розчинність |
— |
1H2O :2,5Cl2 |
2,5 г на |
0,02 г на |
у воді |
|
|
100 г H2O |
100 г H2O |
Возгонка, або сублімація — перехід речовини із твердого агре гатного стану в газоподібний, минаючи рідкий.

42 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Природні сполуки
F: Плавиковий шпат — CaF2
Cl: NaCl — сіль; KCl — сильвін; KCl MgCl2 6H2O — карналіт Br, I: морська вода (водорості)
Одержання галогенів
1.Електроліз MeHaIx
NaCl струм→
NaBr струм→
NaF струм→
2.HCl + MnO2 → Cl2 + MnCl2 + H2O
3.KMnO4 + HCl(конц.) → KCl + MnCl2 + H2O + Cl2
4.KBr + Cl2 → KCl + Br2
Хімічні властивості галогенів
|
|
|
H2 + HaI → HHaI |
|
H2 |
+ F2 → |
|
(гідроген флуорид) |
|
H2 |
+ Cl2 |
→ |
( |
) |
H2 |
+ Br2 |
→ |
( |
) |
|
|
|
H2O + F2 → HF + O2 |
|
|
|
|
H2O + Cl2 → HCl + HClO |
|
|
|
|
H2S + Br2 → HBr + S |
|
|
|
|
Me + HaI → MeHaIx |
|
Zn + F2 → |
( |
) |
||
Fe + Cl2 → |
( |
) |
||
Mg + Br2 → |
|
(магній бромід) |
||
MeCl + F2 →
MeBr + Cl2 →
HBr + Cl2 →
NaOH + Cl2 → NaCl + NaClO + H2O
Ca(OH)2 + Cl2 →
KClO3 →t
Застосування
Фтор — для фторування органічних сполук, одержання висо котемпературного полум’я.
Теоретична частина |
43 |
HF — для одержання написів, малюнків на склі, для травлен ня чавуну.
Хлор — відбілювання целюлози (виробництво паперу), дезін фікуючий засіб для води, одержання HCl, для одержання хлорпо хідних вуглеводнів.
HCl — під час травлення металів, паяльна рідина (HCl + Zn), для одержання металів із руд.
KClO3 — бертолетова сіль — виробництво сірників, вибухових речовин.
Ca(OH)2 + Ca(OCl)2 + CaCl2 — хлорне вапно — дезінфікуючий і відбілювальний засіб, дезактивація отруйних речовин.
Бром — для одержання бромідів, бромопохідних вуглеводнів, сполуки використовують як заспокійливі засоби.
Йод — виробництво ліків і в хімічному аналізі.
Водневі сполуки галогенів
HF — фтороводень (розчин у воді — плавикова кислота). Кислота середньої сили, отруйна, спричиняє опіки.
HF + SiO2 → SiF4 + H2O
HCl — хлороводень (розчин у воді — хлоридна кислота) Сильна кислота, спричиняє опіки.
HCl + Me(до H) →
HCl + MeO →
HCl + MeOH →
Якісна реакція на Cl−
Cl− + Ag+ → AgCl ↓ (білий сирнистий осад)
HBr — бромоводень (розчин у воді — бромідна кислота)
HBr + Me(до H) →
HBr + MeO →
HBr + MeOH →
Якісна реакція на Br−
Br− + Ag+ → AgBr ↓ (жовтий сирнистий осад)
 Складіть рівняння реакцій узаємодії: водню з фтором хлору із залізом фтору із сіркою
Складіть рівняння реакцій узаємодії: водню з фтором хлору із залізом фтору із сіркою
44 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Зрівняйте з допомогою електронного балансу:
Cl2 + I2 + H2O → HIO3 + HCl
ПІДГРУПА ОКСИГЕНУ
(VI група, головна підгрупа)
 Укажіть правильні відповіді для елементів VIА підгрупи.
Укажіть правильні відповіді для елементів VIА підгрупи.
1.Кількість електронів на зовнішньому рівні атомів дорівнює:
а) |
5; |
б) 4; |
в) |
6; |
г) 7. |
2.Розподіл зовнішніх електронів за підрівнями:
а) |
s2 p3d1; |
б) s2 p4d0; |
в) |
s1 p3d2. |
|
3.Можливі валентності:
а) |
I; |
б) II; |
в) |
III; |
г) IV; |
д) V; |
е) VI. |
|
4.Характерні ступені окиснення (крім О):
а) |
–1, |
–2, |
+1, |
+2, +4, +6; |
б) –2, +4, +6; |
в) |
–1, |
–2, |
+4, |
+6. |
|
5.Формули можливих оксидів:
а) |
E2O3; |
б) EO2; |
в) |
EO3; |
г) E2O5. |
6.Формули можливих гідроксидів:
а) |
HEO3; |
б) H2EO3; |
в) |
HEO4; |
г) H2EO4. |
7.Під час руху від Оксигену до Полонію металічність:
а) |
зменшується; |
б) збільшується; |
в) |
не змінюється. |
|
8.Під час руху від Оксигену до Полонію електронегативність:
а) |
зменшується; |
б) збільшується; |
в) |
не змінюється. |
|
Теоретична частина |
45 |
Оксиген і кисень
Проста речовина O2 |
|
Молекулярна формула |
|
Mr = |
M = |
Структурна формула |
|
Тип зв’язку |
|
Тип ґратки |
|
Алотропні модифікації |
|
Кисень O2 |
|
Фізичні властивості |
|
Агрегатний стан |
Колір |
Запах |
У воді |
tкип. = −183 °C |
tпл = −219 °C |
Відносна густина за повітрям |
|
Озон O3 |
|
Фізичні властивості |
|
Агрегатний стан |
Колір |
Запах |
У воді |
tкип. = −183 °C |
tпл = −219 °C |
Відносна густина за повітрям |
|
Хімічні властивості
Процес узаємодії речовини з киснем —
Процес узаємодії речовини з киснем з виділенням тепла й світ ла —
Продукт узаємодії речовини з киснем —
46 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
1.E + O2 → E2Ox
а) Fe + O2 →
б) Cu + O2 →
в) H2 + O2 →
2.ABC + O2 → A2Ox +B2Oy +C2Oz
а) CH4 + O2 →
б) CS2 + O2 →
в) PH3 + O2 →
Кисень —
Поширення у
У вигляді простої речовини |
У складі складних речовин |
|
yy |
||
(O2 ) |
||
yy |
||
|
||
21% атмосфери |
yy |
|
yy |
||
|
Застосування
Одержання кисню
У лабораторії
KMnO4 →
H2O2 →
KClO3 →
KNO3 →
KMnO4 Скловата O2
Теоретична частина |
47 |
У промисловості
MnO2
O2
H2O2
Сульфур і сірка
Алотропія — явище існування декількох різних за _________
__________ і _____________________________ простих речовин, утворених одним хімічним елементом.
Алотропні видозміни — прості речовини, різні за ______ ____
_________ і _______________________________, утворені одним хімічним елементом.
Сірка як проста речовина
|
Кристалічна сірка |
Пластична сірка |
|
|
S |
8 |
S∞ |
|
|
|
|
|
|
Моноклінна |
Ромбічна |
Агрегатний |
Твердий, кристали |
Твердий, гумоподібний |
|
стан |
|
|
|
Колір |
|
Жовтий |
Коричневий |
Запах |
|
Без запаху |
Без запаху |
tпл. |
|
112,8 °С |
119,3 °С |
|
|
|
|
tкип. |
|
444 °С |
444 °С |
|
|
|
|
У воді |
|
Нерозчинна |
Нерозчинна |
S8 →tкип. →охолодження у водi →S∞ →самочинне →S8

48 |
|
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
|
Хімічні властивості |
|
||
Окисник |
|
||
S + H2 |
→ |
→ S−2 |
|
гідроген сульфід |
|||
S + Me |
→ |
сульфід |
|
S + Al → |
|
||
|
|
t |
|
S + Fe → |
|
||
S + неMe → |
|
||
S + C → |
|
||
S + P → |
|
||
Відновник |
|
||
|
|
|
S0 −4e → S+4 |
S + O2 |
→ |
→ S+6 |
|
|
|||
S + F2 |
→ |
|
|
S + Cl2 |
→ |
|
|
S + Br2 |
→ |
|
|
Поширення у природі
У вигляді простої речовини
FeS2
FeS
PbS
Cu2S
ZnS
Одержання
Нестача
H2S + O2 →
H2S + Cl2 →
H2S + SO2 →
Застосування
Для одержання сульфатної кислоти; у паперовій промисловос ті; у сільському господарстві (для боротьби із хворобами виногра ду й бавовнику); у гумовій промисловості (вулканізуючий агент); у виробництві барвників і світних сполук; для одержання чорного (мисливського) пороху; у виробництві сірників; у медицині.
Теоретична частина |
49 |
Основні сполуки Сульфуру
Оксиди
Характеристика |
Сульфур(IV) оксид |
Сульфур(VI) оксид |
Молекулярна |
|
|
формула |
|
|
Структурна формула, |
|
|
вид зв’язку |
|
|
Технічна назва |
Сірчистий газ |
Сірчаний ангідрид |
Фізичні властивості (за н. у.)
Характреистика |
Сульфур(IV) оксид |
Сульфур(VI) оксид |
Агрегатний стан |
Газ |
Тверда речовина |
Колір |
— |
— |
Запах |
Різкий |
Характерний |
tкип.,°С |
–10,1 |
44,9 |
Розчинність у воді |
Малорозчинний |
Розчинний |
Біологічна дія |
Отруйний |
Отруйний |
Хімічні властивості
Реагент |
Сульфур(IV) оксид |
Сульфур(VI) оксид |
+ H2O |
|
|
+ NaOH |
|
|
+ 2NaOH |
|
|
+ CaO |
|
|
Одержання
Сульфур(IV) оксид |
Сульфур(VI) оксид |

50 Опорні конспекти та дидактичні матеріали з неорганічної хімії
Застосування
Сульфур(IV) оксид 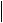 Сульфур(VI) оксид
Сульфур(VI) оксид
Сульфатна кислота
Характеристика за формулою
Молекулярна формула Структурна формула
Види зв’язків
Mr = |
|
M = |
|
Клас: |
|
1) двохосновна: |
|
2) |
|
Фізичні властивості |
|
Агрегатний стан: масляниста рідина |
Колір |
Запах |
Гігроскопічна |
У воді розчинна з виділенням тепла, спричиняє сильні опіки |
|
Правило ТБ під час розведення сульфатної кислоти
Під час розведення сульфатної кислоти додають |
|
в |
, а не навпаки. |
Теоретична частина |
51 |
Застосування
У виробництві мінеральних добрив, під час переробки рідко го палива — для очищення гасу, парафіну, мастил від сульфатних
іненасичених сполук, під час переробки кам’яновугільної смоли. Під час очищення різних мінеральних олій і жирів. У різних орга нічних синтезах. Для так званого травлення металів — очищення їх від оксидів. Сульфатна кислота є гарною осушувальною речо виною й із цією метою дістає широке застосування у лабораторіях
іпромисловості.
Хімічні властивості H2SO4
Спільні з іншими кислотами для розведеної H2SO4:
H2SO4
H2SO4 + Me(до H) → MeSO4 + H2
H2SO4 +Zn →
H2SO4 + Ag →
H2SO4 + Me2Ox → MeSO4 + H2O
H2SO4 + FeO →
H2SO4 + Me(OH)x → MeSO4 + H2O
H2SO4 + Cu(OH)2 →
H2SO4 + MeK → MeSO4 + HK
H2SO4 + CaCO3 →
Специфічні для концентрованої H2SO4 :
H2SO4 (конц.)+ nH2O → H2SO4 nH2O + Q
|
|
|
H2S |
|
|
|
до H |
MeSO4 + S + H2O |
|
||||
H2SO4 (конц.)+ Me |
|
|
SO2 |
|
|
|
|
|
|
|
|
||
Cu, Hg |
MeSO |
4 |
+ SO |
2 |
+ H |
O |
|
|
|
2 |
|
||
H2SO4 (конц.)+ Cu →
H2SO4 (100 %)+ Fe → (пасивує)
H2SO4 (конц.)+ CxHyOz → C + H2O + SO2
(обвуглювання органічних речовин) Якісна реакція на йон SO24− :

52 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
|||||
Солі сульфатної кислоти |
|
|
|
|||
Сульфати MeSO4 |
|
|
|
|
||
Гідрогенсульфати MeHSO4 |
|
|
|
|||
Хімічні властивості |
|
|
|
|
||
CuSO4 |
+Zn → |
|
|
|
|
|
CuSO4 |
+ NaOH → |
|
|
|
|
|
CuSO4 |
+ BaCl2 → |
|
|
(якісна реакція) |
||
Окремі представники й застосування |
|
|
||||
Глауберова сіль |
|
|
|
. |
||
Проносне в медицині, виробництво скла й соди. |
|
|||||
Мідний купорос |
|
|
|
. |
||
Обприскування рослин, протравляння насіння, покриття мета |
||||||
лів міддю електролізом. |
|
|
|
|
||
Залізний купорос |
|
|
|
. |
||
Боротьба зі шкідниками рослин, виготовлення чорнила, фар |
||||||
бування тканин. |
|
|
|
|
||
Гіпс |
|
|
|
|
|
. |
У будівництві й медицині. |
|
|
|
|||
Здійсніть схему перетворень. |
|
|
|
|||
1 |
|
сульфур(VI) |
2 |
сульфатна |
3 |
алюміній |
Сірка → |
оксид |
→ |
кислота |
→ |
сульфат |
|
45
гідроген кальцій сульфід сульфат
Для рівняння 4 напишіть електронний баланс, для рівнян ня 3 — реакції йонного обміну.
Теоретична частина |
53 |
Виробництво сульфатної кислоти
I стадія: випалювання
1) FeS2 + O2 →
пiрит
Апарат: піч для випалювання у «киплячому шарі» Технологічний принцип протитоку.
Температура = 800 °С.
II стадія: очищення SO2
2)Від великих частинок — циклон
3)Від дрібного пилу — електрофільтр
4)Від випарів води — осушка — сушильна вежа
III стадія: каталітичне окиснення SO2
SO2 + O2 →
5)Теплообмінник
6)Контактний апарат
(kat — V2O5, tпоч. = 600 °C, tкiнц. = 400 − 450 °C)
IV стадія: одержання олеуму
SO3 + H2SO4 nH2O →
7)Поглинальна вежа.
Технологічний принцип протитоку.
 Виконайте завдання.
Виконайте завдання.
1.Сума коефіцієнтів у реакції випалювання піриту: а) 12; б) 15; в) 25.
2.У який бік зміститься рівновага реакції:
2SO2 + O2 2SO3 + Q
за:
а) підвищення температури; б) зниження тиску;
в) збільшення концентрації кисню?
54 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Сірчаний |
1 |
2 |
колчедан |
|
Грубний газ |
|
|
Повітря
Вода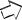
Очищений |
газ |
|
|
|
Водяна
пара
Недогарок |
Пил |
|
Концентрована 4 сульфатна 3
кислота
Грубний газ
сульфатна |
Пил |
кислота |
Очищений газ |
|
7 |
6 |
Газ |
|||||
|
5 |
|
|
|
|
|
|
Підігрітий |
|
||||
|
|
|||||
|
|
газ |
Сульфатна |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Газ із |
Олеум |
|||
|
контактного |
|||||
|
на склад |
|||||
|
|
апарату |
||||
|
|
|
||||
|
|
Виробництво сульфатної кислоти |
|
|||
Теоретична частина |
55 |
3.У який бік зміститься рівновага реакції:
SO3 + H2O H2SO4 + Q
за:
а) підвищення температури; б) зниження тиску;
в) збільшення концентрації сульфур(VI) оксиду?
ПІДГРУПА НІТРОГЕНУ
Укажіть правильні відповіді для елементів VА підгрупи.
1.Кількість електронів на зовнішньому рівні в атомах цих еле ментів дорівнює:
а) 3; б) 4; в) 5.
2.Характерні ступені окиснення: а) +1, +2, +3, +5, –1, –2, –3; б) +3, +5, –1, –2, –3; в) +3, +5, –3.
3.Формули можливих оксидів:
а) |
E2O3; |
б) E2O; |
в) |
E2O5; |
г) EO2. |
4.Формули можливих гідроксидів:
а) |
E(OH)2 ; |
б) HEO2; |
в) |
E(OH)3 ; |
г) HEO3. |
Нітроген
Проста речовина
Молекулярна формула
Mr =
M =
56 |
Опорні конспекти та дидактичні матеріали з неорганічної хімії |
Теоретична частина |
57 |
|
|
Структурна формула |
|
Застосування |
|
|
|
1. |
Одержання амоніаку. |
|
|
|
2. |
Створення інертного середовища. |
|
|
|
3. |
Спецефекти. |
|
|
|
4. |
Створення низьких температур. |
|
Кругообіг Нітрогену в природі
Тип зв’язку |
|
Тип ґратки |
Нітроген |
Фізичні властивості |
повітря |
|
Агрегатний стан — газ |
Колір |
Нітроген рослин |
|
|
|
Запах |
У воді дуже мало розчинний |
і тварин |
tкип. = −196 °C |
tпл = −210 °C |
Нітроген |
водойм |
||
Dповiтря = |
|
Харчування |
|
|
|
|
|
рослин |
Хімічні властивості |
|
|
Окисник |
|
Нітроген |
|
ґрунту |
|
N0 +3e → N−3 |
|
|
|
|
|
t, p, kat |
|
Поширення у природі |
N2 + H2 → |
|
|
+ Me(до Al) |
→ |
(амоніак) |
|
У вільному стані |
N2 |
|
|
|||
|
|
t |
|
|
|
|
|
|
(нітрид) |
|
78% повітря (за об’ємом) |
|
+ Ca → |
|
|
У зв’язаному стані |
|
N2 |
|
|
|
||
N2 |
+ K → |
|
|
|
Ґрунт (неорганічні сполуки). Органічні сполуки — білки, ну |
Відновник |
|
|
|
клеїнові кислоти та ін. |
|
|
|
|
Основні сполуки |
||
|
t° |
|
|
|
|
N2 + O2 → |
|
|
|
Амоніак |
|
Реактивна здатність |
|
, тому що |
|||
|
Характеристика за формулою |
||||
|
|
|
|
|
|
|
|
|
|
|
Молекулярна формула |
|
|
|
|
|
Mr = |
Одержання |
|
|
|
M = |
|
У лабораторії |
|
|
|
Структурна формула |
|
|
→N2 + H2O |
|
|
||
|
|
NH4NO2 |
|
|
|
|
|
|
t |
|
|
амоній нітрит
У промисловості
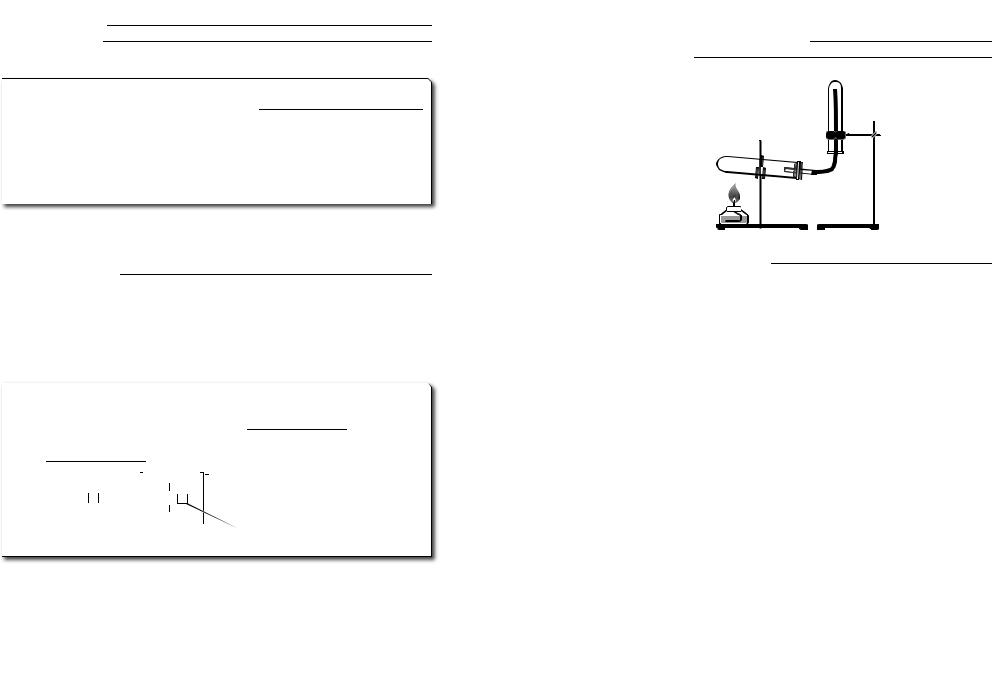
58 Опорні конспекти та дидактичні матеріали з неорганічної хімії Теоретична частина 59
Тип зв’язку |
Одержання |
Тип ґратки |
t |
У лабораторії: MeOH+ NH4X → |
|
Фізичні властивості |
Метод збирання |
|
Агрегатний стан за н. у. — газ |
Колір |
Запах різкий |
tкип. = −33,4 °C |
Розчинність у воді |
Біологічно активний, отруйний, |
1V H2O:700V NH3 |
уражає слизові оболонки очей |
|
і дихальних шляхів |
NH3 
NH4Cl
Ca(OH)2
Хімічні властивості амоніаку
Зі зміною ступеня окиснення азоту
NH3 + O2 →t
NH3 + O2 t, p, kat→
NH3 + Cl2 →
З утворенням йона амонію
NH3 + H2O →
NH3 + HnK →
Донорно-акцепторний зв’язок
Вид зв’язку, за якого один атом (_____________) надає свою неподілену електронну пару для утворення зв’язку, а другий атом (_____________) приймає цю пару на порожню орбіталь.
|
H |
|
H |
|
|
H − N: + H+ → H − N : H |
|
||||
|
|
|
|
|
|
|
H |
|
H |
донорно акцепторний |
|
|
|
|
|
|
|
йон амонію |
зв’язок |
|
У промисловості: N2 + H2 →
t = 400 −500 °C; p = 35− 40 МПа kat — Pt
Технологічний принцип — рециркуляція
Колона синтезу
Вода
Холодильник
Каталізатор
Турбокомпресор |
Вода |
Циркуляційний |
|
|
компресор |
Застосування
1.Як добриво.
2.Для одержання азотних добрив, нітратної кислоти, соди, вибу хових речовин.
3.Як холодоагент.
4.Нашатирний спирт — у медицині, побуті, лабораторіях.
Азотоводнева |
Сепаратор |
суміш (N2 + H2 )
Амоніак
Циркуляційний газ
