
Наочний довідник 8-9 класи
.pdf
Тема 3. Складні речовини.
Основні класи неорганічних речовин
ОКСИДИ
Оксиди — це складні речовини, утворені двома елементами (бінарні сполуки), одним із яких є Оксиген.
Кислотні оксиди — це оксиди неметалів (або оксиди, яким відповідають кислоти). Це оксиди елементів з валентністю III і вищою.
Осно[вні оксиди — це оксиди металів (або оксиди, яким відпо-
відають основи). Це оксиди елементів з валентністю I і II.
Амфотерні оксиди — це оксиди, які мають властивості і кислотних, і основних оксидів. Це оксиди деяких дво- і тривалентних елементів.
Класифікація оксидів
Солетворні |
Несолетворні |
Амфотерні |
||
Кислотні оксиди |
Оснóвні оксиди |
|||
|
|
|||
|
|
|
|
|
CO2 — карбон(IV) оксид |
Na2O — натрій оксид |
СО — карбон (ІІ) оксид |
Al2O3— алюміній оксид |
|
|
|
|
|
|
SO2 — сульфур(IV) |
BaO — барій оксид |
NО — нітроген(ІІ) |
Cr2O3 — хром(ІІІ) оксид |
|
оксид |
оксид |
|||
|
|
|||
|
|
|
|
|
SO3 — сульфур(VI) |
MgO — магній оксид |
|
ZnО — цинк оксид |
|
оксид |
|
|||
|
|
|
||
|
|
|
|
|
P2O5 — фосфор(V) |
FeO — ферум(ІІ) оксид |
|
PbO — плюмбум оксид |
|
оксид |
|
|||
|
|
|
||
|
|
|
|
|
P2O3 — фосфор(III) |
|
|
BeO — берилій оксид |
|
оксид |
|
|
||
|
|
|
||
|
|
|
|
|
SiO2 — силіцій оксид |
|
|
|
|
|
|
|
|
|
Оксиди в природі
В атмосфері |
У земній корі |
У гідросфері |
|
|
|
|
Мінерали: |
|
|
SiO2 — кварц, гірський криш- |
|
CO2 — вуглекислий газ |
таль, аметист, яшма, агат |
H2O — вода |
|
Al2O3 — корунд, глинозем |
|
|
Fe2O3 — бурий залізняк |
|
Тема 3. Складні речовини. Основні класи неорганічних речовин |
31 |

Характеристика амфотерних оксидів
Амфотерний елемент |
Амфотерний оксид |
Амфотерний гідроксид |
Zn |
ZnО |
Zn(OH)2 |
Al |
Al2O3 |
Al(OH)3 |
Сr |
Cr2O3 |
Cr(OH)3 |
Добування оксидів
|
Спосіб добування |
|
|
Рівняння реакції |
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
t |
|
1. |
Окиснення простих речовин |
C + O2 → CO2 ; 3Fe + 2O2 → Fe3 O4 |
|
|||
|
|
|
карбон(IV) |
|
залізна |
|
|
|
|
оксид |
|
окалина |
|
|
|
|
||||
2. |
Горіння складних речовин |
2CuS + 3O2 → 2CuO + 2SO2 ; CH4 + O2 → CO2 + 2H2 O |
||||
купрум(II) |
купрум |
сульфур(IV) метан |
карбон(V) |
|||
|
|
сульфід |
оксид |
|
оксид |
оксид |
|
|
|
|
|
|
|
|
|
|
t |
|
|
t |
3. |
Розклад нерозчинних основ |
2Fe(OH)3 → Fe2 O3 + |
3H2 O; Cu(OH)2 → CuO + H2 O |
|||
|
|
ферум |
ферум(III) |
|
купрум(II) |
купрум(II) |
|
|
пероксид |
оксид |
|
гідроксид |
оксид |
|
|
|
|
|
|
|
4. |
Розклад солей |
|
|
|
|
|
|
|
|
||||
5. |
Розклад гідроксидів |
H2 CO3 → H2 O + CO2 ↑ ; H2 SO3 → H2 O + SO2↑ |
||||
карбонатна |
карбон(IV) |
сульфітна |
сульфур(IV) |
|||
|
|
кислота |
оксид |
кислота |
оксид |
|
|
|
|
|
|
|
|
Основні галузі застосування деяких оксидів
Назва і формула оксиду |
Застосування |
|
|
|
|
Алюміній оксид Al2O3, глинозем |
Добування алюмінію, високоякісних вогнетрив- |
|
ких матеріалів |
||
|
||
|
|
|
Манган(IV) оксид MnO2 |
Як окисник |
|
Арсен(ІІІ) оксид As2O3 |
Виробництво отрутохімікатів, скла |
|
Сульфур(IV) оксид SO2, сірчистий газ |
Виробництво сульфатної кислоти |
|
Карбон(IV) оксид CO2, вуглекислий газ |
Добування соди, виготовлення безалкогольних |
|
напоїв |
||
|
||
|
|
|
Кальцій оксид СаО, палене або негашене вапно |
У будівництві як в’яжучий матеріал |
|
|
|
|
Цинк оксид ZnO |
Як каталізатор у багатьох хімічних процесах, |
|
входить до складу цинкового білила |
||
|
||
|
|
32 |
Розділ I |

Хімічні властивості оксидів
Хімічні
Оснóвні оксиди Кислотні оксиди Амфотерні оксиди
властивості
Взаємодія |
CaO + H2 O → Ca (OH)2 |
SO3 |
+ H2 O → H2 SO4 |
|
|
— |
|
|||
з водою |
кальцій |
|
кальцій |
сульфур(VI) |
|
сульфатна |
|
|
|
|
оксид |
|
гідроксид |
оксид |
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Взаємодія |
CaO + SO3 |
→ CaSO4 |
|
|
|
ZnO + CaO → CaZnO2 |
||||
з кислотними |
|
— |
|
|||||||
кальцій сульфур |
кальцій |
|
|
цинк кальцій |
кальцій |
|||||
оксидами |
оксид |
оксид |
сульфат |
|
|
|
оксид |
оксид |
цинкат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Взаємодія |
|
|
|
SO3 + CaO → Ca2 SO4 |
|
|
|
|
||
з основними ок- |
|
— |
|
|
|
|
|
|||
|
|
сульфур(VI) |
кальцій кальцій |
|
|
|
|
|||
сидами |
|
|
|
оксид |
оксид |
сульфат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Взаємодія з ам- |
Na2 O + ZnO → Na2ZnO2 |
P2 O5 + Al2 O3 → 2AlPO4 |
|
|
— |
|
||||
фотерними ок- |
натрій |
цинк |
натрій |
фосфор(V) алюміній |
алюміній |
|
|
|
||
сидами |
оксид |
оксид |
цинкат |
оксид |
оксид |
фосфат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Взаємодія |
CaO + 2HCl → CaCl2 + H2 O |
|
— |
|
ZnO + 2HCl → ZnCl2 + H2 O |
|||||
з кислотами |
кальцій хлоридна |
кальцій |
|
|
цинк |
хлоридна |
цинк |
|||
оксид кислота |
хлорид |
|
|
|
оксид |
кислота |
хлорид |
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
SO3 |
+ 2NaOH → |
|
ZnO + 2NaOH → |
|||
Взаємодія |
|
|
|
сульфур(VI) натрій |
|
цинк натрій |
||||
|
— |
|
оксид |
гідроксид |
|
оксид |
гідроксид |
|||
з основами |
|
|
→ Na2 SO4 + H2 O |
|
→ Na2ZnO2 + H2 O |
|||||
|
|
|
|
|||||||
|
|
|
|
натрій |
|
|
|
натрій |
|
|
|
|
|
|
|
|
|
цинкат |
|
||
|
|
|
|
сульфат |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
ВОДА ЯК НАЙВАЖЛИВІШИЙ ОКСИД
Вода — хімічна сполука Гідроге- |
реходить з одного агрегатного стану |
ну й Оксигену. |
в інший. |
Кругообіг води в природі — цик- |
|
лічний процес, при якому вода пе- |
|
|
|
|
|
Немає природного тіла, яке мог- |
лу, гірської породи, живого тіла — |
ло б з нею порівнятися за впливом |
в якому не було б води. |
на хід найосновніших процесів. |
В. І. Вернадський |
Немає земної речовини — мінера- |
|
|
|
Тема 3. Складні речовини. Основні класи неорганічних речовин |
33 |
Історія дослідження води
Історія дослідження води
Стародавні філософи Платон і Арістотель вважали воду одним із чотирьох начал всього існуючого: землі, води, вогню та повітря. З погляду Арістотеля, поєднуючи основні елементи між собою, можна одержувати всі спостережувані властивості речовин: земля з водою утворюють холод, вода з повітрям — вологість, земля з вогнем — сухість, а вогонь з повітрям — тепло
До кінця ХVІІІ ст. вода вважалася простою речовиною. Ці погляди були такими міцними, що навіть досліди французького хіміка Пьєра Жозефа Макера в 1775 р., під час яких він добув воду в результаті спалювання водню, не дозволили йому спростувати думку про те, що вода — «неподільна» речовина. Проте досліди, що доводять протилежне, на той час проводилися хіміками дедалі частіше
Неелементарну природу води довів французький математик Гаспар Монж. А англійський учений Генрі Кавендіш у 1781 р. експериментально довів, що вода утворюється із «займистого повітря» з атмосферним киснем
У1783 р. французькі хіміки Антуан Лавуазьє і Пьєр Лаплас синтезували воду з водню.
Урезультаті цих дослідів стало відомо, що вода складається з двох елементів, які Лавуазьє назвав Гідрогеном і Оксигеном. Так вода «перетворилася» з простого елемента на складну речовину
Агрегатні стани води |
|
|
|
Газ |
Рідина |
|
Тверде тіло |
|
Вода |
|
|
Нагрівання |
|
Плавиться |
|
Водяна |
|
|
|
пара |
|
|
|
Охолодження |
|
Замерзає |
Лід |
Фізичні властивості води
атмосферному |
тиску |
При |
|
|
|
Прозора, не має смаку і запаху
Густина при 4 °C — 1 г/см3, при 20 °C — 0,9982 г/см3
Температура кипіння — 100 °С, температура плавлення — 0 °С
Висока теплоємність — 4,184 кДж/(кг•К)
Чиста вода погано проводить електрику
Є гарним відновником
34 |
Розділ I |

Хімічні властивості води
H O взаємодіє 2
з активними металами |
2K + 2H2 O → 2KOH + H2 ↑ ; Ca + 2H2 O → Ca (OH)2 + H2 ↑ |
|
кальцій |
кальцій |
|
|
гідроксид |
гідроксид |
|
|
|
|
|
t |
з менш активними металами |
Zn + H2 O → ZnO + H2 ; Mg + H2 O → MgO + H2 ↑ |
|
|
цинк |
магній |
|
|
|
|
t |
↑ |
з деякими неметалами |
C + H2 O → CO + H2 |
|
карбон(II) |
|
|
|
оксид |
|
|
|
|
з осно{вними оксидами |
|
|
з кислотними оксидами |
|
|
|
|
|
розкладається за високої температури |
ел. струм |
↑ |
під дією електричного струму |
2H2 O →2H2↑ + O2 |
|
|
|
Ти не маєш ані смаку, ані кольо- |
відаючи, що ти таке… Ти найбільше |
ру, ані запаху, тебе неможливо опи- |
багатство на світі… |
сати, тобою насолоджуватися, не |
А. де Сент-Екзюпері — про воду |
|
|
Витрата води у світі на рік
100%
80%
60%
40%
20%
|
|
|
|
|
|
|
|
|
|
Сільське господарство 82% |
|
Побутові потреби 10% |
Промисловість 8% |
|
|
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тема 3. Складні речовини. Основні класи неорганічних речовин |
35 |

Кругообіг води в природі
Річка |
Дощ |
 Випаровування
Випаровування
 Океан
Океан
Значення води в природі та житті людини
Вода
Гарний розчинник для багатьох речовин
Визначає і регулює клімат, бере участь у процесах рельєфоутворення
Є середовищем для перебігу хімічних реакцій
Забезпечує існування життя на Землі, входить до складу живих організмів
Бере участь у біохімічних реакціях, є середовищем існування для водних організмів
Сировина для промисловості, джерело енергії (ГЕС)
КИСЛОТИ
Кислоти — це складні речовини, |
Індикатор — хімічна речовина, |
що складаються з атомів Гідрогену |
забарвлення якої змінюється за- |
й кислотного залишку. |
лежно від кислотності середовища. |
|
|
Класифікація кислот за складом
|
|
Кислоти |
|
||
Ý |
Þ |
|
|||
Безоксигенові |
|
|
Оксигеновмісні |
||
|
|
|
|
|
|
Ø |
Ø |
||||
HCl — хлоридна кислота HBr — бромідна кислота HI — йодидна кислота HF — фторидна кислота H2S — сульфідна кислота
HNO3 — нітратна кислота H2SO3 — сульфітна кислота H2SO4 — сульфатна кислота H3PO4 — ортофосфатна кислота
36 |
Розділ I |

Класифікація кислот за кількістю атомів Гідрогену, |
|
|
|
||||
які входять до її складу, здатних заміщуватися на метал |
|
|
|
||||
|
|
|
Кислоти |
|
|
|
|
|
|
Ý |
Ø |
Þ |
|
|
|
Одноосновні |
|
Двохосновні |
Трьохосновні |
|
|||
|
Ø |
|
Ø |
|
Ø |
|
|
|
HCl |
|
H2SO3 |
|
|
|
|
|
HI |
|
H2SO4 |
|
H3PO4 |
|
|
|
HNO3 |
|
H3CO3 |
|
|
|
|
Оксиди, що відповідають кислотам |
|
|
|
|
|||
Кислотний оксид |
Відповідна кислота |
Кислотний оксид |
Відповідна кислота |
||||
SO2 |
|
H2SO3 |
P2O3 |
|
|
HPO3 |
|
SO3 |
|
H2SO4 |
CO2 |
|
|
H2CO3 |
|
P2O5 |
|
H3PO4 |
|
|
|
|
|
Найважливіші кислоти |
|
|
|
|
|
||
Назва |
|
|
Формула |
|
|
|
|
|
емпірична |
|
структурна |
|
|||
|
|
|
|
||||
Хлоридна |
|
НСI |
|
|
H |
Cl |
|
|
|
|
|
|
|
|
O |
Нітратна |
|
HNO3 |
|
H |
O |
N |
O |
|
|
|
|
|
|
|
|
Нітритна |
|
HNO2 |
|
H |
O |
N |
O |
|
|
|
|
H |
O |
S |
O |
Сульфітна |
|
H2SO3 |
|
H |
O |
||
|
|
|
|
|
|
||
|
|
|
|
H |
O |
S |
O |
Сульфатна |
|
H2SO4 |
|
H |
O |
O |
|
|
|
|
|
|
|||
|
|
|
|
H |
O |
C |
O |
Карбонатна |
|
H2CO3 |
|
H |
O |
||
|
|
|
|
|
|
||
|
|
|
|
H |
O |
|
|
Ортофосфатна |
|
H3PO4 |
|
H |
O |
P |
O |
|
|
|
|
H |
O |
|
|
|
|
|
|
|
|
|
O |
Метафосфатна |
|
HPO3 |
|
H |
O |
P |
O |
|
|
|
|
|
|
|
|
Тема 3. Складні речовини. Основні класи неорганічних речовин |
|
|
|
37 |
|||

Розповсюдження деяких кислот у природі
H2S |
HCl |
HNO3, H2SO4 |
H2CO3 |
Зустрічається у вулканіч- |
Входить до складу |
Містяться в дощовій |
Входить до складу при- |
них газах і у водах міне- |
шлункового соку |
воді «кислотні дощі» |
родних мінеральних |
ральних джерел |
|
|
вод |
|
|
|
|
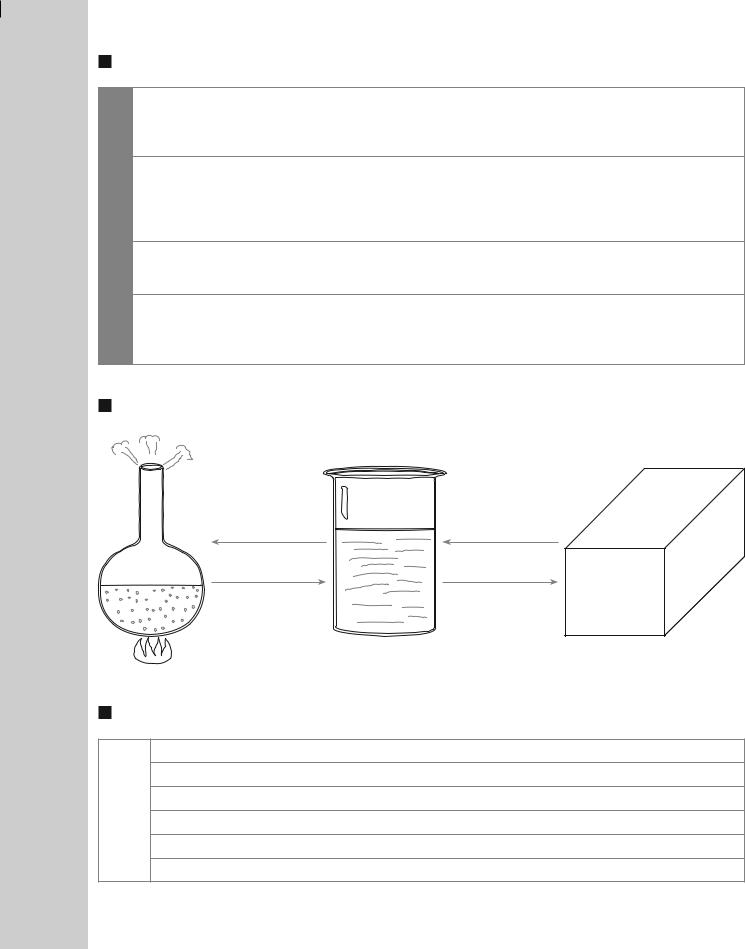
Добування кислот
Спосіб отримання |
Рівняння реакції |
1. |
Взаємодія кислотних оксидів з водою |
SO3 + H2 O → H2 SO4 ; CO2 + H2 O → H2 CO3 |
|||||
сульфур(VI) |
|
сульфатна карбон(IV) |
карбонатна |
||||
|
|
оксид |
|
кислота оксид |
|
кислота |
|
|
|
|
|
||||
|
|
N2 SiO3 + H2 SO4 → Na2 SO4 + H2 SiO3 ↓ |
|
||||
2. |
Витіснення сильною кислотою слабкої кисло- |
натрій |
сульфатна |
|
натрій |
силікатна |
|
силікат |
кислота |
|
сульфат |
кислота |
|
||
|
ти з її солей |
2NaCl + H2 SO4 → Na2 SO4 + 2HCl |
|
||||
|
|
натрій |
сульфатна |
|
натрій хлороводень |
|
|
|
|
хлорид |
кислота |
|
сульфат |
|
|
|
|
|
|
|
|
||
3. |
Взаємодія неметалів з воднем із подальшим |
H2 + Cl2 |
→ 2HCl ; H2 + S → |
H2 S |
|
||
|
розчиненням у воді (утворення безоксигено- |
|
хлороводень |
сірководень |
|
||
|
вих кислот) |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хімічні властивості кислот
|
змінюють колір |
індикаторів |
Кислоти |
взаємодіють |
|
|
|
|
Лакмус — червоний
Метилоранж — рожевий
Фенолфталеїн — залишається безбарвним
з металами |
Zn + 2HCl → ZnCl2 + H2↑ ; 2Na + 2H3 PO4 → 2NaPO4 + 3H2↑ |
|||||||
хлоридна |
цинк |
фосфатна |
натрій |
|
|
|||
|
кислота |
хлорид |
кислота |
фосфат |
|
|
||
|
|
|||||||
з осно{вними |
CaO + 2HCl → CaCl2 + H2 O; MgO + H2 SO4 → MgSO4 + H2 O |
|||||||
оксидами |
кальцій хлоридна |
|
кальцій |
магній сульфатна |
магній |
|
|
|
оксид |
кислота |
|
хлорид |
оксид кислота |
сульфат |
|
|
|
|
|
|||||||
з амфотерними |
Al2 O3 + 3H2 SO4 → Al2 (SO4 )3 + 3H2 O; Cr2 O3 + 6HCl → 2CrCl3 + 3H2 O |
|||||||
оксидами |
алюміній сульфатна |
алюміній |
хром(III) |
хлоридна хром(III) |
||||
оксид |
кислота |
|
сульфат |
оксид |
кислота |
|
хлорид |
|
|
|
|
||||||
з основами |
2KOH + H2 SO4 → K2 SO4 + 2H2 O; 3NaOH + H3 PO4 |
→ Na3 PO4 + 3H2 O |
||||||
калій сульфатна |
калій |
натрій |
ортофосфатна |
|
натрій |
|||
|
гідроксид |
кислота |
сульфат |
гідроксид |
кислота |
|
фосфат |
|
|
|
|
|
|||||
із солями |
BaCl2 + H2 SO4 → BaSO4 ↓ + H2 O; Ca (NO3 )2 + H3 PO4 |
|
→ Ca3 (PO4 )2 + H2 O |
|||||
барій сульфатна |
|
барій |
кальцій |
ортофосфатна |
кальцій |
|||
|
хлорид |
кислота |
|
сульфат |
нітрат |
кислота |
|
фосфат |
|
|
|
|
|
|
|
|
|
38 |
Розділ I |

Основні галузі застосування деяких кислот
Назва кислоти |
Застосування |
|
|
|
|
Хлоридна кислота |
Виробництво солей, травлення металів, як реактив у хімічних лабо- |
|
раторіях |
||
|
||
|
|
|
|
Добування бромідів різних металів, наприклад аргентум броміду, |
|
Бромідна кислота |
який використовується у виробництві світлочутливих кінофотома- |
|
|
теріалів |
|
|
|
|
Сульфатна кислота |
Виробництво кислот, фосфатних і нітратних добрив, очищення різ- |
|
них газів, виробництво барвників |
||
|
||
|
|
|
Нітратна кислота |
Виробництво барвників, вибухових речовин, нітратних добрив |
|
|
|
|
Ортофосфатна кислота |
Виробництво фосфатних добрив |
|
|
|
ХЛОРИДНА КИСЛОТА І ХЛОРОВОДЕНЬ
Хлоридна кислота HCl — це розчин хлороводню у воді
Порівняльна характеристика
Ознаки порівняння |
|
Хлороводень |
|
Хлоридна кислота |
|
|
|
||
|
Безбарвний газ із різким запахом; тверд- |
Безбарвна рідина з різким |
||
|
не за –114,2 °C; трохи важчий за повітря; |
запахом хлороводню; макси- |
||
Фізичні |
густина 1,64 г/л; добре розчиняється у воді |
мальна концентрація хлорид- |
||
властивості |
з утворенням хлоридної кислоти; на волого- |
ної кислоти — 36 %; густина |
||
|
му повітрі «димить», утворюючи з парами |
1,18 г/мл |
||
|
води крапельки хлоридної кислоти |
|
||
|
|
|
|
|
|
У лабораторних умовах |
добувають |
Розчинення хлороводню у воді |
|
|
взаємодією сухої кухонної солі з кон- |
|
||
Добування |
центрованою |
сульфатною |
кислотою. |
|
|
У промисловості одержують спалюванням |
|
||
|
водню в атмосфері хлору |
|
|
|
|
|
|
||
|
Важливий продукт хімічної промисло- |
Для виробництва солей, в ме- |
||
Застосування |
вості, який використовують для виробниц- |
дицині |
||
|
тва хлоридної кислоти |
|
|
|
|
|
|
|
|
Якісна реакція на хлоридну кислоту та її солі
Хлоридна кислота взаємодіє з аргентум хлоридом:
HCl + AgNO3 →HNO3 +AgCl ↓ Аргентум хлорид AgCl — білий осад, нерозчинний у воді та кислотах.
Тема 3. Складні речовини. Основні класи неорганічних речовин |
39 |

Хімічні властивості хлоридної кислоти
HCl
змінює колір |
індикаторів |
взаємодіє
лакмус — червоний
метилоранж — рожевий
з металами |
Zn + 2HCl → ZnCl2 + H2↑ ; 2Al + 6HCl → 2AlCl3 + 3H2↑ |
|||||||
хлоридна |
цинк |
хлоридна алюміній |
|
|||||
|
кислота хлорид |
кислота |
|
хлорид |
|
|||
|
|
|
||||||
з осно{вними |
MgO + 2HCl → MgCl2 + H2 O; FeO + 2HCl → FeCl2 |
+ H2 O |
||||||
оксидами |
магній хлоридна |
магній |
ферум |
хлоридна |
ферум(II) |
|||
оксид |
кислота |
хлорид |
оксид |
кислота |
хлорид |
|
||
|
|
|||||||
із солями |
AgNO3 + HCl → AgCl ↓ + HNO3 ; HgNO3 + HCl → HgCl2 + HNO3 |
|||||||
аргентум |
хлоридна |
білий |
аргентум |
|
|
|
меркурій |
|
|
нітрат |
кислота |
осад |
хлорид |
|
|
|
хлорид |
|
|
|||||||
з основами |
NaOH + HCl → NaCl + H2 O; Ba (OH)2 + 2HCl → BaCl2 + 2H2 O |
|||||||
натрій хлоридна |
натрій |
барій |
хлоридна |
барій |
||||
|
гідроксид |
кислота |
хлорид |
гідроксид |
кислота |
хлоррид |
||
|
|
|
|
|
|
|
|
|
ОСНОВИ
Основи — складні речовини, що складаються з атомів металу та гідроксильної групи (—ОН).
Амфотерний гідроксид — основа, яка виявляє властивості основи й кислоти.
Луг —це розчинна основа.
Реакції нейтралізації — це реакції між основами та кислотами, в результаті яких утворюються сіль і вода.
Класифікація основ за розчинністю у воді
Розчинні (луги) |
Малорозчинні |
Нерозчинні |
|
|
|
NаOН — натрій гідроксид |
Ca(OH)2 — кальцій гідроксид |
Cu(OH)2— купрум (II) гідроксид |
(їдкий натр, луг натрію) |
(гашене вапно) |
Zn(OH)2 — цинк гідроксид |
КОН — калій гідроксид |
Mg(OH)2 — магній гідроксид |
Al(OH)3 — алюміній гідроксид |
(калі їдке, луг калію) |
|
|
Ba(OH)2 — барій гідроксид |
|
|
40 |
Розділ I |
