
bilety_Kot_ispravlennye
.docxК А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: "Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 1
|
||
|
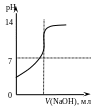
Титрованию какой кислоты соответствует приведённая на рисунке кривая титрования? 1) H2SO4 2) HOOCCH = CHCOOH, (Ka1 = 1,210 2, Ka2 = 6,010 7); 3) H3PO4, (Ka1 = 7,110 3, Ka2 = 6,210 8, Ka3= 5,010 13); 4) H2C4H4O6 , (Ka1 = 9,110 4, Ka2 = 4,310 5); 5) H3BO3 , (Ka = 5,810 10).
Дайте необходимые пояснения.
|
1,0 |
|
2. |
Укажите уравнение химической реакции, протекающей при титровании 0,1 М раствора карбоната натрия 0,1 М раствором HCl с индикатором метиловым оранжевым (pT = 4,0). 1) Na2CO3 + HCl NaHCO3 + NaCl 2) Na2CO3 + 2HCl H2CO3 + 2NaCl 3) Na2CO3 + 2HCl CO2 + H2O + 2NaCl 4) 2Na2CO3 + 3HCl 2NaHCO3 + H2CO3+ 3NaCl 5) 2Na2CO3 + 3HCl 2NaHCO3 + H2O + CO2 + 3NaCl |
1,0 |
|
3. |
В каких случаях точка нейтральности совпадает с точкой эквивалентности? 1) при титровании слабой кислоты; 2) при титровании слабого основания; 3) при титровании сильной кислоты; 4) при титровании сильного основания. |
1,0 |
|
4. |
Чему равна молярная масса эквивалента тетрабората натрия при использовании его в качестве первичного стандарта для определения характеристик рабочего раствора HCl? Ответ подтвердите уравнением химической реакции.
|
1,0 |
|
5. |
Рассчитайте титр раствора H2SO4 по NaOH (T (H2SO4/NaOH)), если c (1/2 H2SO4) = 0,0500моль/л. M (NaOH) = = 40 г/моль. 1) 0,002000 г/мл; 2) 0,0002000 г/мл; 3) 0,004000 г/мл; 4) 0,04000 г/мл; 5) 0,4000 г/мл |
1,5 |
|
6. |
Навеску NH4Cl растворили в 50,00 мл раствора гидроксида натрия (c (1/1 NaOH) = 0,1025 моль/л). Полученный раствор нагрели до полного удаления аммиака. На титрование непрореагировавшего NaOH израсходовали 25,00 мл хлороводородной кислоты (c (1/1 HCl) = 0,09825 моль/л). Рассчитайте массу навески NH4Cl, взятой для анализа. |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 2
|
||
|
Какая кривая соответствует титрованию 0,1 М раствора NH3·H2O 0,1 М раствором HCl? Поясните свой ответ.
|
1,0 |
|
2. |
Титруют смесь гидроксида натрия и карбоната натрия раствором HCl с индикатором метиловым оранжевым (pT = 4,0). Какие компоненты смеси при этом будут оттитровываться? Ответ подтвердите уравнениями соответствующих химических реакций. 1) NaOH и Na2CO3; 2) только NaOH; 3) только Na2CO3.
|
1,0 |
|
3. |
В каком случае точка эквивалентности находится выше линии нейтральности? 1) при титровании слабой кислоты; 2) при титровании слабого основания; 3) при титровании сильной кислоты; 4) при титровании сильного основания.. |
1,0 |
|
4. |
Какой индикатор следует использовать при определении содержания гидроксида натрия, если в растворе присутствует ацетат натрия (Ka (CH3COOH) = 1,75105)? Ответ подтвердите соответствующими уравнениями реакций и расчётами. 1) метиловый красный, pT = 5; 2); фенолфталеин, , pT = 9; 3) метиловый оранжевый, pT = 4; 4) любой из указанных индикаторов. |
1,0 |
|
5. |
В мерной колбе объёмом 100,0 мл растворили навеску тетрабората натрия (Na2B4O7·10H2O) массой 0,9535 г. На титрование 10,00 мл полученного раствора израсходовали 10,00 мл соляной кислоты ( c (1/1 HCl) = 0,0500 моль/л). Вычислите величину молярной массы эквивалента тетрабората натрия. 1) 381,4 г/моль; 2) 38,14 г/моль; 3) 190,7 г/моль; 4) 19,07 г/моль; 5) 1907 г/моль |
1,5 |
|
6. |
Через колонку с катионитом в Н+-форме пропустили 10,00 мл раствора CuSO4. На титрование собранного элюата израсходовали 20,35 мл раствора NaOH с концентрацией 0,1505 моль/л. Рассчитайте молярную концентрацию раствора CuSO4. |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 3 |
||
|
Какой вид имеет кривая титрования 0,05000 М раствора Na2CO3? Приведите уравнения химических реакций, подтверждающие ответ.
|
1,0 |
|
2. |
Какое из веществ и почему можно использовать в качестве первичного стандарта при определении характеристик рабочего раствора KOH? 1) HCl; 2) NH4Cl; 3) H2C2O4·2H2O; 4) H2SO4; 5) NaHCO3. |
1,0 |
|
3. |
При каких условиях возможно дифференцированное титрование двухосновной кислоты H2An в водном растворе?
1) |
1,0 |
|
4. |
По какой формуле рассчитывают количество моль эквивалента BaCO3 при его определении методом кислотно-основного титрования? Приведите уравнения химических реакций, подтверждающие ответ. 1) n (1/2 BaCO3) = n (NaOH); 2) n (1/2 BaCO3) = n (HCl) 3) n (1/2 BaCO3) = n (HCl) – n (NaOH); 4) n (1/2 BaCO3) = n (NaOH) – n (HCl) 5) n (1/2 BaCO3) = n (NaOH) + n (HCl). |
1,0 |
|
5. |
На титрование 10,00 мл раствора щавелевой кислоты (c (1/2 H2C2O4·2H2O) = 0,1000 моль/л) расходуется 15,00 мл раствора гидроксида натрия. Вычислите титр раствора NaOH. (M (NaOH) = 40,00 г/моль). 1) 0,002666 г/мл; 2) 2,666 г/мл; 3) 0,00026666 г/мл; 4) 0,026666 г/мл; 5) 0,2666 г/мл. |
1,5 |
|
6. |
Для идентификации катиона в карбонате, не содержащем примесей, 0,1400 г пробы растворили в 50,00 мл раствора HCl (c (HCl) = 0,1140 моль/л) и прокипятили для удаления CO2. На титрование остатка HCl затрачено 24,20 мл раствора NaOH (c (NaOH) = 0,09800 моль/л). Карбонат какого металла анализировали? |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 4 |
||
|
Титрованию какой кислоты соответствует приведённая на рисунке кривая? 1) H2SO4 2) H2C4H4O6, (Ka1 = 9,110 4, Ka2 = 4,310 5); 3) H2CO3 , (Ka1 = 4,510 7, Ka2 = 4,810 11); 4) H3PO4 (Ka1 = 7,110 3, Ka2 = 6,210 8, Ka3= 5,010 13); 5) H3BO3 (Ka1 = 5,810 10).
Дайте необходимые пояснения.
|
1,0 |
|
2. |
Какой состав раствора в точке эквивалентности при титровании раствора H3PO4 раствором NaOH с индикатором фенолфталеином (pT = 9)?
1) NaH2PO4; 2) NaH2PO4 + Na2HPO4; 3) Na2HPO4; 4) Na2HPO4 + Na3PO4; 5) Na3PO4
|
1,0 |
|
3. |
При титровании раствора слабой одноосновной кислоты раствором NaOH в точке эквивалентности находится: 1) буферный раствор; 2) негидролизующаяся соль; 3) соль, гидролизующаяся по катиону, 4) соль, гидролизующаяся по аниону.
|
1,0 |
|
4. |
С
каким индикатором следует титровать
K2CO3
до угольной кислоты
1) фенолфталеин, pT = 9; 2) метиловый оранжевый, pT = 4; 3) метиловый красный, pT = 5; 4) любой из указанных индикаторов.
|
1,0 |
|
5. |
Какую навеску тетрабората натрия Na2B4O7·10H2O нужно взять для установки титра раствора HCl с концентрацией c (1/1HCl) = 0,1000 моль/л способом отдельных навесок, чтобы на её титрование расходовалось 10,00 мл раствора HCl? M (Na2B4O7·10H2O) = 381,4 г/моль. 1) 1,907 г; 2) 0,1907 г; 3) 0,01907 г; 4) 0,3814 г; 5) 0,03814 г |
1,5 |
|
6. |
В образце массой 0,6450 г, содержащем NH4Cl, содержание NH3 определяли формальдегидным способом. На титрование выделившейся кислоты потребовалось 12,60 мл раствора NaOH с T (NaOH) = 0,002579 г/мл. Рассчитайте содержание NH3 в образце (в мас. %). |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 5 |
||
|
Какая кривая соответствует титрованию 0,1000 М раствора HCl 0,1000 М раствором NaOH? Дайте необходимые пояснения.
|
1,0 |
|
2. |
Укажите
уравнение химической реакции,
протекающей при титровании 0,1 М
раствора H3PO4
1) H3PO4 + NaOH NaH2PO4 + H2O 2) H3PO4 + 3NaOH Na3PO4 + 3H2O 3) 2H3PO4 + 3NaOH Na2HPO4 + NaH2PO4 + 3H2O 4) H3PO4 + 2NaOH Na2HPO4 + 2H2O 5) 2H3PO4 + 5NaOH Na3PO4 + Na2HPO4 + 5H2O.
|
1,0 |
|
3. |
0,0500 М раствор муравьиной кислоты (Ka(HCOOH) = 1,8104) оттитровали 0,0500 М раствором NaOH на 75 %. Укажите состав полученного раствора: 1) амфипротное соединение; 3) соль, подвергающаяся гидролизу; 2) буферный раствор; 4) негидролизующаяся соль. |
1,0 |
|
4. |
Какое из указанных веществ определяют способом титрования заместителя? Приведите уравнение химической реакции. 1) Na2CO3; 2) BaO; 3) NH4Cl; 4) NaOH; 5) CaCO3. |
1,0 |
|
5. |
Какую навеску безводного карбоната натрия Na2CO3 нужно взять, чтобы на её титрование с индикатором метиловым оранжевым (pT=4,0) расходовалось 10,00 мл раствора HCl (c (1/1HCl) = 0,05000 моль/л). М (Na2CO3) = 106,0 г/моль. 1) 0,0265 г; 3) 0,0053 г; 2) 0,0530 г; 4) 0,0027г. |
2,5 |
|
6. |
На титрование 25,00 мл раствора, содержащего HCl и H3PO4, в присутствии индикатора метилового оранжевого (pT=4,0) израсходовали 23,00 мл 0,1025 М раствора гидроксида натрия. Затем продолжили титрование в присутствии индикатора тимолфталеина (pT=10,0). При этом было израсходовано ещё 9,00 мл раствора NaOH. Рассчитайте молярные концентрации соляной и фосфорной кислот в анализируемом растворе. |
3,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 6 |
||
|
Какой вид имеет кривая титрования смеси H3PO4 + NaH2PO4? Приведите уравнения химических реакций, подтверждающие ответ.
|
1,0 |
|
2. |
Какое из указанных веществ применяется в качестве первичного стандарта для определения характеристик рабочего раствора KOH? Обоснуйте свой ответ. 1) H2SO4; 2) HCl; 3) NaHCO3; 4) H2C2O4·2H2O. |
1,0 |
|
3. |
В каком случае величина pH в точке эквивалентности больше 7? 1) при титровании сильной кислоты; 2) при титровании слабой кислоты; 3) при титровании сильного основания; 4) при титровании слабого основания. |
1,0 |
|
4. |
С каким индикатором следует титровать HCl, если в растворе присутствует NH4Cl (Kb(NH3·H2O) = 1,810 5)? Приведите необходимые уравнения химических реакций и расчёты. Концентрации всех участников принять равными 0,1000 моль/л. 1) фенолфталеин, pT = 9; 2) метиловый оранжевый, pT = 4; 3) метиловый красный, pT = 5; 4) любой из указанных индикаторов. |
1,0 |
|
5. |
Рассчитать титр раствора HCl по NaOH (T (HCl/NaOH)), если титр T (HCl) = 0,003646 г/мл. M (NaOH) = 40,00 г/моль, M (HCl) = 36,46 г/моль. 1) 0,0004000 г/мл; 2) 0,004000 г/мл; 3) 0,4000 г/мл; 4) 4,000 г/мл; 5) 0,04000 г/мл |
1,5 |
|
6. |
Навеску, массой 0,4789 г, содержащую карбонат стронция растворили в 40,00 мл 0,05100 М раствора HCl. После окончания реакции на титрование непрореагировавшей хлороводородной кислоты с индикатором фенолфталеином было израсходовано 20,00 мл раствора гидроксида натрия (T(NaOH)=0,0020 г/мл). Определите содержание SrCO3 в образце (в мас.%). (При расчёте примите М(SrCO3) =147,7 г/моль). |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 7 |
||
|
Какая кривая соответствует титрованию 0,0500 М раствора CH3COOH (Ka (CH3COOH) = 1,8105)) 0,1000 М раствором NaOH? Дайте необходимые пояснения.
|
1,0 |
|
2. |
С каким индикатором следует титровать Na2CO3 до NaHCO3
( 1) метиловый оранжевый, pT = 4; 2) фенолфталеин, pT = 9; 3) метиловый красный, pT = 5; 4) лакмус, pT = 7; 5) любой из указанных индикаторов. |
1,0 |
|
3. |
В каком случае величина pH в точке эквивалентности меньше 7? 1) при титровании сильной кислоты; 2) при титровании слабой кислоты; 3) при титровании сильного основания; 4) при титровании слабого основания. |
1,0 |
|
4. |
Какие из перечисленных растворов являются буферными? 1) 0,1 М CH3COOH + 0,1 М NaCl; 2) 0,1 М CH3COOH + 0,1 М CH3COONa; 3) 0,1 М HCl + 0,1 М CH3COOH; 4) 0,1 М NaCl + 0,1 М CH3COONa; 5) 0,1 М NH4OH + 0,1 М NH4Cl |
1,0 |
|
5. |
Вычислите титр раствора HCl, если c (HCl) = 0,1000 моль/л. M (HCl) = 36,46 г/моль. 1) 0,0003646 г/мл; 2) 0,3646 г/мл; 3) 0,003646 г/мл; 4) 3,646 г/мл; 5) 0,03646 г/мл. |
1,5 |
|
6. |
Образец массой 1,137 г, содержащий NH4NO3, растворили и разбавили дистиллированной водой до 250,0 мл в мерной колбе. К 25,00 мл полученного раствора прибавили раствор щёлочи и выделившейся NH3 отогнали в 20,00 мл раствора HCl (c (HCl) = 0,08120 моль/л). На титрование полученного раствора потребовалось 4,02 мл раствора NaOH (c (NaOH) = 0,09520 моль/л). Рассчитайте содержание NH4NO3 в образце (в мас.%) . |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 8 |
||
|
Какая кривая соответствует титрованию 0,05000 М раствора NaOH 0,0500 М раствором HCl? Объясните свой ответ.
|
1,0 |
|
2. |
Укажите уравнение химической реакции, протекающей при титровании 0,1000 М раствора тетрабората натрия (Na2B4O7·10H2O) 0,1000 М стандартным раствором HCl с индикатором метиловым красным (pT = 5,5): 1) Na2B4O7 + 10H2O + 2HCl 4HBO2 + 2NaCl 2) Na2B4O7 + HCl NaHB4O7 + NaCl 3) Na2B4O7 + 2HCl H2B4O7 + 2NaCl 4) Na2B4O7 + 2HCl + 5H2O 4H3BO3 + 2NaCl |
1,0 |
|
3. |
Раствор муравьиной кислоты ((Ka(HCOOH) = 1,810 4) оттитровали стандартным раствором гидроксида натрия. Укажите состав раствора в Т.Э.: 1) буферный раствор; 3) соль, гидролизующаяся по катиону; 2) соль, гидролизующаяся по аниону; 4) соль, не подвергающаяся гидролизу. |
1,0 |
|
4. |
С каким индикатором можно оттитровать 0,1000 М раствор H3PO4 до Na2HPO4 ( )? Ответ подтвердите расчётом и уравнениями химических реакций. 1) метиловый оранжевый, ,pT = 4; 3) тимолфталеин, , pT = 10,0; 2) метиловый красный, pT = 5; 4) любой из указанных индикаторов.
|
1,0 |
|
5. |
На титрование 10,00 мл раствора карбоната натрия (c (1/2 Na2CO3) = 0,05000 моль/л) в присутствии индикатора метилового оранжевого (pT = 4) расходуется 10,00 мл раствора HCl. Вычислите титр раствора HCl. При расчёте примите M (HCl) = 36,46 г/моль. 1) 0,001823 г/мл; 2) 0,03646 г/мл; 3) 0,1823 г/мл; 4) 0,01823 г/мл; 5) 0,0003646 г/мл |
1,5 |
|
6. |
Из навески препарата хлорида натрия (х.ч.) приготовили раствор в мерной колбе объёмом 100,0 мл. 10,00 мл полученного раствора пропустили через ионообменную колонку с катионитом в Н+-форме. На титрование собранного элюата израсходовали 10,56 мл раствора гидроксида натрия (T(NaOH)=0,003850 г/мл). Определите содержание NaCl в образце ( в г). |
2,5 |
|

 1.
1.
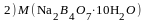
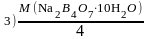
 1.
1.

 1.
1.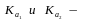 ступенчатые
константы диссоциации кислоты
ступенчатые
константы диссоциации кислоты 2)
2) 3)
3)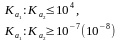
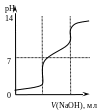 1.
1.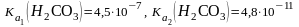 ?
Ответ подтвердите расчётом.
?
Ответ подтвердите расчётом. 1.
1.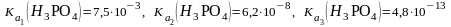 0,1 М стандартным раствором NaOH
с индикатором метиловым оранжевым
(pT
=
4). Ответ подтвердите расчётами.
0,1 М стандартным раствором NaOH
с индикатором метиловым оранжевым
(pT
=
4). Ответ подтвердите расчётами.


 1.
1. 1.
1.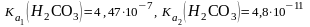 )?
Ответ подтвердите расчетом.
)?
Ответ подтвердите расчетом. 1.
1.