
bilety_Kot_ispravlennye
.docx
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 17 |
||
|
Какой вид имеет кривая титрования смеси Na2CO3 + NaHCO3?
|
1,0 |
|
2. |
Титруют смесь NaH2PO4 и Na2HPO4 стандартным раствором NaOH с индикатором тимолфталеином (pT = 10). Какие компоненты смеси при этом будут оттитровываться? . Объясните ответ и приведите уравнения реакций, протекающих при титровании. 1) NaH2PO4; 2) Na2HPO4; 3) NaH2PO4 и Na2HPO4. |
1,0 |
|
3. |
Укажите формулу, по которой рассчитывают интервал pH перехода окраски двухцветного кислотно-основного индикатора? ; ; ; . |
1,0 |
|
4. |
По какой формуле рассчитывают количество моль эквивалента ионов NH4+ при определении способом обратного титрования? Приведите уравнения реакций, иллюстрирующих схему титрования 1) n (NH4+) = n (NaOH) – n (HCl); 3) n (NH4+) = n (HCl); 2) n (NH4+) = n (NaOH); 4) n (NH4+) = n (HCl) – n (NaOH). |
1,0 |
|
5. |
Какую навеску декагидрата карбоната натрия Na2CO310 H2O нужно взять, чтобы на её титрование с индиктором метиловым оранжевым (pT = 4,0) расходовалось 10,00 мл раствора HCl (T (HCl) = 0,001823 г/мл). М (Na2CO310 H2O) = 286 г/моль, M (HCl) = 36,46 г/моль. 1) 0,0715 г; 2) 0,7150 г; 3) 0,00715 г; 4) 0,143 г; 5) 1,430 г. |
1,5 |
|
6. |
Для идентификации катиона в карбонате двухвалентного металла, содержащем 5% индифферентных примесей, образец массой 0,1753 г растворили в 50,00 мл HCl (c (HCl) = 0,1140 моль/л) и прокипятили для удаления CO2. На титрование остатка HCl израсходовали 24,20 мл раствора NaOH (c (NaOH) = 0,09800 моль/л). Определите, карбонат какого металла анализировали. |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 18 |
||
|
Титрованию какой кислоты соответствует приведённая кривая титрования? Объясните свой ответ. 1) HNO3; 2) HOOCCH = CHCOOH (Ka1 = 1,210 2, Ka2 = 6,010 7); 3) H3PO4 (Ka1 = 7,110 3, Ka2 = 6,210 8, Ka3= 5,010 13); 4) H2C4H4O6 ( 5) H3BO3 (Ka = 5,810 10).
|
1,0 |
|
2. |
Какое из указанных веществ определяют способом титрования заместителя? Приведите уравнение химической реакции. 1) Na2CO3; 2) BaO; 3) NH4Cl; 4) NaOH; 5) CaCO3. |
1,0 |
|
3. |
Какое требование является обязательным при выборе индикатора для конкретного случая кислотно-основного титрования? 1) интервал перехода окраски индикатора должен полностью или частично входить в пределы скачка титрования; 2) pT индикатора обязательно должно совпадать с точкой нейтральности; 3) индикатор должен необратимо изменять окраску в ТЭ. |
1,0 |
|
4. |
С каким индикатором можно оттитровать 0,1000 М раствор H3PO4 до NaH2PO4 Ответ подтвердите расчётом. ( ). 1) метиловый оранжевый, pT = 4; 3) фенолфталеин, pT = 9; 2) метиловый красный, pT = 5; 4) тимолфталеин , pT = 10. |
1,0 |
|
5. |
На титрование 0,1908 г тетрабората натрия Na2B4O7∙10H2O израсходовали 10,05 мл стандартного раствора H2SO4. Вычислите T(H2SO4/ Na2B4O7∙10H2O). 1) 0,1899; 2) 0,001899; 3) 0,01899; 4) 0,004900; 5) 1,899. |
1,5 |
|
6. |
Рассчитайте объём соляной кислоты (c(HCl) = 0,09239 моль/л), необходимый для титрования 25,00 мл раствора, содержащего 0,1450 М NaOH и 0,09500 М Na2CO3, с индикатором метиловым оранжевым (pT = 4,0). |
2,5 |
|



 1.
1. 1.
1.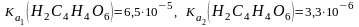 );
);