
bilety_Kot_ispravlennye
.docx
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 9 |
||
|
Титрованию какой кислоты соответствует приведённая кривая титрования? Объясните свой ответ.
1) HCl 2) HOOCCH = CHCOOH, (Ka1 = 1,210 2, Ka2 = 6,010 7); 3) H3PO4, (Ka1 = 7,110 3, Ka2 = 6,210 8, Ka3= 5,010 13); 4) H2CO3 , (Ka1 = 4,510 7, Ka2 = 4,810 11); 5) H3BO3 , (Ka = 5,810 10).
|
1,0 |
|
2. |
Какое вещество было в растворе, если на титрование пробы раствора с индикатором метиловым оранжевым затрачено V мл стандартного раствора HCl, а с индикатором фенолфталеином на титрование такой же пробы – V/2 мл раствора HCl? Приведите уравнения химических реакций, объясняющие ответ. 1) NaOH; 3) NaHCO3; 2) Na2CO3; 4) Ba(OH)2. |
1,0 |
|
3. |
Какое требование является обязательным при выборе индикатора для конкретного случая кислотно-основного титрования? 1) интервал перехода окраски индикатора должен полностью или частично входить в пределы скачка титрования; 2) pT индикатора обязательно совпадает с линией нейтральности; 3) индикатор должен необратимо изменять окраску в ТЭ. |
1,0 |
|
4. |
С каким индикатором можно оттитровать 0,1000 М раствор H3PO4 до NaH2PO4 Ответ подтвердите расчётом. ( ). 1) метиловый оранжевый, pT = 4; 3) фенолфталеин, pT = 9; 2) метиловый красный, pT = 5,5; 4) бромкрезоловый синий, pT = 7. |
1,0 |
|
5. |
На титрование раствора, полученного из 0,3813 г "х.ч." тетрабората натрия Na2B4O7·10H2O, расходуется 16,00 мл раствора HCl. Вычислите с (HCl). (При расчёте принять M (Na2B4O7·10H2O) = 381,37 г/моль, M (HCl) = 36,46 г/моль.) 1) 0,6250 моль/л; 2) 0,06250 моль/л; 3) 0,006250 моль/л; 4) 0,1250 моль/л; 5) 0,01250 моль/л. |
1,5 |
|
6. |
10,00 мл моющего раствора, содержащего гидроксид натрия и карбонат натрия (c (NaOH)=0,1200 моль/л, c (Na2CO3)=0,1050 моль/л), оттитровали 0,1135 М раствором хлороводородной кислоты в присутствии индикатора фенолфталеина (pT=9). Рассчитайте объём HCl, который был израсходован на титрование. |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 10 |
||
|
Какой вид имеет кривая потенциометрического титрования смеси Na2CO3 + NaHCO3 (индикаторный электрод стеклянный)? Приведите уравнения химических реакций, подтверждающие ответ.
|
1,0 |
|
2. |
Содержание какой из солей можно определить способом прямого титрования? Объясните свой ответ. 1) Na3PO4 ( ); 2) (NH4)2SO4 ((Kb(NH3H2O) = 1,810 5); 3) K2SO4; 4) BaCO3 (Ka1 = 4,510 7, Ka2 = 4,810 11). |
1,0 |
|
3. |
Водный раствор метиламина CH3NH2 (Kb(CH3NH2·H2O) = 4,610 3) оттитровали соляной кислотой на 50 % Укажите состав полученного раствора: 1) соль, не подвергающаяся гидролизу; 3) соль, гидролизующаяся по катиону; 2) соль, гидролизующаяся по аниону; 4) буферный раствор. |
1,0 |
|
4. |
Какой состав раствора в точке эквивалентности при титровании раствора H3PO4 раствором NaOH с индикатором фенолфталеином (pT = 9)? Ответ подтвердите расчётом. . 1) NaH2PO4; 3) Na2HPO4; 2) NaH2PO4 + Na2HPO4; 4) Na2HPO4 + Na3PO4; 5) Na3PO4. |
1,0 |
|
5. |
На титрование 10,00 мл раствора NaOH расходуется 10,00 мл раствора H2SO4 с титром T (H2SO4) = 0,004900 г/мл. Вычислите T (NaOH). M (H2SO4) = 98 г/моль. M (NaOH) = 40 г/моль. 1) 0,4000 г/мл; 2) 0,04000 г/мл; 3) 0,004000 г/мл; 4) 0,0004000 г/мл; 5) 4,0000 г/мл |
1,5 |
|
6. |
К 35 мл 0,6 М раствора KH2PO4 добавили 65 мл 0,05 М раствора Na2HPO4. Рассчитайте pH полученного раствора. . |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 11 |
||
|
Какой вид имеет кривая титрования смеси NaOH + Na2CO3? Приведите уравнения химических реакций, подтверждающие ответ.
|
1,0 |
|
2. |
Какой индикатор следует использовать при титровании раствора Na2B4O7·10H2O (c(1/2 Na2B4O7·10H2O) = 0,0500 моль-экв/л) 0,0500 М раствором HCl?. (Ka H3BO3= 5,810 10) Ответ подтвердите расчётом. 1) метиловый оранжевый, pT = 4; 2) метиловый красный, pT = 5,5; 3) фенолфталеин, pT = 9; 4) пригодны все перечисленные индикаторы. |
1,0 |
|
3. |
Укажите формулу, по которой рассчитывают интервал pH перехода окраски двухцветного кислотно-основного индикатора?
|
1,0 |
|
4. |
По какой формуле рассчитывают количество моль эквивалента ионов NH4+ при определении солей аммония способом отгонки? Приведите уравнения реакций, иллюстрирующих схему титрования 1) n (NH4+) = n (NaOH) – n (HCl); 3) n (NH4+) = n (HCl); 2) n (NH4+) = n (NaOH); 4) n (NH4+) = n (HCl) – n (NaOH). |
1,0 |
|
5. |
На титрование раствора, полученного из 0,1907 г "х.ч." тетрабората натрия Na2B4O7·10H2O, расходуется 10,00 мл раствора хлороводородной кислоты. Вычислите титр раствора HCl. M (Na2B4O7·10H2O) = 381,4 г/моль, M (HCl) = 36,46 г/моль. 1) 0,003646 г/мл; 2) 0,03646 г/мл; 3) 0,001823 г/мл; 4) 0,3646 г/мл; 5) 0,01823 г/мл |
1,5 |
|
6. |
Навеску магнезита 0,1126 г, в состав которого входит MgCO3, обработали при нагревании 20,00 мл 0,1025 моль-экв/л раствора HCl. На титрование полученного раствора потребовалось 8,00 мл NaOH с T (NaOH) = 0,005250 г/мл. Определить %-ое содержание MgCO3 в магнезите. |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 12 |
||
|
Титрованию какой кислоты соответствует кривая титрования? 1) CH3COOH
2) HCl; 3) H2CO3 ; 4) H3BO3
5) H2C4H4O6
|
1,0 |
|
2. |
Чему равна молярная масса эквивалента фосфорной кислоты при титровании ее раствора стандартным раствором NaOH c индикатором метиловым оранжевым (pT = 4,0)? Ответ подтвердите уравнением химической реакции.
|
1,0 |
|
3. |
Титруют раствор Na2CO3 раствором HCl с индикатором метиловым оранжевым (pT = 4,0). Укажите состав раствора в ТЭ? 1) кислая соль; 3) буферная смесь; 2) слабая кислота; 4) сильная кислота. |
1,0 |
|
4. |
Какой индикатор следует использовать при титровании раствора NaOH раствором HCl в присутствии CH3COONa ( )? Ответ подтвердите расчётом. 1) метиловый оранжевый pT = 4; 3) фенолфталеин, pT = 9; 2) лакмус, pT = 7; 4) метиловый красный, pT = 5. |
1,0 |
|
5. |
Какую навеску NaOH следует взять, чтобы на титрование полученного из нее раствора в присутствии индикатора метилового оранжевого расходовалось 12,00 мл раствора HCl с c (HCl) = 0,1000 моль/л. M (NaOH) = 40 г/моль. 1) 0,0024 г; 2) 0,0240 г; 3) 0,0048 г; 4) 0,0480 г; 5) 4,8000 г |
1,5 |
|
6. |
Раствор NiSO4, пропущенный через ионообменную колонку с катионообменником в H+ - форме, разбавили в мерной колбе до 200 мл. 10,00 мл полученного раствора оттитровали 15,25 мл раствора NaOH с T (NaOH) = 0,003245 г/мл. Рассчитать содержание NiSO4 в исходном растворе (г). |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 13 |
||
|
Какой вид имеет кривая титрования H3PO4 раствором NaOH? Приведите уравнения химических реакций, подтверждающие ответ.
|
1,0 |
|
2. |
Какое вещество или смесь веществ находится в растворе, если при последовательном титровании стандартным раствором HCl V ф/ф (HCl) > V м/о (HCl)? Приведите уравнения химических реакций, подтверждающие ответ. 1) Na2CO3; 3) NaHCO3; 2) Na2CO3 + NaHCO3; 4) NaOH; 5) NaOH + Na2CO3. |
1,0 |
|
3. |
Какое практическое значение имеют буферные растворы? 1) увеличивают (или уменьшают) значение pH раствора; 2) изменяют направление химической реакции; 3) поддерживают постоянное значение pH раствора. |
1,0 |
|
4. |
По какой формуле рассчитывают количество моль эквивалента CaCO3 при его определении способом обратного титрования? Приведите уравнения реакций, иллюстрирующих схему титрования. 1) n (1/2 CaCO3) = n (NaOH); 3) n (1/2 CaCO3) = n (NaOH) + n (HCl); 2) n (1/2 CaCO3) = n (HCl); 4) n (1/2 CaCO3) = n (HCl) – n (NaOH); 5) n (1/2 CaCO3) = n (NaOH) – n (HCl) |
1,0 |
|
5. |
На титрование с индикатором метиловым оранжевым (pT = 4,0) образца технической кальцинированной соды массой 0,0589 г израсходовано 10,00 мл раствора HCl (c (HCl) = 0,1000 моль/л). Вычислите процентное содержание Na2CO3 в образце. М (Na2CO3) = 106 г/моль. 1) 100 %; 2) 90 %; 3) 80 %; 4) 70%; 5) 60%. |
1,5 |
|
6. |
К
40,0 мл 0,500 М раствора HCOONa
добавили 50,0 мл 0,200 М раствора HCl.
Рассчитайте pH
полученного раствора.
|
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 14 |
||
|
Какой вид имеет кривая титрования смеси HCl + H3PO4 раствором NaOH? Приведите уравнения химических реакций, подтверждающие ответ.
|
1,0 |
|
2. |
С каким индикатором следует титровать 0.1000 М раствор NaHCO3 до угольной кислоты . Ответ подтвердите расчётом. 1) метиловый оранжевый, pT = 4; 3) лакмус, pT =7; 2) фенолфталеин, pT = 9; 4) тимолфталеин, pT = 10; 5) с любым из указанных индикаторов. |
1,0 |
|
3. |
Раствор бензойной кислоты (Ka (C6H5COOH) = 6,3105) оттитровали стандартным раствором NaOH. Укажите состав раствора в ТЭ: 1) негидролизующаяся соль; 3) соль, гидролизующаяся по катиону; 2) соль, гидролизующаяся по аниону; 4) буферный раствор. |
1,0 |
|
4. |
По какой формуле рассчитывают количество моль эквивалента иона аммония при его определении формальдегидным методом? Приведите уравнения реакций, иллюстрирующих схему титрования. 1) n (1/1 NH4+) = n (1/1 NaOH); 3) n (1/1 NH4+) = n (1/1 HCl) – n (1/1 NaOH); 2) n (1/1 NH4+) = n (1/1 HCl); 4) n (1/1 NH4+) = n (1/1 NaOH) – n (1/1 HCl).
|
1,0 |
|
5. |
На титрование 10,00 мл раствора тетрабората натрия с титром T (Na2B4O7·10H2O) = 0,01907 г/мл расходуется 10,00 мл раствора HCl. Определите титр раствора HCl. M (HCl) = 36,46 г/моль, M (Na2B4O7·10H2O) = 381,4 г/моль. 1) 0,3646 г/мл; 2) 0,03646 г/мл; 3) 0,003646 г/мл; 4) 0,0003646 г/мл; 5) 0,001823 г/мл. |
1,5 |
|
6. |
Рассчитайте массу навески NaNO3 (х.ч.), взятую для анализа, если нитрат-ион предварительно был восстановлен до аммиака. Выделившийся NH3 поглотили 40,00 мл 0,1245 М раствора HCl и избыток кислоты оттитровали 22,40 мл 0,1002 М раствора NaOH в присутствии индикатора метилового красного. |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 15 |
||
|
Титрованию какой кислоты соответствует приведённая кривая титрования? 1) CH3COOH ; 2) H2CO3 ; 3) H2SO4; 4) H3BO3
5) H2C4H4O6
Объясните свой ответ. |
1,0 |
|
2. |
Какое вещество или смесь веществ находятся в растворе, если при последовательном титровании его стандартным раствором HCl V ф/ф (HCl) < V м/о (HCl)? Приведите уравнения реакций. 1) Na2CO3; 3) NaHCO3; 2) Na2CO3 + NaHCO3; 4) NaOH; 5) NaOH + Na2CO3. |
1,0 |
|
3. |
При каких условиях возможно дифференцированное титрование двухосновной кислоты H2An в водном растворе? Ka1 и Ka2 ступенчатые константы диссоциации кислоты. 1) 2) 3) |
1,0 |
|
4. |
С каким индикатором следует титровать H3PO4 ( ) до NaH2PO4? Ответ подтвердите расчётом. 1) фенолфталеин, pT = 9; 3) метиловый оранжевый, pT = 4; 2) лакмус, pT =7; 4) тимолфталеин, pT = 10; 5) с любым из указанных индикаторов. |
1,0 |
|
5. |
Какую навеску технической соды, содержащей 90 % Na2CO3, нужно взять, чтобы на ее титрование с индикатором метиловым оранжевым расходовалось 10,00 мл раствора HCl c c (HCl) = 0,1000 моль/л? М (Na2CO3) = 106 г/моль. 1) 0,5889 г; 2) 0,0589 г; 3) 0,1176 г; 4) 5,8889 г; 5) 1,1760 г |
1,5 |
|
6. |
К
40,0 мл 0,50 М раствора NH4NO3
добавили 25,0 мл 0,40 М раствора NaOH.
Рассчитайте pH
полученного раствора ( |
2,5 |
|
К А Ф Е Д Р А А Н А Л И Т И Ч Е С К О Й Х И М И И
Российский химико–технологический университет им. Д.И. Менделеева |
КУРС ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Тема: " Реакции кислотно-основного взаимодействия в количественном анализе» |
|||
КОНТРОЛЬНАЯ РАБОТА № 2 |
ВАРИАНТ № 16 |
||
|
Какая кривая соответствует титрованию 0,1000 М раствора бензойной кислоты C6H5COOH (Ka (C6H5COOH) = 6,3105) 0,1000 М раствором NaOH?
|
1,0 |
|
2. |
Укажите уравнение химической реакции, протекающей при титровании раствора карбоната натрия раствором HCl с индикатором фенолфталеином (pT = 9,0): 1) Na2CO3 + HCl NaHCO3 + NaCl; 2) Na2CO3 + 2HCl H2CO3 + 2NaCl; 3) Na2CO3 + 2HCl CO2 + H2O + 2NaCl; 4) 2Na2CO3 + 3HCl 2NaHCO3 + H2CO3+ 3NaCl; 5) 2Na2CO3 + 3HCl 2NaHCO3 + H2O + CO2 + 3NaCl. |
1,0 |
|
3. |
Водный раствор метиламина CH3NH2 (Kb(CH3NH2·H2O) = 4,610 3) оттитровали соляной кислотой на 50 % Укажите состав полученного раствора: 1) соль, не подвергающаяся гидролизу; 3) соль, гидролизующаяся по катиону; 2) соль, гидролизующаяся по аниону; 4) буферный раствор. |
1,0 |
|
4. |
С каким индикатором можно оттитровать раствор H3PO4 до Na2HPO4 ( )? Ответ подтвердите расчетом. 1) метиловый оранжевый, , pT = 4; 3) тимолфталеин, , pT = 10; 2) метиловый красный, pT = 5; 4) лакмус, pT = 7. |
1,0 |
|
5. |
На титрование 10,00 мл раствора карбоната натрия с c (1/2 Na2CO3) = 0,1000 моль/л в присутствии индикатора метилового оранжевого расходуется 10,00 мл раствора HCl. Вычислить T (HCl). M (HCl) = 36,46 г/моль.
1) 0,0036 г/мл; 2) 0,03646 г/мл; 3) 0,3646 г/мл; 4) 3,6460 г/мл; 5) 0,0003646 г/мл |
1,5 |
|
6. |
Сколько граммов CH3COONa нужно добавить к 150,0 мл 0,1000 М раствора CH3COOH, чтобы получить буферный раствор с pH = 4,76 ( ). |
2,5 |
|

 1.
1.


 1.
1.

 1.
1.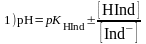 ;
;
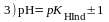 ;
;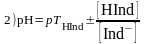 ;
;
 .
. 1.
1. ;
; ;
;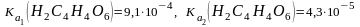 .
.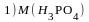 ;
;

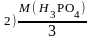 ;
;
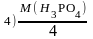


 1.
1.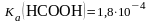 .
.

 1.
1. 1.
1.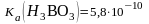 ;
;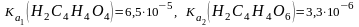 .
.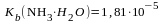 ).
). 1.
1.