
Дополнительные учебные материалы / Болевой шок
.pdf11 помощь организму последние запасы энергетических субстратов. Однако в случае развития
СПОН гиперпотребности организма в различных субстратах для адаптации к повышенным затратам энергии сочетаются с толерантностью тканей к этим же субстратам. В результате организм впустую тратит последние запасы энергии. При развитии гиперметаболизма скорость обмена веществ по сравнению с основным обменом увеличивается в два и более раз, значительно возрастает потребность организма в кислороде, развивается отрицательный азотистый баланс и происходит накопление углекислого газа.
Значительно страдают все виды обменов.
Метаболизм глюкозы протекает в условиях возрастания толерантности клеток к глюкозе на фоне гиперпродукции ее гепатоцитами, резко увеличивается глюконеогенез, для обеспечения которого происходит мобилизация аминокислот из миоцитов и висцеральных клеток.
Метаболизм белков смещается в сторону распада белковых субстанций, используемых в целях глюконеогенеза. Развивается отрицательный азотистый баланс.
Активизируется и липолиз на фоне снижения липогенеза, утилизации жирных кислот тканями и уменьшения активности липопротеинлипазы.
Следствием развития синдрома гиперметаболизма является не только множественная органная дисфункция, но и белково-энергетическая недостаточность с последующей кахексией (если, конечно, последняя успевает развиться до гибели организма).
4.4. Образование «шоковых органов» в процессе развития болевого шока
Как уже было указано выше, нарушение микроциркуляции, нарастающая гипоксия и токсемия приводит к развитию патологического феномена, получившего название «шоковые органы». Познакомимся более подробно с этими проявлениями болевого шока.
4.4.1. Патогенез респираторного дистресс-синдпрома («шоковых легких»)
Острый респираторный дистресс-синдром (или острый респираторный дистресс-синдром взрослых – ОДСВ) может возникнуть при ряде тяжелых патологических состояний различной этиологии. К ним относятся сепсис, травма, жировая эмболия легких, острый панкреатит, острая горная болезнь, отравления наркотиками и лекарственными средствами и ряд других заболеваний. С этой точки зрения ОДСВ можно рассматривать как типовой патологический процесс, что и предусматривает определение этого страдания, данное В.Ю.Шанининым:
«Респираторный дистресс-синдром – это типический патологический процесс снижения до критического уровня и ниже число нормальных респиронов в результате отрицательных нейрогуморальных влияний, патогенных межклеточных взаимодействий и тромбоза легочных микрососудов» (Клиническая патофизиология, СПб, 1998).
Острый респираторный дистресс-синдром взрослых развивается и в результате системной патологии, возникающей на терминальной стадии болевого шока, и с этой точки зрения
12 аналогичен понятию «шоковые легкие» - термин, достаточно часто применяемый при описании шока различной этиологии (Рис.5.).
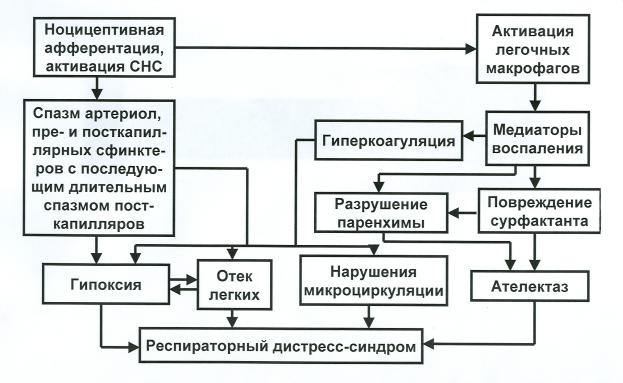
Рис. 5. Схема патогенеза респираторного дистресс-синдрома («шоковых легких»). По В.Ю.Шанину. Пояснения в тексте
В развитии ОДСВ можно выделить два основные звена патогенеза, связанные между собой общей причиной их возникновения – потоком ноцицептивной импульсации, исходящей из очага повреждения при болевом шоке, и порожденным им чрезмерной активацией симпатической нервной системы.
Симпатические влияния на систему легочной микроциркуляции вызывают длительный спазм артериол, пре- и посткапилляров. При этом спазм посткапиллярных сфинктеров сохраняется более длительный период времени, так как они менее чувствительны к гипоксии и ацидозу.
С другой стороны, повышенная активация симпатической нервной системы, которая помимо прессорных влияний на легочные сосуды, приводит к росту концентрации катехоламинов (прежде всего – адреналина) в системе легочного кровообращения. Последние, соединяясь с алфа-адренорецепторами интрапаренхимальных и легочных макрофагов, вызывают повышенную продукцию ими провоспалительных цитокинов (в частности, интерлейкина-1 и фактора некроза опухолей альфа) которые, в свою очередь, активируют гранулоциты и способствуют высвобождению соответствующих медиаторов воспаления. Так возникает и
13 развивается процесс так называемого «патогенного асептического воспаления, лишенного
биологического смысла», процесс, который захватывает не только легкие, но и другие внутренние органы, способствуя инициации полиорганной недостаточности. Медиаторы воспаления не только повышают проницаемость и увеличивают адгезивность эндотелия легочных микрососудов, но и благодаря появлению в очаге воспаления ряда биооксидантов, способствуют разрушению сурфактанта. В результате возникают и каскадно развиваются сразу несколько патологических компонентов дистресс-синдрома:
-ателектаз, вызванный как повреждением сурфактанта, так и самой паренхимы легких;
-тромбоз легочных микрососудов за счет активации контактного фактора свертывания и фактора Хагемана;
-плазмораггия, обусловленная повышением давления в микроциркуляторном русле и повышением проницаемости легочных капилляров, что, в конечном итоге, приводит к отеку легких.
Таковы основные звенья патогенеза респираторного дистресс-синдрома – одного из самых тяжелых последствий болевого шока.
4.4.2. Патогенез образования «шоковых почек»
Рассматривая роль болевого шока в почечной патологии, следует различать два патологических состояния, которые у нефрологов получили названия «почка при шоке» и «шоковая почка». В первом случае речь идет об острой преренальной почечной недостаточности, которая возникает в начале развития болевого травматического шока, сопровождающегося большой кровопотерей и, как следствие, падением артериального давления и гиповолемией. Несмотря на тяжесть подобного состояния, почки, хотя и не способны образовывать в достаточном количестве ультрафильтрат первичной мочи, тем не менее, функционально сохранены и при повышении артериального давления до нормальных величин могут в полной мере выполнять свою функцию.
Развитие значительно более тяжелой почечной патологии наблюдается тогда, когда мы встречаемся с последствиями длительно протекающего некупированного или недостаточно купированного болевого шока. В этом случае речь идет о развитии острой ренальной недостаточности, сопровождающийся морфологическими изменениями почечной паренхимы, некрозом нефронов коркового слоя почек и острым канальцевым некрозом. Именно это патологическое состояние и обозначается как «шоковые почки» (Рис.6.).
14
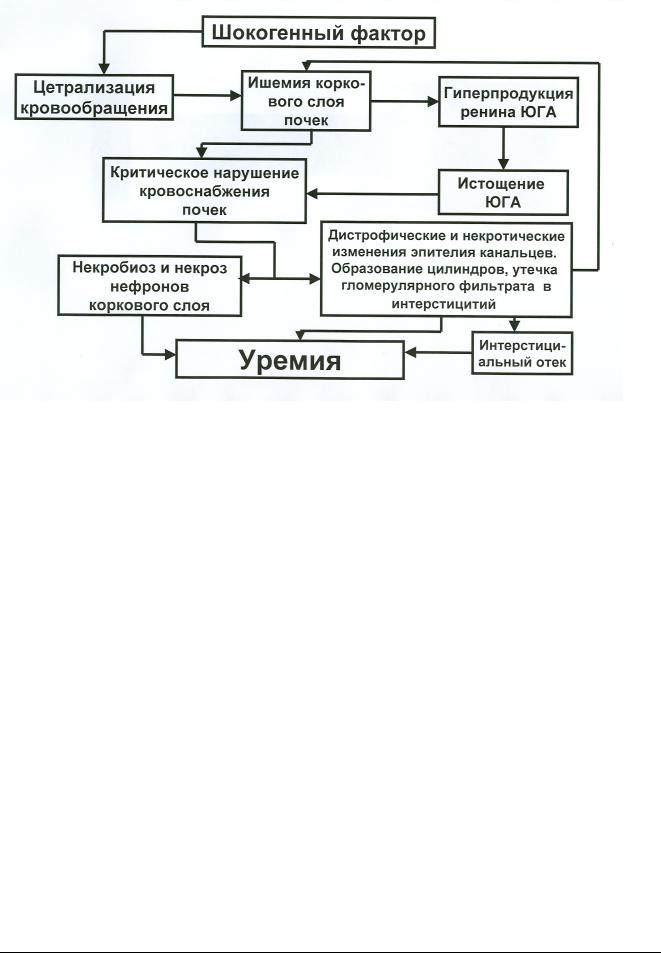
Рис. 6. Схема патогенеза «шоковых почек». Пояснения в тексте
Централизация кровообращения, призванная сохранить более или менее нормальное кровоснабжение жизненно важных органов (головного мозга, сердца) приводит к циркуляторному и энергетическому «обкрадыванию» многих внутренних органов, в том числе – и почек. В течение весьма короткого промежутка времени соотношение между объемом кровотока в корковом и в медуллярном слоях почек снижается с 9:1 до 1:1 (С.А.Селезнев и др., 1974). На некоторое время усиленное образование ренина в ЮГА почек может восстанавливать корковый кровоток, однако, вскоре происходит истощение ренин-ангиотензин-альдостероновой системы, и объем кровотока возвращается к уровню тяжелейшей ишемии почечной ткани. В результате, с одной стороны развивается некробиоз и некроз нефронов коркового слоя, а с другой происходит повреждение канальцевого аппарата почек вплоть до развития острого некроза эндотелия канальцев. Базальная мембрана канальцев, пораженных некрозом, не способна удерживать гломерулярный фильтрат, вследствие чего развивается отек паренхимы. Дополнительным фактором, способствующим развитию этой патологии, служит образование гиалиновых цилиндров, состоящих из слущенного эндотелия канальцев, а также из миоглобина, в том случае, когда мы имеем дело с болевым травматическим шоком, сопровождающимся краш-синдромом и рабдомиолизом – процессом, возникающим в результате деструкции миофибрилл скелетных мышц с выходом содержания мышечных клеток в системный кровоток. Обтурация канальцев еще более увеличивает интерстициальный отек, а это, в свою очередь,
15 усиливает ишемию почек. Последствием всех этих патологических изменений является анурия
иуремия.
4.4.3.Патогенез острой кардиальной нейродистрофии
Острая кардиальная нейродистрофия, имеющая в своем исходе острую сердечную недостаточность – это достаточно частый результат развития болевого шока (Рис.7.).
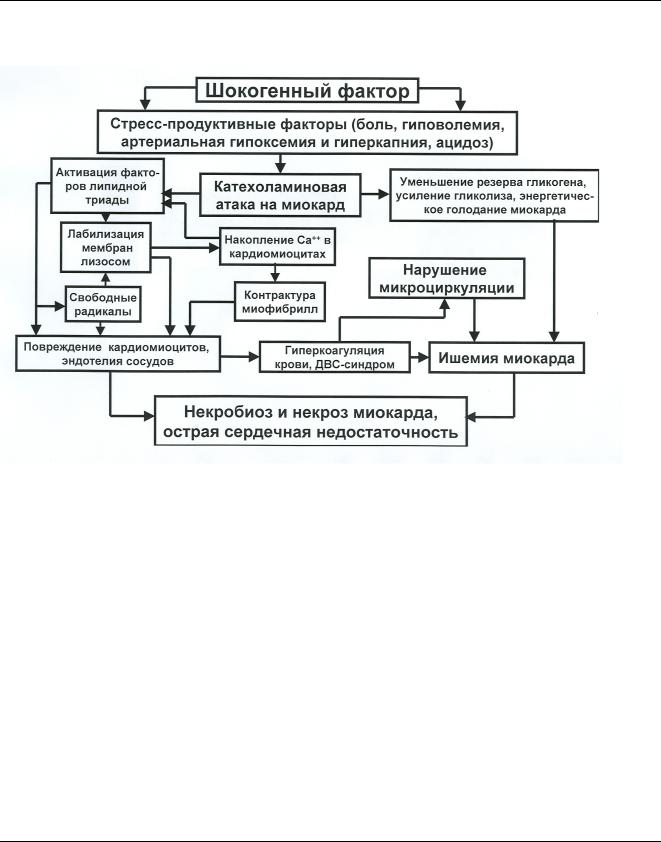
Рис. 7. Схема патогенеза острой кардиальной нейродистрофии при болевом шоке Пояснения в тексте
Шокогенный фактор болевого шока, прежде всего, реализует свое воздействие на организм за счет таких стресс-продуктивных агентов как болевой синдром, гиповолемия, артериальная гипоксемия и гиперкапния, ацидоз. В результате за счет усиленных симпатических влияний на миокард происходит мощное выделение норадреналина из нервных окончаний и быстро растет концентрация адреналина в крови, который в значительных количествах адсорбируется сердечной мышцей. Катехоламиновая атака на миокард вызывает параллельное развитие двух патологических процессов. Во-первых, катехоламины, усиливая потребность миокарда в кислороде, создают «ножницы» между его доставкой и реализацией, причем, реализацией, минующей отдаленные участки миокарда, куда он не успевает доставляться. Это создает множественные участки гипоксии в миокарде, где, компенсаторно, начинают преобладать процессы гликолиза и истощаются запасы гликогена. Во-вторых, избыток катехоламинов

16 способен оказывать на кардиомиоциты цитотоксическое действие за счет активации факторов
липдной триады (активация перекисного окисления липидов, активация липаз и фосфолипаз, детергентное действие жирных кислот). Дополнительный патогенный эффект на миокард вызывает и стимулируемая катехоламинами тахисистолия, которая нарушает систему коронарного кровообращения.
Факторы липидной триады, разрушая клеточные мембраны, повреждают и мембраны лизосом, ферменты которых, в свою очередь, лизируют мембраны сарколеммы и саркоплазматического ретикулума, высвобождая из них ионы Са++ и создавая его избыток в саркоплазме. С одной стороны повышенная концентрация ионов Са++ способствует активации ферментативных звеньев липидной триады, а с другой – вызывает контрактуру миофибрилл. Перекисное окисление липидов, помимо всех прочих негативных последствий этого процесса, приводит к образованию свободных радикалов и свободно-радикальному повреждению кардиомиоцитов и эндотелия сосудов микроциркуляторного русла. В поврежденном миокарде лавинообразно нарастают расстройства микроциркуляции, связанные как с процессами гиперкоагуляции крови в поврежденных микрососудах, так и с ростом внутрикапилляроного давления. Развивающееся общее энергетическое голодание сердечной мышцы стимулирует всю совокупность патологических процессов, что, в конечном итоге, реализуется тотальной ишемией, некробиозом и некрозом кардиомиоцитов и острой сердечной недостаточностью.
4.5. Общий патогенез болевого шока
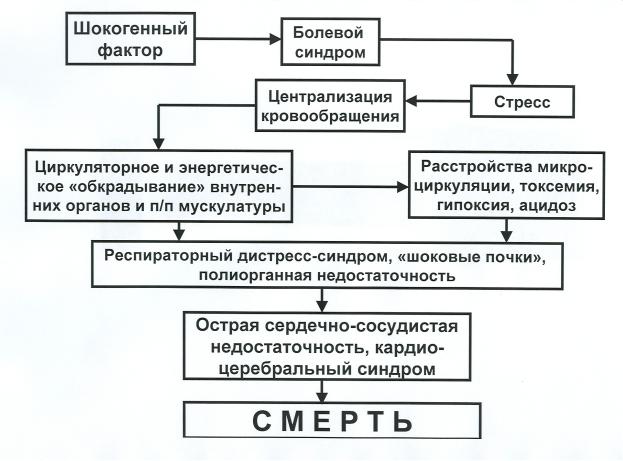
Общий патогенез болевого шока, как это представлено на Рис.8, складывается из взаимосвязанных и уже описанных ранее патогенетических механизмов.
Шокогенный фактор, обрушивающийся на организм, вызывает развитие болевого синдрома, интенсивность которого, конечно, зависит от вида болевого шока. Именно болевой синдром является основным пусковым механизмом стресса, который в большей или меньшей степени может поддерживаться и другими стресс-продуктивными факторами (гиповолемией, артериальной гипоксемией, ацидозом и т.п.). Как известно, стресс – это попытка срочной адаптации организма к резко изменившимся условиям его существования под воздействием шокогенного фактора. Помимо экстренной реализации энергетических ресурсов организма, стресс перестраивает деятельность основных систем его жизнеобеспечения таким образом, что они начинают работать на поддержание метаболических процессов только в тех органах, без сохранения которых жизнь становится просто невозможной (головной мозг, сердце). Так в процессе развития болевого шока возникает этап централизации кровообращения.
17
Рис. 8. Обобщенная схема патогенеза болевого шока. Пояснения в тексте
Однако, другие внутренние органы и скелетная мускулатура, оставшиеся на «голодном энергетическом пайке», могут находиться в таком состоянии достаточно непродолжительный промежуток времени, и их энергетическое голодание и, как следствие этого явления, расстройства микроциркуляции и разлад метаболических процессов начинают все более и более влиять на функции организма в целом, включая и функции сердечной мышцы и головного мозга. В организме нарастают токсемия, развивается тотальная гипоксия, газовый и метаболический ацидоз, свою лепту в который все в большей и большей мере вносят респираторный дистресс-синдром и «шоковые почки».
Развитие острой сердечной, а точнее – острой сердечно-сосудистой недостаточности является самым критическим звеном патогенеза, так как за ним следует его последний этап – нарушение мозгового кровообращения вплоть до развития ишемического инсульта. Наступающие расстройства центральных механизмов регуляции дыхания и сердечнососудистой деятельности делает развитие шока необратимым, приводящим к гибели организма.
Описывая общий патогенез болевого шока, следует сделать несколько пояснений.
18 Во-первых, таков патогенез и исход болевого шока при отсутствии врачебного
вмешательства, которое, как мы увидим в дальнейшем, способно блокировать развитие отдельных патогенетических механизмов, а также разорвать те или иные патологические круги.
Во-вторых, здесь представлен именно общий патогенез болевого шока, без учета специфических особенностей протекания каждого из видов болевого шока, которые, конечно, не могут не вносить существенные коррективы в те или звенья патогенеза. Например, для травматического шока будут в первую очередь характерны кровопотеря и повреждения органов и тканей, вплоть до развития краш-синдрома, а для ожогового шока – массивная токсемия и интенсивная плазмораггия через обожженную поверхность. Краткое описание патогенеза отдельных видов болевого шока рассматривается в нижеследующем разделе.
5. Патогенез отдельных видов болевого шока
В целом, схема патогенеза любого вида болевого шока будет включать одни и те же патогенетические звенья. Однако, в зависимости от вида болевого шока, одни из них будут преобладающими, а другие, при их реализации, будут приносить менее выраженные повреждающие воздействия.
5.1. Травматический шок
Для этого вида шока характерен мощный болевой синдром и, если при травме произошло ранение крупных кровеносных сосудов, большая кровопотеря, приводящая к резкому падению АД и гиповолемии. Кроме того, во многих случаях травматический шок сопровождается размозжением мягких тканей и всасыванием в кровь продуктов их распада (формирование «краш-синдрома»). Как правило, травматический шок сопровождается развитием эксудативного воспаления, которое в значительной степени осложняет терапию этого патологического состояния. Если травма затрагивает какие-либо внутренние органы, то во многом динамика шока будет зависеть от того, насколько серьезны эти повреждения и какие именно внутренние органы повреждены. Особенно тяжело травматический шок будет протекать при открытых и закрытых повреждениях головного мозга, ушибах сердца, пневмотораксе.
5.2. Ожоговый шок
Так же как и для шока травматического, для ожогового шока характерна сильнейшая боль, поскольку обожженные ткани становятся источником мощной болевой импульсации.
При ожоговом шоке ОЦК снижается вследствие не только сосудистых расстройств, но и в результате интенсивнейшей плазморагии через обожженную поверхность. Больной теряет огромное количество жидкости и степень сгущения крови при ожоговом шоке значительно выше, чем при шоке любой другой этиологии. Поэтому при ожоговом шоке следует переливать больному не цельную кровь, а плазму или физиологический раствор, с тем, чтобы разбавить эритроцитарную массу (предпочтительны кровезамещающие жидкости, содержащие
19 высокомолекулярные коллоиды, которые создают высокое онкотическое давление в сосудистом русле, восстанавливая ОЦК).
Кроме того, при ожоговом шоке наблюдается интоксикация за счет всасывания с обширной раневой поверхности продуктов распада тканей. Поэтому в комплекс терапевтических мероприятий при ожоговом шоке обязательно входит дезинтоксикация организма, заключающаяся в инфузии больших количеств жидкости, содержащей глюкозу, витамины, а также проведение гемодиализа и гемосорбции.
Так как обожженная поверхность представляет собой обширные раневые ворота инфекции, необходимо проведение соответствующих мероприятий (антибактериальная терапия, содержание больных в палатах со стерильным воздухом и др.).
5.3. Электрошок
Этот вид болевого шока наступает в результате поражения организма электрическим током, что и диктует весь комплекс терапевтических мероприятий, специфика которых определяется местом поражения и направлением электрического тока, прошедшего через организм.
Так, если электрический ток прошел через все тело или через грудную клетку, то возможно развитие фибрилляции желудочков сердца. Поэтому в случае развития фибрилляции при оказании такому пострадавшему первой помощи следует применить закрытый массаж сердца, а при наличии необходимой аппаратуры - электрическую дефибрилляцию сердца. Параллельно проводится искусственное дыхание. При прохождении электрического тока через голову возможно глубокое угнетение дыхательного и сосудодвигательного центров, в связи с чем нередко приходится часами проводить искусственное дыхание и массаж сердца до тех пор, пока не восстановится деятельность этих центров. Кроме того, в месте поражения электрический ток вызывает электролиз тканей - появляются так называемые «знаки тока», что приводит к развитию долго не заживающихся и с трудом поддающихся лечению местных повреждений.
5.4. Кардиогенный шок
Кардиогенный шок развивается у больных вследствие снижения минутного объема сердца за счет нарушений сократительной функции левого желудочка (инфаркт миокарда, миокардиты, кардиомиопатии, токсические поражения), вследствие нарушений внутрисердечной гемодинамики из-за механических причин (разрыв клапанов, хорд, папиллярных мышц, межжелудочковой перегородки, тяжелые пороки, шаровидный тромб предсердий, опухоли сердца), вследствие слишком высокой или слишком низкой частоты сердечных сокращений (тахи- и брадиаритмии, нарушения предсердно-желудочковой проводимости), а также вследствие невозможности адекватного наполнения камер сердца в период диастолы из-за развившейся тампонады перикарда. Наиболее частая причина кардиогенного шока – инфаркт миокарда (Рис.9).
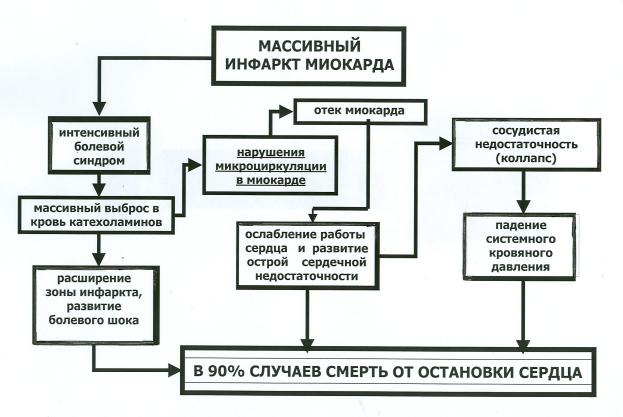
20
Рис. 9. Схема патогенеза кардиогенного шока. Пояснения в тексте
Стрессорный выброс катехоламинов в результате сильной боли, а также снижение ударного и минутного объема вызывает у больных инфарктом миокарда распространенную вазоконстрикцию, сопровождающуюся повышением общего периферического сопротивления. При этом возникают нарушения на уровне микроциркуляторного русла. Последние условно разделяют на две группы: вазомоторные и внутрисосудистые (реологические). Системный спазм артериол и прекапиллярных сфинктеров приводит к переходу крови из артериол в венулы по анастомозам, минуя капилляры. Это ведет к нарушению перфузии тканей, развитию гипоксии и ацидоза, что в свою очередь, вызывает расслабление прекапиллярных сфинктеров, а менее чувствительные к ацидозу посткапиллярные сфинктеры остаются спазмированными. В итоге в капиллярах скапливается кровь, часть которой выключается из кровообращения, гидростатическое давление в них растет, что стимулирует транссудацию жидкости в окружающие ткани, и ОЦК при этом уменьшается. Параллельно с этими изменениями наступают нарушения реологических свойств крови, обусловленные, прежде всего, резким усилением внутрисосудистой агрегации эритроцитов, связанной с замедлением скорости кровотока, увеличением концентрации высокомолекулярных белков, повышением адгезивной способности самих эритроцитов, снижением рН крови. Наряду с агрегацией эритроцитов
