
Дополнительные учебные материалы / Аутоиммунная_агрессия
.pdf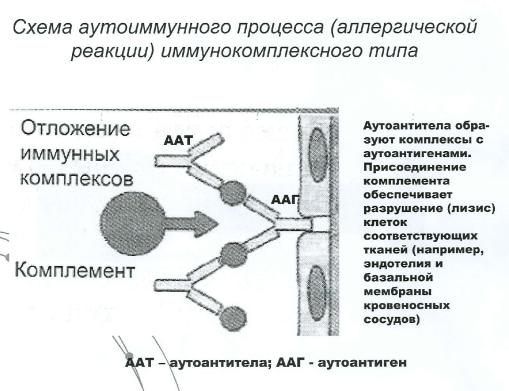
Общая патофизиология Лекция для студентов 3-го курса, специальности:
«лечебное дело», «стоматология»
Патогенетические механизмы измененного и неэффективного иммунитета (аутоиммунная агрессия и противоопухолевый иммунитет)
I.План лекции
1.Понятие об аутоиммунитете и об аутоиммунных заболеваниях
2.Главный комплекс гистосовместимости и его роль в формировании иммунного ответа
3.Гипотезы, объясняющие срыв иммунологической толерантности и развитие аутоиммунитета
4.Особенности противоопухолевого иммунитета
II. Аутоиммунитет характеризуется потерей (нарушением) толерантности к собственным антигенам. В результате цитотоксические клетки или вырабатывающиеся антитела начинают разрушать клетки и ткани организма.
Все аутоиммунные заболевания можно разделить на две основные группы:
- органоспецифические аутоиммунные заболевания (например, миасте-
ния, тиреоидит Хашимото); - системные аутоиммунные заболевания (например, системная красная
волчанка, ревматоидный артрит, рассеянный множественный склероз).
III. Механизмы аутоагрессии

2
IV. Главный комплекс гистосовместимости и его роль в формиро-
вании иммунного ответа
Главный комплекс гистосовместимости – MHC (Major Histocompatibility Complex) – может быть представлен в клетках в двух видах: в виде группы генов (примерно 50 генов), расположенных у человека в 6 хромосоме, или в виде полипептидных молекул, размером от 9 – 11 до 13 – 30 аминокислотных остатков, кодируемых этими генами, встраиваемыми в мембрану клеток и становящимися рецепторами. Для каждого вида установлены свои наименования МНС. Так для человека он носит название HLA – Human Leukocyte Antigens, для собак – DLA, для мышей – Н2 и т.д.. Имеется два основных вида МНС: МНС-I и МНС-II. Белки системы МНС играют весьма важную роль в осуществлении иммунологического процесса. Во-первых, молекулы МНС класса I (MHC-I), встроенные в мембрану всех ядерных клеток человека, соединяются с процессированными собственными цитозольными белками и служат сигналом, благодаря которому иммунная система отличает «свои» клетки от «чужих», или превратившихся в «чужие» в результате мутаций. Кроме того, молекулы МНС-I способны «выставлять» на мембране клеток процессированные чужеродные внутриклеточные антигены, например, вирусные антигены. В этом случае, равно как и при представлении процессированных измененных в результате мутации собственных цитозольных белков, они распознаются Т-киллерами и клетка уничтожается. Во-вторых, молекулы МНС класса II (MHC-II) представляют (презентируют) чужеродные внеклеточные антигены, проникшие в организм, поглощенные и процессированные антигенпредставляющей клеткой (например, моноцитом-макро-

3
фагом) соответствующим клеткам иммунной системы для его распознавания и запуска процесса формирования иммунного ответа.
Формирование иммунного ответа
В процессе формирования и реализации иммунного ответа можно выделить несколько этапов.
1. Распознавание и процессинг антигена.
Первой клеткой, участвующей в распознавании антигена, является фагоцит. Роль последнего заключается не только в уничтожении патогенного микроорганизма, но и в запуске многокомпонентной иммунной реакции, заканчивающейся выработкой антител, предназначенных для антигена (антигенов), которых несет данный микроорганизм.
После захвата и погружения микробной клетки в протоплазму фагоцита, вокруг нее образуется фагосома, в которую лизосомы «вспрыскивают» соответствующие ферменты, под влиянием которых вещество микробной клетки разрушается до отдельных пептидов. Учитывая участие лизосом в этом процессе, фагосому часто называют еще и «фаголизосомой». Нужно подчеркнуть, что подобному процессу обработки подвергаются не только целые микробные клетки, но и вирусные частицы, токсины микробов, высокомолекулярные белки и полисахариды (например, поступающие в организм при вакцинации).
4
«Разборка» высокомолекулярных веществ в фагоците на отдельные составляющие (полипептиды) и дальнейшее использование их в формировании иммунного ответа, получило название «процессинга».
Одновременно с процессингом антигена в фагоците начинается синтез молекул главного комплекса гистосовместимости (МНС), которые, окруженные специальной вакуолью, проникают в фагосому. В фагосоме происходит объединение молекулы МНС с бактериальным пептидом. Созданный комплекс экспрессируется на поверхности макрофага. Кроме того, процессированный антиген может быть экспрессирован на поверхности макрофага и вне связи с молекулами МНС.
2. Распознавание антигена Т-хелпером.
Представление процессированного антигена Т-хелперу (фактически – запуск программы дальнейшей деятельности Т-хелпера) осуществляется за счет контакта комплекса: молекула МНС фагоцита – процессированный антиген с антигенраспознающим рецептором Т-хелпера. В процессе распознавания антигена принимают участие и корецепторы Т-клеток: CD4 у Т-хелпе- ров или CD8 у Т-супрессеров и других цитотоксических лимфоцитов.
Активированный Т-хелпер способен передать сигнал далее – на В-лим- фоцит. Передача сигнала осуществляется через антигенраспознающий рецептор Т-хелпера и МНС В-лимфоцита.
3. Активация В-лимфоцита и подготовка его к клонированию.
Запуск этого процесса возможен только в том случае, если В-лимфоцит получает двойной сигнал: от Т-хелпера через его антигенраспознающий рецептор и МНС В-лимфоцита, и от своего иммуноглобулинового рецептора, распознавшего экспрессированный на поверхности макрофага антиген.
4. Клонирование В-лимфоцитов и выработка антител.
В-лимфоцит, получивший двумя путями информацию о качестве и структуре антигена (через Т-хелпер и через свой иммуноглобулиновый рецептор), начинает процесс клонирования. После трансформации клона в плазматические клетки, последними начинается синтез огромного количества антител, имеющих специфическое сродство к распознанному антигену.
5. Роль цитокинов в формировании и реализации иммунного ответа.
В процессах активации иммунокомпетентных клеток большую роль играют многие цитокины. К ним можно отнести интерлейкины 1, 2, 4 (ИЛ-1, ИЛ-2, ИЛ-4), фактор активации макрофагов (ФАМ), гамма-интерферон и некоторые другие. Цитокины по принципу прямой и обратной связи активируют иммунокомпетентные клетки и способствуют передаче информации о процессированном антигене от фагоцитов (макрофагов) к конечным исполнителям иммунного ответа – плазматическим клеткам.

5
V.Гипотезы, объясняющие срыв (нарушение, потерю) толерантности и развитие аутоиммунитета
6
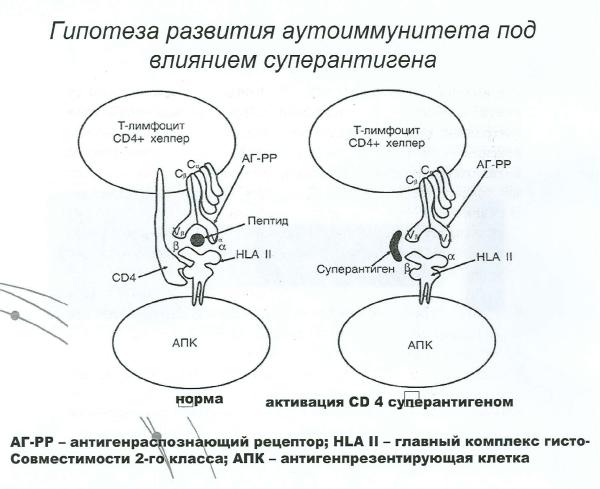
Гипотеза развития аутоиммунитета под влиянием суперантигенов. Свойства суперантигенов
1.К суперантигенам относятся энтеротоксины стафилокков, токсины стрептококков, а также суперантигены вирусов бешенства, СПИДа, вируса Эпштейн-Барра и др..
2.Суперантигены способны вызывать поликлональную активацию аутореактивных Т- и В-лимфоцитов, что обеспечивает развитие аутоагрессии.
3.Поликлонально активированные Т-хелперы после контакта с суперантигенами гибнут путем аоптоза. Это обстоятельство способствует развитию иммунодефицитов
Гипотеза «мимикрии» антигенов микроорганизмов
1.В процессе эволюции некоторые микроорганизмы становятся способными изменять свои антигены и делать их подобными (гомологичными) антигенам макроорганизма
2.Измененные антигены микроорганизмов не распознаются иммунной системой как чужеродные и микроорганизмы не уничтожаются
3.Распознавать измененные антигены микроорганизмов способны только «запретные клоны» аутореактивных лимфоцитов, избегших деплеции (выбраковки, уничтожения) в процессе созревания
7
4. Однако же, эти лимфоциты способны инициировать и аутоагрессивные состояния
Гипотеза нарушений иммунологической регуляции
1. Нарушение функции Т-супрессоров
Одной из функции Т-супрессоров является их способность подавлять деятельность аутореактивных В-лимфоцитов по выработке ими аутоантител. Повреждение Т-супрессоров может провоцировать аутоагрессию
2. Нарушение функции Т-хелперов
При повышении активности Т-хелперов возможна активация ими аутореактивных В-лимфоцитов даже при нормальной функции Т-супрессоров. В результате возможна провокация аутоагрессии
Гипотеза изменения аутоантигенов под влиянием факторов внешней и внутренней среды
В антигенном плане любая белковая субстанция состоит из неспецифического ядра (шлеппера) и специфических детерминантных групп. Под действием повреждающего фактора может произойти изменение некоторых детерминантных групп, в результате чего белок собственной ткани организма превратился в аутоантиген и стал специфическим раздражителем иммунной системы.
Оправомерности возникновения такой реакции свидетельствуют данные
отом, что граница между «своим» и "чужим" в иммунологическом отношении проводится в организме чрезвычайно точно: даже вещества со сходной стереохимической структурой "узнаются" безошибочно (например, антигены, определяющие группы крови и отличающиеся только одной - двумя концевыми остатками моносахаридов).
На появление аутоантигенов организм отвечает образованием аутоантител, количество которых согласно особенностям протекания иммунологических реакций в десятки раз превышает число молекул антигенов. Циркулирующие в крови аутоантитела реагируют комплиментарными детерминантными группами с антигенами нормальных тканей, вызывая их повреждение с повторным выходом аутоантигенов в кровь и развитием цепной реакции повреждения.
Вкачестве факторов, вызывающих образование вторичных аутоантигенов, могут выступать микробы, их токсины, физические и химические воздействия (травма, высокие и низкие температуры, проникающая радиация, медикаментозные препараты, промышленные яды и др.).
Следует отметить, что образовавшийся в организме аутоантиген может в дальнейшем вызвать два типа ответных реакций. Во-первых, согласно теории М.Барнета, он может взаимодействовать с лимфоидной клеткой, заставляя ее делиться, в результате чего в организме возникает новый клон лимфоцитов, несущих антитела к данному антигену.

8
Во-вторых, аутоантиген, контактируя с клетками лимфоидной ткани, может повышать их чувствительность по отношению к себе, включая, таким образом, механизмы клеточного иммунитета.
VI. Противоопухолевый иммунитет Факторы противоопухолевого иммунитета
1. |
Т-лимфоциты «киллеры» |
|
2. |
Лимфоциты «натуральные киллеры» (ЕК-клетки) |
|
3. |
Активированные макрофаги |
|
4. |
Специфические противоопухолевые антитела |
|
5. Различные цитокины (в частности, ФНОα, способный |
индуциро- |
|
вать апоптоз опухолевых клеток) |
|
|
Процесс апоптоза опухолевой клетки может инициироваться внешними сигналами, которые одна клетка передает другой. Роль сигнальных молекул в этом случае играют некоторые цитокины (фактор некроза опухолей альфа -
ФНОα, фактор некроза опухолей бета, он же лимфотоксин - ФНОβ, фактор роста нервов и некоторые другие). Значение этого вида апоптоза, который получил название «инструктивного» весьма велико для нормальной деятельности, прежде всего, иммунной системы (противоопухолевый иммунитет, защита естественных антигенов, например, семенников или хрусталика глаза от иммуноцитов организма и т.п.).
9
Интересна история открытия цитокина ФНОα. В конце XVIII века врачами было замечено, что у некоторых пациентов исчезали злокачественные опухоли после перенесения ими инфекционного заболевания. В начале ХХ века американский врач W.Coley пытался лечить онкологических больных вводя им препараты, полученные фильтрованием культур грамм-положи- тельных и грамм-отрицательных бактерий. В некоторых случаях эта терапия приводила к успеху. В дальнейшем, уже в середине ХХ века после открытия липополисахарида - вещества, входящего в состав мембран микробных клеток, было показано, что это вещество способно индуцировать некроз опухолей. Однако в 1975 году благодаря работам L.Old и его коллег стало ясно, что некроз опухолей вызывает не сам липополисахприд, но некий белковый фактор, который вырабатывается макрофагами при их контакте с бактериями. Этот белковый фактор и получил название «фактор некроза опухолей». К концу ХХ века стало ясно, что ФНО вырабатывается не только активированными макрофагами, но и Т-лимфоцитами, нейтрофилами, тучными клетками, астроцитами и клетками – натуральными киллерами (NK-клетками). В настоящее время твердо установлено, что ФНО способен индуцировать апоптоз самых различных клеточных структур, в том числе – и опухолевых клеток. Кроме того, являясь провоспалительным цитокином, ФНО способен вызывать и некроз клеток как результат их гибели в очаге воспаления.
Важным элементом механизма инструктивного апоптоза являются рецепторы клетки, способные соединяться с указанными цитокинами. Эти рецепторы (белковые макромолекулы) принадлежат к суперсемейству рецепторов фактора некроза опухолей альфа и, в силу их особой функции, получили название «рецепторов смерти» (Death Receptors). Внутрицитоплазматическая часть этих рецепторов получила название «доменов смерти». После соедине-
ния с этими рецепторами их лиганд (ФНОα, ФНОβ и других) активированный домен смерти при посредстве сложной ферментной системы (адапторного белка) осуществляет автокаталитический процессинг прокиназ, которые, в свою очередь, активирую киназы, входящие в состав каскада «казнящих киназ». Их ферментативное воздействие и осуществляет апоптоз по уже известной схеме.
Следует иметь в виду, что определенную роль в активации киназного каскада играют ионы Са++, которые проникают в клетку через кальциевые каналы, открытию которых так же способствует активация рецепторов смерти.
Продолжение лекции смотри на следующей странице

10
Апоптоз («программированная гибель клетки») – это мощная защитная система организма, реализуемая на клеточном уровне, и способная предотвратить появление «потомства» клетки, обладающего вредными для организма качествами. Понятие «вредное качество» в полной мере относится к возможности возникновения в организме клеток, получивших в результате мутаций способность к безудержному размножению без явления созревания, то есть клеток злокачественных опухолей.
Повреждение генома клетки, в том числе и ее малигнизация, может быть вызвана различными факторами. Во-первых, это всевозможные повреждения клетки (воспаление, гипоксия, тепловая травма, радиационные повреждения и т.п.). Во-вторых, - это нерегулируемое воздействие на клетку всевозможных факторов роста, а также различных канцерогенов (включая вирусные канцерогены). Защита клетки от злокачественного перерождения обеспечивается семейством опухолевых супрессоров (белков), главную роль среди которых играет белок р53, который и является основным инициатором апоптоза.
Факторы иммунорезистентности опухолей
1.Постоянное изменение антигенного состава опухолевых клеток
2.Шеддинг («слущивание») молекул комплекса МНС 1-го класса с мембран опухолевых клеток
