
- •Таблица 3
- •Удельная теплоемкость стекла (Ст) равна 0,753 Дж/г·град, раствора (Ср) – 4,184 Дж/г·град, ρ – плотность раствора – 1 г/мл, V и С – объем и молярная концентрация кислоты (основания).
- •РАБОТА 8. БУФЕРНЫЕ СИСТЕМЫ
- •Таблица 8
- •Таблица 9
- •ЦЕЛЬ ЗАНЯТИЯ:
- •ОПЫТ 1. Определение поверхностной активности веществ
- •ОПЫТ 3. Зависимость величины адсорбции от природы сорбента
- •ОПЫТ 4. Зависимость величины адсорбции от природы растворителя
- •ОБРАЗЕЦ ОТВЕТА НА КОНТРОЛЬНЫЕ ВОПРОСЫ:
- •ЦЕЛЬ ЗАНЯТИЯ:
- •ЗАДАНИЕ:
- •Таблица 19
- •КОНТРОЛЬНЫЕ ВОПРОСЫ:
- •ЛИТЕРАТУРА:
- •Таблица 21
ГОУ ВПО УРАЛЬСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
Под редакцией профессора Ореховой А.И.
Рекомендовано Учебно-мето- дическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
(УМО-265 12.05.06)
Екатеринбург, 2009
Практикум по общей химии для студентов всех факультетов.
Изд. П, переработанное и дополненное./ Под редакцией проф. Ореховой А.И. – Екатеринбург: УГМА, 2009.
При подготовке врачей большое внимание уделяется теоретическому и практическому изучению многих разделов химии. Химия, как основа всех биологических процессов, входит в число наук, составляющих фундамент медицины. Химические методы исследования и анализа постоянно применяются в диагностике заболеваний и при профилактических обследованиях. Химический синтез является основой для изготовления лекарств. В данном практическом руководстве приведены лабораторные работы, помогающие освоению теоретических основ химии. Практикум написан в соответствии с программой по курсу общей химии для студентов медицинских институтов.
В составлении практикума принимали участие: Р.П.Лелекова И.И.Ильяшевич В.Е.Кротов Г.Н.Моисеева Т.М.Вовнова Т.А.Афанасьева
2
© Уральская государственная медицинская академия, 2009
3
СОДЕРЖАНИЕ |
|
Предисловие ................................................................................ |
5 |
РАБОТА 1. Определение эквивалента металла ...................... |
6 |
РАБОТА 2. Приготовление раствора определенной |
|
концентрации ............................................................................. |
9 |
РАБОТА 3. Измерение теплового эффекта |
|
реакции нейтрализации ............................................................ |
12 |
РАБОТА 4. Скорость химической реакции ............................. |
15 |
РАБОТА 5. Химическое равновесие ......................................... |
18 |
РАБОТА 6. Получение комплексных соединений .................. |
21 |
РАБОТА 7. Окислительно-восстановительные свойства |
|
соединений марганца ................................................................ |
24 |
РАБОТА 8. Буферные системы ................................................. |
27 |
РАБОТА 9. Поверхностные явления. Адсорбция ................... |
32 |
РАБОТА 10. Хроматография ..................................................... |
36 |
РАБОТА 11. Структурообразование, изоэлектрическая |
|
точка белков ............................................................................... |
43 |
РАБОТА 12. Химические свойства металлов и сплавов ....... |
48 |
РАБОТА 13. Метод комплексонометрии. Определение |
|
общей жесткости воды (для медико-профилактического |
|
факультета) .................................................................................. |
51 |
РАБОТА 14. Метод комплексонометрии. Определение |
|
содержания кальция в плазме крови (для лечебно- |
|
профилактического и педиатрического факультетов)................. |
54 |
РАБОТА 15. Метод комплексонометрии. Определение |
|
содержания кальция в слюне (для стоматологического |
|
факультета) ................................................................................... |
57 |
РАБОТА 16. Метод оксидиметрии. Определение |
|
окисляемости воды методом перманганатометрии |
|
(для медико-профилактического факультета) ............................ |
60 |
РАБОТА 17. Метод оксидиметрии. Определение |
|
массовой доли пероксида водорода в растворе |
|
методом перманганатометрии (для лечебно- |
|
профилактического и педиатрического факультетов) ................ |
63 |
4
РАБОТА 18. Метод йодометрии. Определение |
|
содержания аскорбиновой кислоты в препарате |
|
(для лечебно-профилактического, стоматологического, |
|
педиатрического факультетов) .................................................... |
66 |
РАБОТА 19. Метод йодометрии. Определение |
|
содержания свободного хлора в воде (для медико- |
|
профилактического факультета) ................................................. |
68 |
РАБОТА 20. Фотоколориметрия. Определение |
|
содержания Fe (III) в минерализованной плазме крови |
|
(для лечебно-профилактического и педиатрического |
|
факультетов) ................................................................................ |
70 |
РАБОТА 21. Фотоколориметрия. Определение |
|
содержания Fe (III) в питьевой воде (для медико- |
|
профилактического факультета) ................................................. |
72 |
РАБОТА 22. Потенциометрический метод |
|
определения нитратов в овощах и фруктах |
|
(для медико-профилактического факультета) ............................ |
74 |
РАБОТА 23. Определение активной и общей |
|
кислотности желудочного сока методом |
|
потенциометрического титрования (для лечебно- |
|
профилактического и педиатрического факультетов) ................ |
78 |
РАБОТА 24. Теория произведения растворимости. |
|
Образование осадков в организме человека и их |
|
растворение ................................................................................ |
81 |
РАБОТА25. Получение дисперсных систем ............................ |
84 |
РАБОТА 26. Сравнительная устойчивость и методы |
|
осаждения различных дисперсных систем ............................. |
88 |
РАБОТА 27. Растворы электролитов. Методы |
|
определения рН биологических жидкостей ............................ |
94 |
РАБОТА 28. Метод кондуктометрии. Определение |
|
электрической проводимости желудочного сока ................... |
98 |
5
ПРЕДИСЛОВИЕ
Практикум содержит информацию о подготовке и проведении лабораторно-практических занятий по 10 темам.
К каждому занятию предпослано краткое обоснование изучения данной темы для формирования будущего специалиста-медика; указывается цель занятия, где дается представление о том, какие знания и умения должен приобрести студент на занятии. Контрольные вопросы ориентируют студента в самостоятельной работе с литературой, помогают лучше усвоить материал.
При подготовке к занятию рекомендуется пользоваться следующей литературой:
1.Ю.А.Ершов, В.А.Попков, А.С.Берлянд. Общая химия. М.: Высшая школа, 1993.
2. А.С.Ленский. Введение в бионеорганическую |
и |
биофизическую химию. М.: Высшая школа, 1989. |
|
3.М.И.Равич-Щербо, В.В.Новиков. Физическая и коллоидная химия. М.: Высшая школа, 1980.
4.А.В.Бабков и др. Практикум по общей химии с элементами количественного анализа. М.: Высшая школа, 1978.
5.А.И.Орехова, Р.П.Лелекова. Задачи и упражнения по общей и
бионеорганической химии. Под ред. А.И.Ореховой. Екатеринбург: УГМА, 2007.
6.В.И.Слесарев. Химия. Основы химии живого. С.-Пб.: Химиздат, 2000.
Письменное задание к занятию включает в себя вопросы и задачи для проверки усвоения материала, в то же время обязательное выполнение домашнего задания – это одна из форм самостоятельной работы студентов.
Лабораторная работа представлена описанием опытов и методическим указанием к их проведению. Лабораторная работа выполняется каждым студентом индивидуально. Для более глубокого осмысления лабораторной работы и экономии времени на занятии необходимо в процессе подготовки к занятию прочитать описание опытов, заготовить таблицы.
6
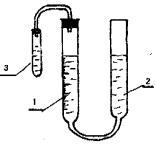
РАБОТА 1. ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА МЕТАЛЛА
Закон эквивалентов является одним из основных законов химии; используется при приготовлении реактивов и количественном определении веществ титриметрическим методом.
Закон эквивалентов имеет большое значение при анализе чистоты лекарственных препаратов, анализе питьевых и сточных вод, различных биологических жидкостей, при диагностике и контроле за ходом лечения ряда заболеваний.
ЦЕЛЬ ЗАНЯТИЯ:
Усвоить понятие эквивалента, ознакомиться с практическим расчетом эквивалента металла на основании экспериментальных данных по выделению им водорода из раствора кислоты.
ЗАДАНИЕ:
Проведите экспериментальное определение эквивалента металла по выделению им водорода из раствора кислоты. По величине эквивалента и его степени окисления назовите металл. Составьте отчет.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
1.Соберите установку (рис. 1).
2.Получите у преподавателя навеску металла в папиросной бумаге, смочите ее водой и приклейте к внутренней стенке пробирки над кислотой, плотно присоедините пробирку к
прибору.
3. Проверьте герметичность прибора. Для этого опустите уравнительный сосуд так, чтобы уровень воды в нем был ниже уровня в бюретке, и закрепите его в штативе. Если через 1-3 мин понижения уровня воды в бюретке не произойдет, прибор герметичен.
Рис. 1
1)бюретка с водой;
2)уравнительный сосуд с водой;
7
3) пробирка с кислотой (5 мл H2SO4 Cэ=3 моль экв/л)
8
4.Установите уравнительный сосуд так, чтобы уровни в нем и бюретке были одинаковы, показания бюретки запишите. Встряхните пробирку так, чтобы металл попал в кислоту. Начинается выделение водорода, уровень воды в бюретке понижается. Дайте выдержку 10-15 мин, чтобы газ принял температуру окружающей среды.
5.Приведите к одному уровню воду в бюретке и уравнительном сосуде. Если он не изменяется, запишите новое показание бюретки. Данные для расчета запишите по форме (табл. 1)
m - масса металла, г,
V1 - показание бюретки до реакции, мл, V2 - показание бюретки после реакции, мл,
(V1-V2) - объем выделившегося водорода, мл,
Т
Р
РН
РН2
-температура опыта, К,
-атмосферное давление, мл рт ст.,
О- давление насыщенного пара воды возьмите из [5],
Р РН О – парциальное давление водорода.2 2
Объем выделившегося водорода при нормальных условиях рассчитайте по уравнению Менделеева-Клапейрона:
Р |
|
V |
|
P V |
; |
V |
|
P V T |
|
о |
o |
|
o |
||||
|
|
|
|
|
|
|||
|
T |
|
T |
|
o |
|
T P |
|
|
|
|
|
|
||||
|
|
o |
|
|
|
|
|
o |
Эквивалент металла рассчитайте по закону эквивалентов, зная
V0:
m |
|
|
V |
|
|
|
|
m |
Me |
V |
|
|
|
|
; |
Э |
|
|
|
Э |
|
||||
|
Me |
|
o |
|
|
|
|
H2 |
||||
|
|
|
|
|
|
|
|
|
|
|||
Э |
|
|
V |
|
|
|
Ме |
|
|
V |
|
|
Ме |
|
|
|
|
|
|
|
|
||||
|
|
Э |
H |
|
|
|
|
|
|
o |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
6.Запишите уравнение реакции взаимодействия металла с кислотой. Назовите металл, зная величину его эквивалента и степень окисления, равную 2.
7.Сравните полученное и теоретическое значения эквивалента металла, рассчитайте относительную ошибку по формуле:
% Этеор. Ээксп. 100
Этеор.
9
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Как рассчитать эквивалент элемента, зная его атомную массу, степень окисления?
2.Рассчитайте ЭAl в Al2О3; ЭCr в Cr2(SO4)3.
3.При действии НСl на 6 г металла выделится 5,6 л водорода
(н.у.). Определите молярную массу атома металла, если степень окисления его равна 2.
4.На сжигание 1 г металла требуется 560 мл кислорода. Найдите эквивалент металла.
5.Соединение кремния с кислородом содержит 47% кремния. Вычислите эквивалент кремния и степень его окисления.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
||
|
|
|
|
|
ФОРМА ОТЧЕТА |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
Название работы |
|
|
|
|
|
|
|
||||
металлаМасса, г |
|
Показания бюретки, мл |
ОбъемН2, мл |
,ТК |
Давление, |
|
|
ОбъемН2 |
.),у.н( мл |
|
ЭМе, |
Относительная ошибка, % |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
мм рт ст. |
|
|
|
|
г/моль |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
до реакции |
|
после реакции |
|
|
|
атмосферное |
нас. пара воды |
Н2 |
|
|
|
эксперимент. |
|
теоретич. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
3 |
4 |
5 |
|
6 |
7 |
8 |
|
9 |
|
10 |
|
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение химической реакции: Формулы для расчетов:
ЛИТЕРАТУРА:
4. С. 27-32.
10
РАБОТА 2. ПРИГОТОВЛЕНИЕ РАСТВОРА ОПРЕДЕЛЕННОЙ КОНЦЕНТРАЦИИ
Важной характеристикой раствора является его концентрация. Многие лекарственные препараты используются в виде растворов определенной концентрации. Пищевые продукты характеризуются различным количественным содержанием компонентов. Нормальная жизнедеятельность организма невозможна без поддержания постоянной концентрации компонентов во внутриклеточных и тканевых жидкостях организма. Знание этой темы необходимо при изучении биохимии, физиологии, фармакологии, клинических и санитарно-гигиенических дисциплин.
ЦЕЛЬ ЗАНЯТИЯ:
Научиться пользоваться мерной посудой (мерные колбы, пипетки, бюретки). Научиться готовить растворы путем разбавления. Научиться титровать.
ЗАДАНИЕ:
1.Рассчитайте объем исходной концентрированной кислоты, необходимый для приготовления более разбавленного раствора.
2.Приготовьте заданный раствор.
3.Установите точную концентрацию приготовленного раствора.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ
РАБОТЫ:
1.Получите конкретное задание от преподавателя. Запишите в отчете.
2.Измерьте в цилиндре ареометром плотность исходного концентрированного раствора. Запишите в отчете.
3.По таблице справочника установите массовую долю (ώ, %) кислоты. Запишите в отчете.
4.Рассчитайте по формулам: сколько мл исходной концентрированной кислоты потребуется для приготовления раствора заданной концентрации в заданном объеме. Формулы:
% |
mв ва |
100, |
m |
в ва |
Vмл |
||||||||||||
Vмл |
|||||||||||||||||
|
|
|
|
|
|
|
|
100 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
С |
Э |
|
|
mв ва |
|
, mв ва C |
Э |
|
1 |
|
Mв ва Vл |
||||||
|
Vл |
1 |
Mв ва |
|
z |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
z |
|
|
|
|
11 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||

В результате разбавления масса растворенного вещества не изменяется, следовательно:
|
|
|
|
|
|
|
|
|
100C |
Э |
|
1 |
M |
|
V |
% V |
|
|
1 |
|
|
|
|
|
|
|
в ва |
||||
CЭ |
M |
|
V |
, |
V |
|
|
|
z |
|
л |
||||
мл |
|
|
в ва |
|
|
|
|
|
|||||||
100 |
|
|
z |
|
л |
|
мл |
|
|
% |
|
||||
|
|
|
|
|
|
|
|
|
|
||||||
5. Проверьте результат расчета у преподавателя.
6. Отмерьте с помощью бюретки (на столе общего пользования) рассчитанный объем кислоты в мерную колбу.
7. Разбавьте дистиллированной водой, перемешайте. Долейте дистиллированной водой до метки. Снова перемешайте.
8. Перенесите пипеткой в три конические колбы по 10 мл приготовленного раствора кислоты. Добавьте в них по 1-2 капли фенолфталеина.
9. Приведите бюретку в рабочее состояние. Заполните ее титрованным раствором щелочи.
10. Оттитруйте три пробы приготовленного раствора кислоты. Конец титрования определите по появлению слабо розового
окрашивания. Результаты занесите в табл. 2. |
С |
Э |
V |
C |
Э |
V |
|
11. Исходя из закона эквивалентов, по формуле |
|||||||
|
|
|
|
||||
1 |
1 |
|
2 |
2 |
|||
|
|
||||||
рассчитайте точную молярную концентрацию эквивалента приготовленного раствора кислоты (точность: три значащих цифры после запятой). Результаты расчета занесите в отчет.
12. Сделайте вывод о точности приготовленного Вами раствора
кислоты. Для |
|
этого рассчитайте относительную ошибку |
|||
С |
Э |
|
С |
Э |
приготовления: |
зад. |
приг. |
||||
|
|
|
Э |
100,% |
|
|
|
С |
|
|
|
|
|
|
зад. |
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Почему для растворов кислот НСl, НNO3 молярная и молярная концентрации эквивалента совпадают, а для Н2SO4 и Н3РО4 нет?
2.Во сколько раз молярная концентрация эквивалента выше молярной концентрации для растворов Са(NO3)2, АlCl3, Fe2(SO4)3?
3.Запишите формулы расчета титра раствора, если известна его
молярная концентрация эквивалента.
12
4.Выразите состояние эквивалентности при взаимодействии растворов всеми возможными способами.
5.Что такое титрование? С какой целью проводится?
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исходная кислота |
|
|
Приготовленный раствор кислоты |
|
Результаты титрования |
|
Концентрация по результатам титрования |
Относительная ошибка |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
ρ, г/мл |
ω % |
V, мл |
V, мл |
|
Сэ, моль экв/л |
Vк-ты, мл |
Vщ , мл |
|
Vщ , мл |
Сэ, моль экв/л |
ω, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛИТЕРАТУРА:
1. С. 48-49; 2. С. 94-96; 4. С. 77-93, 98-103, 109-110; 5. С. 38-47; 6. С. 135-139.
13
РАБОТА 3. ИЗМЕРЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
Определение тепловых эффектов химических процессов является задачей термохимии. Термохимические методы имеют большое значение не только в химических, но и в медикобиологических науках. Энергия, необходимая живым организмам для совершения работы, поддержания постоянной температуры тела и т.д., получается за счет экзотермических реакций окисления, протекающих в клетках. Запас окисляющихся веществ (углеводов, жиров) постоянно возобновляется при приеме пищи. Пищевые рационы, необходимые человеку при различных условиях труда и жизни, определяются с учетом теплотворной способности пищевых продуктов.
ЦЕЛЬ ЗАНЯТИЯ:
Овладеть методикой калориметрического метода измерения теплового эффекта реакции нейтрализации и расчета энтальпии нейтрализации.
ЗАДАНИЕ:
Выполните три лабораторных опыта, результаты запишите в таблицу. Составьте отчет по теме.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
Во взвешенный калориметрический стакан поместите 50 мл 1,0 М раствора основания и измерьте его температуру. В отдельный стакан отмерьте 50 мл 1,0 М раствора кислоты и запишите показания термометра. Затем через воронку влейте раствор кислоты в калориметр. Отметьте самую высокую температуру, которую покажет термометр после сливания растворов.
Определение проведите два раза с сильными кислотами и основаниями и один раз со слабыми. Начинайте определение со слабых:
NH3 aq + CH3COOH aq = CH3COONH4 aq, |
ΔH1 |
< 0 |
NaOH aq + HCl aq = NaCl aq + H2O ж, |
ΔH2 |
< 0 |
KOH aq + HNO3 aq = KNO3 aq + H2O ж, |
Н3 |
< 0 |
14
Результаты занесите в табл. 3.
Таблица 3
Наименование величины |
1 |
2 |
3 |
Масса калориметрического стакана, m, г |
|
|
|
Концентрация растворов, С, моль/л |
|
|
|
Объем каждого раствора, V, мл |
|
|
|
Температура основания, tосн., оС |
|
|
|
Температура кислоты, tк., оС |
|
|
|
Начальная температура, t1=0,5(tосн.+tк.), оС |
|
|
|
Температура нейтрализации, t2, оС |
|
|
|
Общая масса растворов, m2 = 2Vρ, г |
|
|
|
Энтальпия нейтрализации, ∆Нонейтр., Дж/моль |
|
|
|
По результатам опытов вычислите энтальпию нейтрализации 1 моля кислоты (основания) по формуле:
|
|
|
t C |
; |
|
нейтр. |
V(л) М |
||||
|
|
|
|||
|
|
|
|
||
где |
|
t = t2 – t1 |
|
||
C – теплоемкость калориметрической жидкости и всех соприкасающихся с ней частей калориметра: стакана, мешалки, термометра:
С = ΣСi·mi , так что С = С1·m1 + C2·m2
Удельная теплоемкость стекла (Ст) равна 0,753 Дж/г·град, раствора (Ср) – 4,184 Дж/г·град, ρ – плотность раствора – 1 г/мл, V и С – объем и молярная концентрация кислоты (основания).
ВЫВОДЫ:
1.Объясните, почему реакция нейтрализации 1 моля любой
сильной одноосновной кислоты (НС1, HNO3 и т.п.) сильными основаниями (NaOH, KOH и т.п.) в достаточно разбавленных водных растворах сопровождается почти одинаковым экзотермическим тепловым эффектом, при 298 К незначительно отклоняющимся от -55,900, при 291 К -57,363 кДж/моль.
2.Объясните, почему для слабых электролитов в реакции нейтрализации выделяется значительно меньшее количество теплоты.
15
КОНТРОЛЬНЫЕ ВОПРОСЫ: |
|
|
|
1. Исходя из значений |
Но реакций: |
|
|
MgO k + 2H+aq = Mg2+aq + H2O ж, |
Но1 |
= -145,6 кДж |
|
Н2О ж = Н+aq + OH-aq |
|
ΔHo2 |
= 57,5 кДж, |
вычислите значение |
Но3 для |
реакции растворения оксида |
|
магния в воде: |
|
|
|
MgOk + H2Oж = Mg2+aq + 2OH-aq , |
ΔHo3 |
|
|
Cокращение «aq» обозначает разбавленный водный раствор.
2. Используя значения стандартных энтальпий образования СО2 и MgO, равных соответственно -393,5 и -601,8 кДж/моль, вычислите Но реакции: 2Mgk + CO2 г = 2MgOk + Cт
3. Вычислите стандартное изменение энтальпии реакции:
Ст + 2Н2 г + ½ О2 г = СН3ОНж, если стандартные энтальпии сгорания С, Н2 и СН3ОН равны соответственно -395, -286, - 712 кДж/моль.
ЛИТЕРАТУРА:
1. С.16-21; 2. С. 17-22; 4. С. 51-56; 5. С. 6-14; 6. С. 73-84.
16
РАБОТА 4. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Изучение скорости химической реакции и влияния различных факторов (температуры, катализатора, концентрации реагирующих веществ) необходимо для понимания протекания биохимических процессов в организме. Основная задача химической кинетики – управление химическим процессом, направленное влияние на его скорость.
ЦЕЛЬ ЗАНЯТИЯ:
Научиться устанавливать закономерности влияния на скорость химической реакции концентрации реагирующих веществ и температуры. Научиться экспериментально определять относительную скорость реакции.
ЗАДАНИЕ:
Выполните два лабораторных опыта. Составьте отчет по теме.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
ОПЫТ 1. Зависимость скорости реакции от концентрации
В пять пробирок налейте из бюретки 0,1 М раствор Na2S2O3, 1, 2, 3, 4, 5 мл и добавьте соответственно 4, 3, 2, 1, 0 мл воды (в сумме в одной пробирке 5 мл). В другие пять пробирок налейте по 5 мл 1 М раствор H2SO4. Вылейте в стакан 5 мл H2SO4 и прилейте Na2S2O3 из одной пробирки. Отсчитайте время в секундах от момента сливания растворов до начала появления помутнения (выпадения серы). Такой опыт проделайте для всех пяти растворов Na2S2O3.
|
|
|
|
|
|
|
|
Таблица 4 |
||
№ |
VNa S O |
, |
VH O , |
VH SO |
, |
Время |
Относит. |
|
||
пробирк |
2 |
2 |
3 |
2 |
2 |
4 |
τ, с |
скорость, |
|
|
|
|
|
|
|
||||||
и |
мл |
|
мл |
мл |
|
|
1/τ, с |
-1 |
|
|
|
|
|
|
|
|
|
|
|
||
1 |
1 |
|
|
4 |
5 |
|
|
|
|
|
2 |
2 |
|
|
3 |
5 |
|
|
|
|
|
3 |
3 |
|
|
2 |
5 |
|
|
|
|
|
4 |
4 |
|
|
1 |
5 |
|
|
|
|
|
5 |
5 |
|
|
0 |
5 |
|
|
|
|
|
ВЫВОДЫ:
1. На основании полученных результатов постройте график зависимости условной скорости реакции от концентрации.
17
2.Сделайте вывод о порядке исследуемой реакции в целом; запишите суммарные уравнения реакции и ее стадии; покажите, какой стадией определяется скорость суммарного процесса.
3.Сделайте вывод о результате, полученном на практике.
ОПЫТ 2. Зависимость скорости реакции от температуры
В две пробирки налейте по 5 мл 0,1 М раствора Na2S2O3, в
другие две пробирки – по 5 мл 1 М серной кислоты. Одну пару пробирок с H2SO4 и Na2S2O3 поместите в стакан с водой при температуре 30оС, другую пару пробирок – в стакан с водой при температуре 40оС на 10 минут. Слейте в пустой стаканчик пару пробирок с H2SO4 и Na2S2O3 и отсчитайте время до появления мути.
То же сделайте с другой парой. В этом опыте учтите результат предыдущего опыта при сливании 5 мл H2SO4 и 5 мл Na2S2O3 при комнатной температуре.
|
|
|
Таблица 5 |
|
№ пп |
t, оС |
Время помутнения τ, с |
Относит. скорость 1/τ, с-1 |
|
1 |
20 |
|
|
|
2 |
30 |
|
|
|
3 |
40 |
|
|
|
ВЫВОДЫ:
1.Постройте график зависимости условной скорости от температуры.
2.Сделайте вывод о влиянии температуры на скорость.
3.Рассчитайте температурный коэффициент реакции по правилу Вант-Гоффа.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Что называется скоростью химической реакции? Математическое выражение скорости гомогенных и гетерогенных реакций.
2.От каких факторов зависит скорость химических реакций?
3.Классификация сложных химических реакций.
4.Закон действующих масс.
5.Молекулярность реакции.
6.Порядок реакции.
7.Как влияет температура на скорость химической реакции? Правило Вант-Гоффа.
18
8.Теория активации, уравнение Аррениуса.
9.Определите молекулярность и порядок прямой и обратной реакций:
ВаСО3 к ↔ ВаО к + СО2 г.
10.Во сколько раз изменится скорость реакции разложения
оксида серы (VI): 2SO3 г ↔ 2SO2 г + СО2 г при уменьшении объема в три раза?
ЛИТЕРАТУРА:
1. С. 396-405; 2. С. 57-58; 3. С. 101-115; 4. С. 59-60, 65-67; 5. С. 32-36; 6. С. 97-106.
19
РАБОТА 5. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Тема «Химическое равновесие» логически связана с изучением медико-биологических дисциплин: нормальной физиологии, пат.анатомии, эпидемиологии и др. Ее изучение необходимо для понимания сущности равновесных процессов метаболизма. Например, обмен О2 и СО2 между кровью и тканями – равновесные процессы, характеризующиеся определенными константами равновесия (Кр). Изменение парциального давления газов приводит к смещению химических равновесий метаболических процессов. Резкое смещение химических равновесий может вызвать смерть. Например, это может произойти, если больному эмфиземой легких ввести кислород с высокой скоростью.
ЦЕЛЬ ЗАНЯТИЯ:
Научиться применять закон действующих масс при расчете равновесных концентраций веществ по значениям констант равновесия обратимых химических реакций; определять направление смещения химического равновесия при изменении условий (С, Т, Р).
ЗАДАНИЕ:
Выполните три лабораторных опыта и составьте отчет по теме.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
Опыт 1. Влияние температуры на химическое равновесие
Выполнение: Для проведения опыта берут два сообщающихся сосуда, заполненных смесью газов NO2 и N2O4. При комнатной температуре протекает обратимая реакция:
2NO2 г ↔ N2O4 г
бурый бесцветный
Один сосуд опускают в кристаллизатор с горячей водой, другой
– в кристаллизатор со льдом или снегом. Наблюдают изменение цвета газовой смеси в сосудах.
ВЫВОДЫ:
1.Запишите, какие наблюдения сделаны в опыте.
2.В какую сторону сдвинулось равновесие в системе при нагревании, при охлаждении?
20
3.Дайте пояснение наблюдаемому явлению на основании принципа Ле-Шателье.
4.На основании смещения равновесия определите знак теплового эффекта реакции.
Опыт 2. Влияние концентрации на химическое равновесие
Выполнение: В каждую из четырех пробирок налейте по 1 мл
раствора хлорида железа и добавьте по 1 мл роданида калия (КSСN), затем в первую пробирку добавьте несколько кристаллов КSСN, во вторую – несколько кристаллов FeCl3, в третью – несколько кристаллов KCl. Четвертая пробирка – для сравнения цвета растворов в пробирках. Наблюдайте изменение цвета растворов.
ВЫВОДЫ:
1.Запишите наблюдения, сделанные в опыте.
2.Запишите реакцию между FeCl3 и КSСN и константу равновесия реакции.
3.На основании изменения цвета растворов объясните смещение равновесия в реакции при изменении концентрации веществ с помощью закона действующих масс и К равновесия.
Опыт 3. Влияние одноименных ионов на степень ионизации слабых электролитов
Выполнение: В пробирку налейте 1 мл уксусной кислоты (СН3СООН). Определите рН раствора СН3СООН. Для этого каплю кислоты нанесите на универсальную индикаторную бумагу. Затем в пробирку добавьте несколько кристаллов
ацетата натрия (CH3COONa), перемешайте до полного растворения и снова определите рН раствора.
ВЫВОДЫ:
1.Запишите уравнение реакции ионизации уксусной кислоты и выражение константы ионизации.
2.Определите направление смещения равновесия по данным изменениям рН раствора при добавлении соли СН3СООNa.
3.Объясните смещение равновесия на основании закона действующих масс.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Характеристика состояния равновесия. Основные признаки.
2.Запись констант равновесия: Кс, Кр, Ка.
21
3.От каких факторов зависит константа равновесия?
4.Характеристика состояния равновесия с точки зрения термодинамики. Направление реакций.
5.Уравнение изотермы химической реакции. Анализ уравнения.
6.Запишите константу равновесия реакций:
СО2 г + С т ↔ 2СО г
2Fе к + 3Н2О ↔ Fe2О3 к + 3Н2 г
7.Рассчитайте константу равновесия реакции: СО г + Сl2 г ↔ СОСl2 г, если исходные концентрации оксида углерода (II) и хлора составляли 2 моль/л и равновесная концентрация фосгена 2моль/л.
8.Как следует изменить концентрацию НСl и давление в системе, чтобы повысить выход хлора в реакции:
4НСl г + О2 г ↔ 2Н2О г + 2Сl2 г?
9.Объясните смещение равновесия при повышении температуры
с точки зрения кинетики и термодинамики:
N2 г +3Н2 г ↔ 2NН3 г, ∆Н<0
ЛИТЕРАТУРА:
1. С. 32-40; 2. С. 80-90; 4. С. 70; 5. С. 27-32; 6. С. 109-250.
22
РАБОТА 6. ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Комплексные соединения – наиболее обширный и разнообразный класс соединений. Они широко распространены в природе, играют важную роль в биологических процессах. Микроэлементы Со, Мо, Си, Мn и др. в организме в основном находятся в виде комплексных соединений. Различные ферменты, витамины, гормоны представляют собой комплексные соединения. Комплексные соединения находят разнообразное практическое применение. Так, образование хелатных комплексов используется при умягчении жесткой воды, растворении камней в почках, выведении металлов-ядов из организма. Знание темы «Комплексные соединения» необходимо при изучении биохимии, фармакологии, судебной медицины, гигиенических и некоторых клинических дисциплин.
ЦЕЛЬ ЗАНЯТИЯ:
Изучить способы получения комплексных соединений. Научиться записывать формулы комплексных соединений, называть их, классифицировать, показывать образование связей в комплексных ионах.
ЗАДАНИЕ:
Выполните пять лабораторных опытов, ответьте по каждому опыту на следующие вопросы:
1.Напишите уравнение реакции получения комплексного иона.
2.Рассчитайте заряд комплексного иона.
3.Рассчитайте степень окисления комплексообразователя.
4.Укажите координационное число.
5.Укажите лиганды.
6.Объясните механизм процесса комплексообразования и тип гибридизации центрального атома.
7.Укажите класс комплексного соединения.
8.Назовите комплексное соединение.
9.Оформите отчет по теме. Сделайте вывод о методах получения комплексных соединений.
23
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
Опыт 1. Получение комплексного соединения меди
[Сu(H2O)4]SO4
Поместите в пробирку несколько кристаллов сульфата меди (белый порошок). Добавьте несколько капель воды. Наблюдайте появление голубой окраски комплексного соединения.
Опыт 2. Получение комплексного соединения меди
[Cu(NH3)4]SO4
К3-4 каплям сульфата меди (II) по каплям добавьте раствор аммиака до образования осадка основной соли меди (CuOH)2SO4.
Косадку прилейте избыток раствора аммиака. Наблюдайте
растворение осадка и получение сине-фиолетового раствора, содержащего комплексные ионы [Cu(NH3)4]2+.
Опыт 3. Получение внутрикомплексного соединения кобальта
(II)
Поместите в пробирку несколько кристаллов карбоната кобальта (II). Добавьте на кончике шпателя глютаминовой кислоты. Прилейте к содержимому пробирки 4-5 капель воды и нагрейте на спиртовке до окончания выделения углекислого газа. Получившийся розовый раствор указывает на образование глютамата кобальта (II).
Опыт 4. Получение комплексного соединения ртути K2[HgI4]
К3-4 каплям нитрата ртути (II) добавьте раствор иодида калия до образования ярко-красного осадка иодида ртути (II). К полученному осадку прилейте избыток иодида калия до растворения образовавшегося осадка и появления желтоватого раствора, содержащего ионы [HgI4]2-.
Опыт 5. Получение комплексного соединения алюминия
Na3[Al(OH)6]
К3-4 каплям раствора сульфата алюминия по каплям добавьте раствор NaOH до образования белого осадка гидроксида алюминия. К осадку прилейте избыток раствора NaOH. Наблюдайте растворение осадка с образованием раствора комплексного соединения.
24
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Какие соединения называются комплексными?
2.Какова структура комплексного соединения?
3.Как определяется заряд комплексного иона, комплексообразователя?
4.Как определяется координационное число комплексообразователя?
5.Какие частицы могут выполнять роль комплексообразователя? лиганда?
6.Каков характер связей в комплексных соединениях? Их поведение в растворах.
7.По каким признакам классифицируются комплексные соединения?
8.Номенклатура комплексных соединений.
|
|
|
|
|
|
Таблица 6 |
|
|
|
|
|
|
|
|
|
Формула соли, название |
Класс |
Уравнение реакции |
Заряд комплексного иона |
Степень окисления комплексообразователя |
Координационное число комплексообразователя |
Тип гибридизации |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛИТЕРАТУРА:
1. С. 191-203; 2. С. 219-227; 5. С. 24-26; 6. С. 243-261.
25
РАБОТА 7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬ- НЫЕ СВОЙСТВА СОЕДИНЕНИЙ МАРГАНЦА
Окислительно-восстановительные реакции относятся к числу наиболее распространенных химических реакций в природе и в живых организмах. Дыхание, горение, гниение, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других биологических процессов – в основе своей окислительно-восстановительные. Важнейшие биохимические процессы связаны с переносом электронов и протонов и осуществляются при помощи строго определенного ряда ферментов-переносчиков. Каждому звену этой цепи соответствует определенное значение редокс-потенциала. Строгая последовательность ферментов в цепи окисления исключает резкую разницу между потенциалами взаимодействующих систем. Это обусловливает постепенное выделение энергии. Знание этой системы необходимо для изучения биохимии, нормальной и патологической физиологии.
ЦЕЛЬ ЗАНЯТИЯ:
Научиться составлять уравнения окислительно-восстанови- тельных реакций ионно-электронным методом, определять направление реакций, пользуясь величинами нормальных окислительно-восстановительных потенциалов. Изучить, как изменяются окислительно-восстановительные свойства элемента и его соединений с изменением степени окисления.
ЗАДАНИЕ:
1.Выполните лабораторные опыты согласно методическим указаниям к проведению работы.
2.Запишите уравнение протекающих реакций. Пользуясь ионноэлектронным методом, расставьте в них коэффициенты.
3.По таблице найдите значения соответствующих редокспотенциалов и подтвердите направление реакций.
4.На основании проделанных опытов сделайте вывод о том, как изменяются окислительные и восстановительные свойства соединений марганца в разной степени окисления.
26
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
ОПЫТ 1. К 1-2 каплям раствора МnSO4 прилейте 8-10 капель 6М раствора НNO3 и добавьте на конце шпателя NaBiO3. Смесь нагрейте почти до кипения. Прилейте 8-10 капель воды и выдержите, не встряхивая, 1 мин. Появление красно-фиолетовой окраски указывает на образование в растворе ионов МnО4-. Напишите уравнение окислительно-восстановительной реакции и укажите роль MnSO4.
ОПЫТ 2. Расплавьте немного твердого гидроксида калия в фарфоровой чашке, прибавьте диоксид марганца и нитрат калия, нагрейте до полного расплавления (при этом весь сплав должен равномерно окраситься в зеленый цвет вследствие образования манганата калия). После охлаждения растворите в воде. Укажите роль MnO2.
ОПЫТ 3. (Опыт демонстрационный, проводить в вытяжном шкафу). К небольшому количеству диоксида марганца прилейте 3-4 капли концентрированной соляной кислоты. Наблюдайте выделение хлора, докажите, что выделившийся газ – хлор (по появлению бурого пятна I2 на бумаге, смоченной иодидом калия). Напишите уравнения окислительно-восстановительных реакций. Укажите роль МnО2 в каждой реакции.
ОПЫТ 4. К 3-4 каплям раствора перманганата калий прибавьте 2-3 капли раствора серной кислоты и 3-4 капли сульфита натрия. Наблюдайте происходящее изменение. Напишите уравнение окислительно-восстановительной реакции. Укажите роль КМnО4.
27
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Пользуясь таблицей потенциалов, составьте уравнение реакции, в которой РbO2 является окислителем.
2.Пользуясь таблицей потенциалов, составьте уравнение реакции, в которой Н2SO3 является восстановителем.
3.Какая реакция произойдет, если две равновесные системы привести в контакт:
О2+2Н++2е ↔ Н2О2, |
|
|
|
|
Ео = 0,69 В |
|
|
|
|||
НВrО3+5Н++6е ↔ Вr-+3Н2О, |
Ео = 1,42 В? |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Таблица 7 |
||
|
|
|
|
ФОРМА ОТЧЕТА |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Окислитель |
Восстановитель |
|
Среда |
|
Условияпроведения опыта |
Наблюдения |
Уравнения полуреакцийс указаниемЕ |
Уравненияреакций |
|
Выводы |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛИТЕРАТУРА:
1.С. 131-139; 2. С. 231-241; 4. С. 129-135; 5. С. 89-94; 6. С. 208215.
28
