
Задачи Крюкова / Растворы электролитов 6
.docxВ 100 г воды растворены 5 г КCl и 5 г FeCl3. Рассчитайте среднеионный коэффициент активности хлорида калия в этом растворе.
Решение.
Рассчитаем моляльности компонентов раствора:

 -
масса компонента раствора,
-
масса компонента раствора,
 -
масса растворителя,
-
масса растворителя,
 -
молярная масса компонента.
-
молярная масса компонента.
 .
.
 ,
,
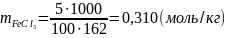 .
.
Для расчёта среднеионного коэффициента воспользуемся вторым приближением уравнения Дебая-Хюккеля:

Приближенный расчет выполним по формуле

Найдем ионную силу раствора:



Тогда,
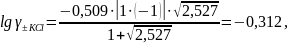

Ответ:

2. Вычислите pH раствора, состоящего из 0,01 моль ацетата натрия, 0,003 моль уксусной кислоты в 100 мл раствора. Константа диссоциации уксусной кислоты – 1,75∙10-5.
Решение.
pH
раствора определяется формулой
 или
или
 при допущении незначительных отклонений
от идеальности.
при допущении незначительных отклонений
от идеальности.
Концентрация ионов водорода:
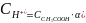 .
.
В
присутствии ацетата натрия
 .
.
Т.к.
количество ацетат-ионов, образующееся
при диссоциации
 гораздо меньше количества ацетат-ионов,
образующееся при диссоциации ацетата
натрия, их вкладом можно пренебречь.
гораздо меньше количества ацетат-ионов,
образующееся при диссоциации ацетата
натрия, их вкладом можно пренебречь.

Так
как термодинамическая константа
равновесия не зависит от наличия и
концентрации посторонних ионов,
 найдем
из уравнения, пренебрегая уменьшением
количества уксусной кислоты по сравнению
с исходным количеством:
найдем
из уравнения, пренебрегая уменьшением
количества уксусной кислоты по сравнению
с исходным количеством:

Отсюда

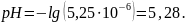
Ответ:
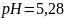 .
.
3. Твёрдая фаза какого состава и в каком количестве (в кг) выкристаллизуется при охлаждении раствора фенол-анилин массой 150 кг, содержащего 95 мол.% анилина, от 300 до 262 оС? Какой состав будет иметь раствор при конечной температуре? Изобразите схематично кривые охлаждения растворов следующего состава: 21% анилина (эвтектика), 60% анилина, 100% фенола.
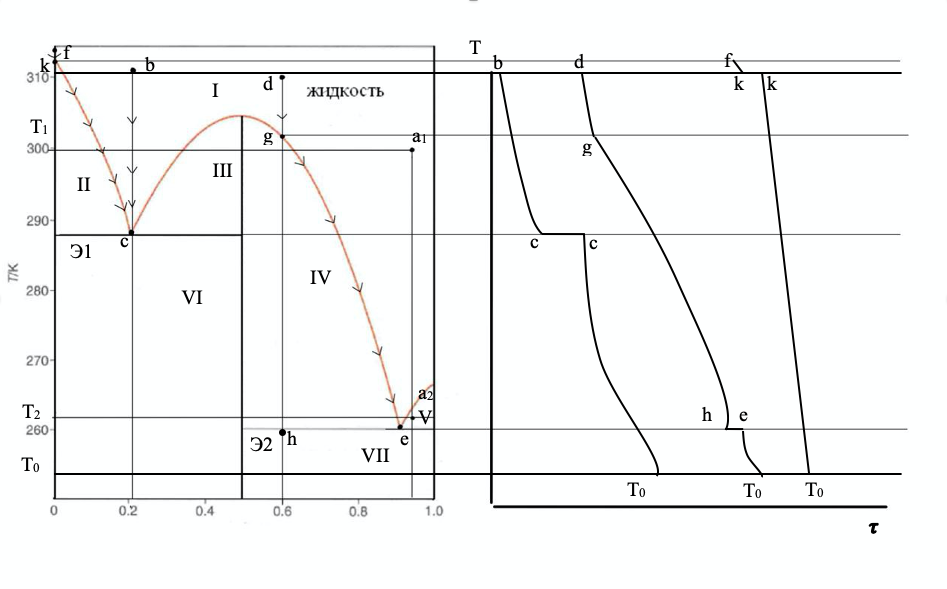
a) Найдем положение первой фигуративной точки на диаграмме, для этого определим точку пересечения изотермы 300oC c линией, выходящей из оси составов при 95% мол. анилина. Получим фигуративную точку а1. Точка находится в области жидкого расплава, содержащего анилин и фенол. Аналогичным способом найдем положение второй фигуративной точки для изотермы 262оС, получим точку а2. Точка находится в гетерогенной системе, в равновесии находятся жидкий расплав и кристаллы анилина. Выкристаллизуется анилин.
По правилу рычага находим:
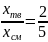
Рассчитаем среднюю молярную массу смеси:

 молярные
массы анилина и фенола соответственно,
молярные
массы анилина и фенола соответственно,
 – молярные
доли анилина и фенола соответственно.
– молярные
доли анилина и фенола соответственно.

Общее количество молей смеси:

Тогда количество выкристаллизовавшихся молей анилина:

Масса выкристаллизовавшегося анилина:

б)
Кривая
 соответствует охлаждению
раствора
21% анилина (эвтектика),
соответствует охлаждению
раствора
21% анилина (эвтектика),
 - 60%
анилина,
- 60%
анилина,
 - 100%
фенола.
- 100%
фенола.
Ответ:
выкристаллизуется
 кг
анилина.
кг
анилина.
Комментарии
Задача 1.
1)
Обозначение
 было введено ввиду того, что в формуле
моляльности используется масса
компонента, обозначаемая
было введено ввиду того, что в формуле
моляльности используется масса
компонента, обозначаемая
 .
.
2) Рассмотрим кривую зависимости среднеионного коэффициента KCl от концентрации (KCl имеет обозначение ) [1].

Из графика видно, что кривая зависимости для KCl не достигает минимума и при моляльности 1 моль/кг, поэтому можно сделать вывод, что среднеионный коэффициент KCl зависит от концентрации не так сильно.
