
механизмы лекция 2
.pdf
Факторы, влияющиена протекание химическойреакции
Температура
|
Распределение Максвелла- |
|
Больцмана |
→ |
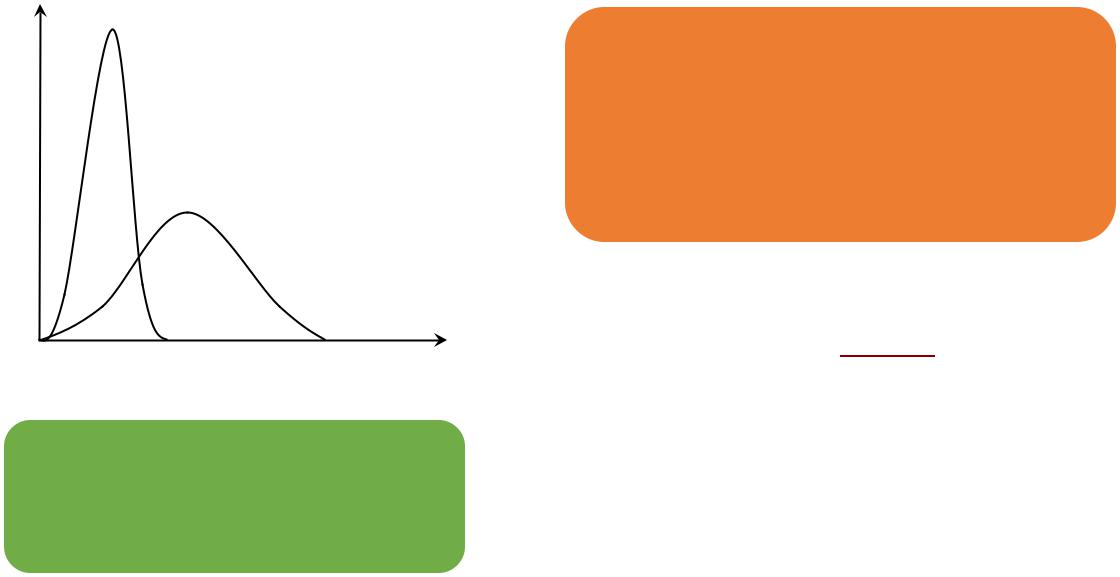
Низкая температура |
молекул |
|
Доля |
Высокая температура |
|
Скорость молекул →
УравнениеАррениуса:
= −
Правило Вант-Гоффа:
Скорость химической реакции увеличивается в 2-4 раза при увеличении температуры на каждые 100 .
|
|
|
|
|
|
− |
Температурныйкоэффициент |
||||||
|
|
|
|
|
|
|
– температурный |
коэффициент Вант-Гоффа, |
|||||
= |
|
|||||
массы на 10°С( |
|
|
). |
|
||
показывает во сколько |
раз возросласкорость |
|||||
химической |
|
2 > 1 |
принагревании реакционной |
|||
реакции |
|
|||||
Давлениевгазофазныхреакциях
Если в реакции участвуют газообразныевещества, то повышение давления равносильно увеличению концентрации.
При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действующих масс возрастает.
При понижении давления газ расширяется, и его концентрация в системе падает, это вызывает уменьшение скорости реакции.
= |
принципом ЛеШателье-Брауна |
|
Уравнение Менделеева-Клапейрона |
Для равновесных газофазных реакций |
|
= = |
|
влияние давление определяется |
+ ↔ |
||
|
|
+ ↔ |
|
|
− − ↔ + − = |

Давлениев жидкофазныхреакциях
При образовании активированного комплекса объем
молекулы изменяется на величину объема активации. |
|
|
||||||
Для деформации среды на эту величину требуетсязатратить |
||||||||
дополнительную |
энергию ∆ , на которую и увеличивается |
|
|
|||||
энергия активации реакции |
|
. |
|
|
|
|
|
|
|
|
|
|
ln , |
= − |
∆ ≠ |
|
|
|
|
|
|
|
||||
|
|
- объем активации |
|
|||||
|
∆≠ |
|
> 0 |
|
|
|
||
|
|
– повышение давления снижает скорость |
||||||
|
∆≠ |
|
– повышение давления повышает скорость |
|||||
|
∆≠ |
|
< 0 |
|
|
|
|
|

Сольватацияи влияниерастворителя
Сольватация (от латинского solvo — растворяю) — электростатическое взаимодействие между частицами растворенного вещества и растворителем
Растворимостьвещества в том или
∆ |
- ∆ = ∆ − |
∆ |
|
ином растворителеопределяет |
|||
энергия Гиббса сольватации |
|||
∆ |
- тепловой |
эффект |
сольватации |
|
|||
энтропиясольватации
!Химическую реакцию нельзя рассматривать отдельноот среды
!Выбор растворителя для проведения конкретной реакции всегдаимеет строгое научное обоснование
Сольватация подразумевает совокупность энергетических и структурных изменений
в растворе при взаимодействии частиц растворенного вещества с молекулами растворителя

Сольватацияи влияниерастворителя
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|||
|
|
|
|
|
|
|
|
|
Первичная сольватная |
|
|
оболочка |
|
|
|
оболочка |
|
|
Вторичная сольватная |
|
Координационное число |
|
|
сольватации – количество молекул |
|
|
растворителяв первичной оболочке |
|
|
сольвата, зависитотприроды |
|
растворителяи растворенного вещества.
Субстрат
Реагент
Растворитель
Целевой Побочный продукт продукт 2 Побочный продукт 1
Возникающиемежмолекулярныевзаимодействия между растворенными веществами и растворителеммогуткак ускорять,так и замедлять процесс химическоговзаимодействия.

Сольватацияи влияниерастворителя
Сольватация растворенной частицы сопровождается изменением распределения электронной плотности какэтой частицы, так и молекул растворителя
Важнейшие
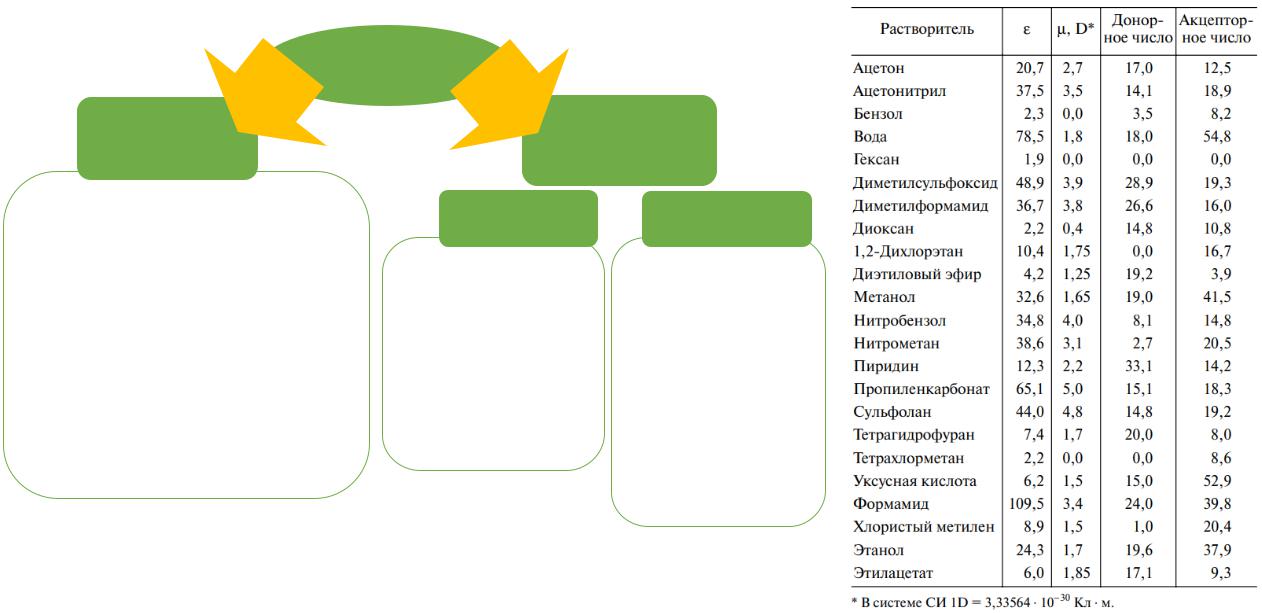
Диэлектрическаяпроницаемость(ДП)
Сольватация существенным образом сказывается на реакционной способности частиц. Для того чтобы произошла реакция, необходима энергия, разрушающая сольватную оболочку реагирующих молекул.
Сольватация промежуточных и конечных продуктов может датьвыигрыш в энергии, стимулирующий ход химической реакции.
характеристики растворителей:
показывает, во сколько раз уменьшается сила электростатического взаимодействия частиц, находящихся в некоторой |
|||||
|
> 50 |
с |
|
средняя ДП |
|
среде, по сравнению с вакуумом |
|||||
|
= 12– 50 |
|
|
||
|
|
|
высокая ДП |
||
При < 12 |
|
|
|
|
|
|
|
низкая ДП |
|||
|
увеличении |
|
растворитель становится, как правило, более полярным. |
||
Дипольный момент µ
представляет собой векторную сумму диполей связей в молекулах. ДП связана с дипольным моментом жидкости и в общем случае наблюдается симбатность изменения этих величин.
Вязкостьоказывает влияние на процессы переноса в растворах.
Плотностьучитывают при расчете термодинамических характеристикжидких систем.
Электропроводимостьважнадля электрохимических процессов.
Температурыкипенияи плавленияопределяют температурный режим процесса и легкость удаления
растворителя от продуктов реакции.
Сольватацияи влияниерастворителя
Растворители
Донорные (основные)
•N-основания (амины, амиды),
•О-основания (простые и сложные эфиры, спирты, альдегиды и кетоны),
•S-основания (тиоэфиры, тиоспирты, сульфоксиды),
•Р-основания (производные трехвалентного фосфора)
Акцепторные (кислотные)
Протонные |
Апротонные |
Минеральные |
Галогениды |
кислоты, |
элементов III–IV |
карбоновые |
групп |
кислоты, спирты, |
Периодической |
фенолы, |
системы, |
хлороформ, |
уксусный |
пентахлорэтан |
ангидрид, |
|
нитробензол, |
|
нитрометан |

Сольватацияи влияниерастворителя
Прихарактеристикерастворителей по их донорно-акцепторным свойствам их не следует априорносвязывать с их кислотностьюи основностью,определяемыми на основании электронного строения молекулрастворителя.
Донорностьили акцепторность растворителяопределяютсятолькохарактером их взаимодействияв системерастворитель – растворенное вещество. Количественно донорные или акцепторные свойстварастворителейопределяютсясоответственно донорными и акцепторными числами.
Обширнаягруппарастворителей(вода, спирты)часто выступает в роли какэлектронодонора,так и электроноакцептора (проявляет амфотерныйхарактер) в зависимостиот свойств рассматриваемой системы.
Комбинируярастворителии их соотношения, можно подобрать смешанный растворительс заданными характеристикамикак по диэлектрическойпроницаемости,так и подонорноакцепторным свойствам.

Сольватацияи влияниерастворителя
В процессах сольватации может происходить перераспределение электронной плотности, что должно приводить к ослаблению или упрочнению химических связей.
Полярные растворители, облегчающие разделение зарядов, благоприятствуют реакциям, включающим гетеролитическое расщепление.
Неполярные растворители благоприятствуют радикальным реакциям.
Растворители кислотного характера благоприятствуют протеканию реакций электрофильного типа с образованием карбокатиона. Из-за кислого характера растворитель способен сольватировать нуклеофильные анионы и может также облегчать анионоидный отрыв при реакциях замещения.
Если растворитель будетсвязывать катион, оставляя анион несольватированным, то он должен сильно стимулировать нуклеофильные реакции.
